Isomería cis-trans
Isomerismo cis-trans, también conocido como isomerismo geométrico o isomerismo configuracional b> es un término utilizado en química que se refiere a la disposición espacial de los átomos dentro de las moléculas. Los prefijos "cis" y "trans" son del latín: "este lado de" y "el otro lado de", respectivamente. En el contexto de la química, cis indica que los grupos funcionales (sustituyentes) están en el mismo lado de algún plano, mientras que trans transmite que están en lados opuestos (transversales).. Los isómeros cis-trans son estereoisómeros, es decir, pares de moléculas que tienen la misma fórmula pero cuyos grupos funcionales están en diferentes orientaciones en el espacio tridimensional. La notación cis-trans no siempre corresponde a la isomería E-Z, que es una descripción estereoquímica absoluta. En general, los estereoisómeros cis–trans contienen dobles enlaces que no giran, o pueden contener estructuras de anillo, donde la rotación de los enlaces está restringida o impedida. Los isómeros cis y trans se encuentran tanto en moléculas orgánicas como en complejos de coordinación inorgánicos. Los descriptores Cis y trans no se utilizan para casos de isomería conformacional en los que las dos formas geométricas se interconvierten fácilmente, como en la mayoría de las estructuras de enlace simple de cadena abierta; en su lugar, los términos "syn" y "anti" son usados.
El término "isomerismo geométrico" es considerado por la IUPAC como un sinónimo obsoleto de isomería "cis–trans.
Química orgánica
Cuando los grupos sustituyentes están orientados en la misma dirección, el diastereómero se denomina cis, mientras que, cuando los sustituyentes están orientados en direcciones opuestas, el diastereómero se denomina trans . Un ejemplo de un hidrocarburo pequeño que muestra isomería cis–trans es el but-2-eno.
Los compuestos alicíclicos también pueden mostrar isomería cis–trans. Como ejemplo de un isómero geométrico debido a una estructura de anillo, considere el 1,2-diclorociclohexano:
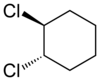 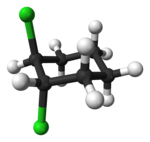 | 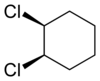  |
| trans-1,2-diclorociclohexano | cis-1,2-diclorociclohexano |
Comparación de propiedades físicas
Los isómeroscis y trans a menudo tienen diferentes propiedades físicas. Las diferencias entre los isómeros, en general, surgen de las diferencias en la forma de la molécula o el momento dipolar general.
 |  |
| cis-2-pentenos | trans-2-pentenos |
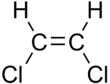 |  |
| cis-1,2-dicloroeteno | trans-1,2-dicloroeteno |
Estas diferencias pueden ser muy pequeñas, como en el caso del punto de ebullición de los alquenos de cadena lineal, como el pent-2-eno, que es de 37 °C en el isómero cis y 36 °C en el isómero trans. Las diferencias entre los isómeros cis y trans pueden ser mayores si hay enlaces polares, como en los 1,2-dicloroetenos. El isómero cis en este caso tiene un punto de ebullición de 60,3 °C, mientras que el isómero trans tiene un punto de ebullición de 47,5 °C. En el isómero cis, los dos momentos dipolares del enlace polar C-Cl se combinan para dar un dipolo molecular general, de modo que existen fuerzas intermoleculares dipolo-dipolo (o fuerzas de Keesom), que se suman a las fuerzas de dispersión de London. y elevar el punto de ebullición. En el isómero trans, por otro lado, esto no ocurre porque los dos momentos del enlace C−Cl se cancelan y la molécula tiene un momento dipolar neto cero (sin embargo, tiene un momento cuadripolar distinto de cero).
 | 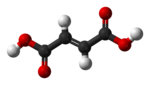 |
| cis- ácido butenedioico (ácido masculino) | trans- ácido butenedioico (ácido funerario) |
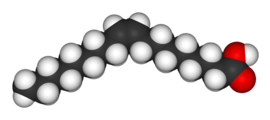 |  |
| cis-9-octadecenoico ácido (ácido oleico) | trans-9-octadecenoico ácido (ácido elédico) |
Los dos isómeros del ácido butenodioico tienen diferencias tan grandes en propiedades y reactividades que en realidad recibieron nombres completamente diferentes. El isómero cis se llama ácido maleico y el isómero trans ácido fumárico. La polaridad es clave para determinar el punto de ebullición relativo, ya que provoca un aumento de las fuerzas intermoleculares, elevando así el punto de ebullición. De la misma manera, la simetría es clave para determinar el punto de fusión relativo, ya que permite un mejor empaquetamiento en el estado sólido, aunque no altere la polaridad de la molécula. Un ejemplo de esto es la relación entre el ácido oleico y el ácido elaídico; El ácido oleico, el isómero cis, tiene un punto de fusión de 13,4 °C, lo que lo convierte en líquido a temperatura ambiente, mientras que el isómero trans, el ácido elaídico, tiene un punto de fusión mucho más alto. punto de fusión de 43 °C, debido a que el isómero trans más puro puede compactarse más y es sólido a temperatura ambiente.
Así, los alquenos trans, que son menos polares y más simétricos, tienen puntos de ebullición más bajos y puntos de fusión más altos, y los alquenos cis, que generalmente son más polares y menos simétricos, tienen puntos de ebullición más altos y puntos de fusión más bajos.
En el caso de los isómeros geométricos que son consecuencia de dobles enlaces y, en particular, cuando ambos sustituyentes son iguales, se suelen mantener algunas tendencias generales. Estas tendencias se pueden atribuir al hecho de que los dipolos de los sustituyentes en un isómero cis se sumarán para dar un dipolo molecular total. En un isómero trans, los dipolos de los sustituyentes se cancelarán debido a que están en lados opuestos de la molécula. Los isómeros trans también tienden a tener densidades más bajas que sus contrapartes cis.
Como tendencia general, los alquenos trans tienden a tener puntos de fusión más altos y una menor solubilidad en disolventes inertes, ya que los alquenos trans, en general, son más simétricos que los cis.
Las constantes de acoplamiento vecinales (3JHH), medidas por espectroscopía de RMN, son mayores para trans (rango: 12–18 Hz; típico: 15 Hz) que para los isómeros cis (rango: 0–12 Hz; típico: 8 Hz).
Estabilidad
Por lo general, para los sistemas acíclicos, los isómeros trans son más estables que los isómeros cis. Esto se debe típicamente a la mayor interacción estérica desfavorable de los sustituyentes en el isómero cis. Por lo tanto, los isómeros trans tienen un calor de combustión menos exotérmico, lo que indica una mayor estabilidad termoquímica. En el conjunto de datos de aditividad del grupo de calor de formación de Benson, los isómeros cis sufren una penalización de estabilidad de 1,10 kcal/mol. Existen excepciones a esta regla, como el 1,2-difluoroetileno, el 1,2-difluorodiazeno (FN=NF) y varios otros etilenos sustituidos con halógeno y oxígeno. En estos casos, el isómero cis es más estable que el isómero trans. Este fenómeno se denomina efecto cis.
Notación E–Z
La notaciónCis–trans no se puede utilizar para alquenos con más de dos sustituyentes diferentes. En su lugar, se usa la notación E–Z basada en la prioridad de los sustituyentes usando las reglas de prioridad de Cahn-Ingold-Prelog (CIP) para la configuración absoluta. Las designaciones estándar de la IUPAC E y Z son inequívocas en todos los casos y, por lo tanto, son especialmente útiles para los alquenos trisustituidos y tetrasustituidos para evitar cualquier confusión sobre qué grupos se identifican como cis o trans entre sí.
Z (del alemán zusammen) significa "juntos& #34;. E (del alemán entgegen) significa "opuesto" en el sentido de "opuesto". Es decir, Z tiene los grupos de mayor prioridad cis entre sí y E tiene los grupos de mayor prioridad trans el uno al otro. Las reglas del CIP determinan si una configuración molecular se designa como E o Z; los números atómicos más altos tienen mayor prioridad. Para cada uno de los dos átomos del doble enlace, es necesario determinar la prioridad de cada sustituyente. Si los dos sustituyentes de mayor prioridad están en el mismo lado, la disposición es Z; si en lados opuestos, la disposición es E.
Debido a que los sistemas cis–trans y E–Z comparan diferentes grupos en el alqueno, es no es estrictamente cierto que Z corresponda a cis y E corresponda a trans. Por ejemplo, trans-2-clorobut-2-eno (los dos grupos metilo, C1 y C4, en el esqueleto de but-2-eno son trans entre sí) es (Z)-2-clorobut-2-eno (el cloro y C4 están juntos porque C1 y C4 son opuestos).
Química inorgánica
La isomeríaCis–trans también puede ocurrir en compuestos inorgánicos, sobre todo en diazenos y compuestos de coordinación.
Diacenos
Los diazenos (y los difosfenos relacionados) también pueden presentar isomería cis–trans. Al igual que con los compuestos orgánicos, el isómero cis es generalmente el más reactivo de los dos, siendo el único isómero que puede reducir alquenos y alquinos a alcanos, pero por una razón diferente: el trans no puede alinear sus hidrógenos adecuadamente para reducir el alqueno, pero el isómero cis, que tiene una forma diferente, sí puede hacerlo.
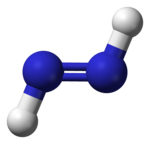  |  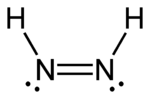 |
| trans- Decena | cis- Decena |
Complejos de coordinación
En los complejos de coordinación inorgánicos con geometrías planas cuadradas o octaédricas, también hay isómeros cis en los que ligandos similares están más juntos e isómeros trans en los que están más separados.
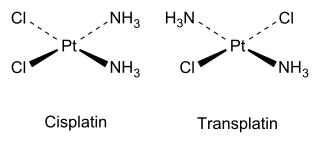
Por ejemplo, hay dos isómeros del plano cuadrado Pt(NH3)2Cl2, como lo explicó Alfred Werner en 1893 Barnett Rosenberg demostró en 1969 que el isómero cis, cuyo nombre completo es cis-diaminodicloroplatino(II), tiene actividad antitumoral y ahora es un fármaco de quimioterapia conocido por el nombre corto de cisplatino. Por el contrario, el isómero trans (transplatino) no tiene actividad anticancerígena útil. Cada isómero se puede sintetizar utilizando el efecto trans para controlar qué isómero se produce.
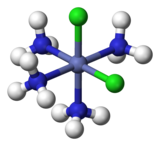
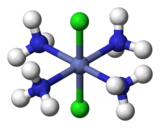
Para los complejos octaédricos de fórmula MX4Y2, también existen dos isómeros. (Aquí M es un átomo de metal, y X e Y son dos tipos diferentes de ligandos). En el isómero cis, los dos ligandos Y son adyacentes entre sí a 90°, como ocurre con el isómero cis. dos átomos de cloro mostrados en verde en cis-[Co(NH3)4Cl2] +, a la izquierda. En el isómero trans que se muestra a la derecha, los dos átomos de Cl están en lados opuestos del átomo de Co central.
Un tipo relacionado de isomería en los complejos octaédricos MX3Y3 es Isomería facial-meridional (o fac–mer), en la que diferentes números de ligandos son cis o trans para mutuamente. Los compuestos de carbonilo metálico se pueden caracterizar como fac o mer mediante espectroscopia infrarroja.
Contenido relacionado
Ecuación de Nernst
Ecuación de Arrhenius
Azeótropo