Ion halonio

Un ion halonio es cualquier ion onio que contiene un átomo de halógeno que lleva una carga positiva. Este catión tiene la estructura general R−X−R′ donde X es cualquier halógeno y no hay restricciones sobre R, esta estructura puede ser cíclica o una estructura molecular de cadena abierta. Los iones de halonio formados a partir de flúor, cloro, bromo y yodo se denominan fluoronio, cloronio, bromonio y yodonio. , respectivamente. La variedad cíclica de 3 miembros comúnmente propuesta como intermediaria en la halogenación electrófila puede denominarse iones de haliranio, utilizando el sistema de nomenclatura de Hantzsch-Widman.
Estructura
Los iones de halonio más simples tienen la estructura H−−H (X = F, Cl, Br, I). Muchos iones halonio tienen una estructura cíclica de tres átomos, similar a la de un epóxido, resultante de la adición formal de un ion halogenio X+ a un doble enlace C=C, como cuando se añade un halógeno a un alqueno. También está bien estudiada la formación de iones halonio de cinco miembros (p. ej., iones clorolanio, bromolanio) mediante la participación de grupos vecinos.
Iones diarioliodonio ([Ar2I]+< /sup>X-) son sales generalmente estables y aislables que exhiben una geometría en forma de T con los grupos arilo separados por aproximadamente 90 grados; para obtener más detalles, consulte yodo hipervalente.
La tendencia a formar puentes de iones de halonio es del orden I > Br> Cl> F. Mientras que el yodo y el bromo forman fácilmente puentes de iones de yodonio y bromonio, los iones de fluoronio se han caracterizado sólo recientemente en sistemas diseñados que fuerzan el encuentro cercano del par solitario de flúor y un centro carbocatiónico. En la práctica, estructuralmente, existe un continuo entre un halonio con puente simétrico, un halonio asimétrico con un enlace largo y débil a uno de los centros de carbono, y un verdadero β-halocarbocatión sin carácter de halonio. La estructura de equilibrio depende de la capacidad de los átomos de carbono y del halógeno para acomodar carga positiva. Por lo tanto, un ion bromonio que une un carbono primario y terciario a menudo exhibirá una estructura sesgada, con un enlace débil al centro terciario (con un carácter carbocatión significativo) y un enlace más fuerte al carbono primario. Esto se debe a la mayor estabilidad de los carbonos terciarios para estabilizar la carga positiva. En el caso más extremo, si el centro terciario es doblemente bencílico, por ejemplo, entonces puede favorecerse la forma abierta. De manera similar, el cambio de bromo a cloro también debilita el carácter puente, debido a la mayor electronegatividad del cloro y su menor propensión a compartir densidad electrónica en comparación con el bromo.
Reactividad
Estos iones suelen ser sólo intermediarios de reacción de vida corta; son muy reactivos debido a la elevada tensión del anillo de tres miembros y a la carga positiva del halógeno; esta carga positiva los convierte en grandes electrófilos. En casi todos los casos, el ion halonio es atacado por un nucleófilo en muy poco tiempo. Incluso un nucleófilo débil, como el agua, atacará al ion halonio; así es como se pueden producir las halohidrinas.
En ocasiones, un átomo de halonio se reorganiza en un carbocatión. Esto suele ocurrir sólo cuando ese carbocatión es un carbocatión alílico o bencílico.
Historia
Los iones halonio fueron postulados por primera vez en 1937 por Roberts y Kimball para explicar la anti diastereoselectividad observada en reacciones de adición de halógeno a alquenos. Argumentaron correctamente que si el intermediario de la reacción inicial en la bromación es la especie de cadena abierta X–C–C+, la rotación alrededor del enlace simple C–C sería posible y conduciría a una mezcla de cantidades iguales de isómero sin dihalógeno y antiisómero, lo cual no es el caso. También afirmaron que un átomo de halógeno cargado positivamente es isoelectrónico con el oxígeno y que el carbono y el bromo tienen potenciales de ionización comparables. Para ciertos alquenos sustituidos con arilo, la estereoespecificidad anti disminuye o se pierde, como resultado del carácter de halonio debilitado o ausente en el intermedio catiónico.
En 1970, George A. Olah logró preparar y aislar sales de halonio añadiendo un haluro de metilo como bromuro de metilo o cloruro de metilo en dióxido de azufre a -78 °C a un complejo de pentafluoruro de antimonio y tetrafluorometano en dióxido de azufre. Después de la evaporación del dióxido de azufre, este procedimiento dejó cristales de [H3C––CH3][SbF6]–< /sup>, estable a temperatura ambiente pero no a la humedad. Recientemente se caracterizó un ion fluoronio en fase de solución (disuelto en dióxido de azufre o fluoruro de cloruro de sulfurilo) a baja temperatura.
Los iones cloronio, bromonio y yodonio cíclicos y acíclicos se han caracterizado estructuralmente mediante cristalografía de rayos X, como el catión bromonio derivado del bi(adamantilideno) que se muestra a continuación.
 | 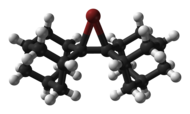 |
| fórmula esquelética | modelo de bola y palo |
No existen compuestos que contengan iones de halonio trivalentes o tetravalentes, pero para algunos compuestos hipotéticos se ha probado computacionalmente la estabilidad.
Referencias
- ^ a b c IUPAC, Compendio de Terminología Química, 2a edición. (el "Gold Book") (1997). Versión corregida en línea: (2006–) "Halonium ions". doi:10.1351/goldbook.H02728
- ^ Peterson, Paul E. (1971-12-01). "Cyclic halonium ions with five-membered rings". Accounts of Chemical Research. 4 (12): 407–413. doi:10.1021/ar50048a003. ISSN 0001-4842.
- ^ Sadek, Omar; Perrin, David M.; Gras, Emmanuel (2019-06-01). "Salas de feniltrifluoroboato de diaryliodonio unsimétrico: Síntesis, estructura y fluoración". Journal of Fluorine Chemistry222–223: 68–74. doi:10.1016/j.jfluchem.2019.04.004. ISSN 0022-1139. S2CID 132289845.
- ^ Bruice, Paula Yurkanis (2014). Química Orgánica (7a edición). Pearson Education. ISBN 978-0-321-80322-1.
- ^ Roberts, Irving; Kimball, George E. (1937). "La Halogenación de Etilenos". J. Am. Chem. Soc. 59 (5): 947. doi:10.1021/ja01284a507.
- ^ Olah, George A.; DeMember, John R. (1970). "Friedel-Crafts química. V. Isolación, carbono-13 resonancia magnética nuclear y estudio espectroscópico láser Raman de fluoroantimonatos de dimetilalonio". J. Am. Chem. Soc. 92 (3): 718. doi:10.1021/ja00706a058.
- ^ Pitts, Cody Ross; Holl, Maxwell Gargiulo; Lectka, Thomas (2018). "Caracterización espectroscópica de un ión de fluoronio [C–F–C]+ en solución". Angew. Chem. 130 (7). doi:10.1002/ange.201712021.
- ^ Mori, T.; Rathore, R. (1998). "X-Ray structure of bridged 2,2′-bi(adamant-2-ylidene) chloronium cation and comparison of its reactividad with a singly bonded chloroarenium cation". ChemComm (8): 927-928. doi:10.1039/a709063c.
- ^ Brown, R. S.; Nagorski, R. W.; Bennet, A. J.; McClung, R. E. D.; Aarts, G. H. M.; Klobukowski, M.; McDonald, R.; Santarsiero, B. D. (Marzo de 1994). "Stable Bromonium and Iodonium Ions of the Hindered Olefins Adamantylideneadamantane and Bicyclo[3.3.1]nonylidenebicyclo[3.3.1]nonane. X-Ray Structure, Transfer of Positive Halogens to Acceptor Olefins, and ab Initio Studies". J. Am. Chem. Soc. 116 (6): 2448–2456. doi:10.1021/ja00085a027.
- ^ Schneider, Tobias F.; Werz, Daniel B. (2010). "La búsqueda de iones de halonio tetracoordinados: una investigación teórica". Org. Lett. 12 (21): 4844–4847. doi:10.1021/ol102059b. PMID 20923174.
