Inhibidor de la β-lactamasa
Las betalactamasas son una familia de enzimas implicadas en la resistencia bacteriana a los antibióticos betalactámicos. En la resistencia bacteriana a los antibióticos betalactámicos, las bacterias tienen betalactamasas que degradan los anillos betalactámicos, haciendo que el antibiótico sea ineficaz. Sin embargo, con los inhibidores de betalactamasas, estas enzimas en las bacterias se inhiben, permitiendo así que el antibiótico surta efecto. Las estrategias para combatir esta forma de resistencia han incluido el desarrollo de nuevos antibióticos betalactámicos que son más resistentes a la escisión y el desarrollo de la clase de inhibidores enzimáticos llamados inhibidores de betalactamasas. Aunque los inhibidores de β-lactamasas tienen poca actividad antibiótica propia, previenen la degradación bacteriana de los antibióticos betalactámicos y, por lo tanto, amplían el rango de bacterias contra las que son eficaces los medicamentos.
Usos médicos
El uso más importante de los inhibidores de beta-lactamasa es en el tratamiento de infecciones que se sabe o se cree que son causadas por bacterias gramnegativas, ya que la producción de beta-lactamasa es un contribuyente importante a la resistencia a las beta-lactamas en estos patógenos. En cambio, la mayor parte de la resistencia a las beta-lactamas en las bacterias gram-positivas se debe a variaciones en las proteínas de unión a la penicilina que conducen a una unión reducida a la beta-lactama. El patógeno gram-positivo Staphylococcus aureus produce beta-lactamasas, pero los inhibidores de beta-lactamasa desempeñan un papel menor en el tratamiento de estas infecciones porque las cepas más resistentes (Staphylococcus aureus resistente a la meticilina) también utilizan proteínas de unión a la penicilina variantes.
Mecanismo de acción
El sistema de clasificación de Ambler agrupa las enzimas beta-lactamasas conocidas en cuatro grupos según la homología de secuencia y las presuntas relaciones filogenéticas. Las clases A, C y D escinden las beta-lactamas mediante un mecanismo de varios pasos análogo al mecanismo de las serina proteasas. Al unirse, un grupo hidroxilo de serina en el sitio activo de la beta-lactamasa forma un enlace covalente transitorio con el grupo carbonilo del anillo de la beta-lactama, escindiendo el anillo de la beta-lactama en el proceso. En un segundo paso, el ataque nucleofílico de una molécula de agua escinde el enlace covalente entre la enzima y el grupo carbonilo de la antigua beta-lactama. Esto permite que la beta-lactama degradada se difunda y libere a la enzima para procesar moléculas de beta-lactama adicionales.
Los inhibidores de beta-lactamasa disponibles actualmente son eficaces contra las beta-lactamasas de clase A de Ambler (tazobactam, clavulanato y sulbactam) o contra las beta-lactamasas de clase A, C y algunas de clase D de Ambler (avibactam). Al igual que los antibióticos beta-lactámicos, son procesados por las beta-lactamasas para formar un intermediario covalente inicial. A diferencia del caso de los antibióticos beta-lactámicos, los inhibidores actúan como sustratos suicidas (tazobactam y sulbactam) que finalmente conducen a la degradación de la beta-lactamasa. Por otro lado, el avibactam no contiene un anillo beta-lactámico (inhibidor de beta-lactamasa no beta-lactámico) y, en cambio, se une de forma reversible.
Las beta-lactamasas de clase B de Ambler escinden las beta-lactamasas mediante un mecanismo similar al de las metaloproteasas. Como no se forma ningún intermediario covalente, el mecanismo de acción de los inhibidores de beta-lactamasa comercializados no es aplicable. Por lo tanto, la propagación de cepas bacterianas que expresan metalo-beta-lactamasas, como la metalo-beta-lactamasa 1 de Nueva Delhi, ha generado una considerable preocupación.
Agentes usados comúnmente
Los inhibidores de la β-lactamasa que se comercializan actualmente no se venden como fármacos individuales, sino que se formulan conjuntamente con un antibiótico β-lactámico con una semivida sérica similar. Esto se hace no sólo por conveniencia de la dosificación, sino también para minimizar el desarrollo de resistencia que podría producirse como resultado de la exposición variable a uno u otro fármaco. Las principales clases de antibióticos β-lactámicos utilizados para tratar infecciones bacterianas gramnegativas incluyen (en orden aproximado de resistencia intrínseca a la escisión por β-lactamasas) penicilinas (especialmente aminopenicilinas y ureidopenicilinas), cefalosporinas de tercera generación y carbapenémicos. Las variantes individuales de β-lactamasa pueden dirigirse a una o varias de estas clases de fármacos, y sólo un subconjunto será inhibido por un inhibidor de β-lactamasa determinado. Los inhibidores de la β-lactamasa amplían el espectro útil de estos antibióticos β-lactámicos al inhibir las enzimas β-lactamasas producidas por las bacterias para desactivarlas.
- Inhibidores β-lactamasa con núcleo β-lactam:
- Tebipenem es el primer carbapenem que se administra oralmente en forma de tebipenem-pivoxil. Estudios estructurales y cinéticos de tebipenem está disponible con M. tuberculosis beta-lactamase (BlaC).
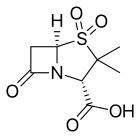
- Ácido eslavulónico o clavulanato, generalmente combinado con amoxicilina (Augmentina) o ticarcilina (Timentina)
- Sulbactam, generalmente combinado con ampicillina (Unasyn) o cefoperazone (Sulperazon)
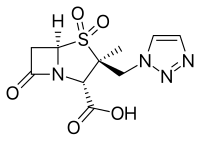
- Tazobactam, generalmente combinado con piperacilina (Zosyn, Tazocin)
- Enmetazobactam, generalmente combinado con cefepime (Exblifep)
- Inhibidores β-lactamasa con núcleo diazabiciclooctano:
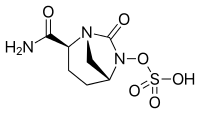
- Avibactam, aprobado en combinación con ceftazidime (Avycaz, Zavicefta), actualmente en estudio clínico para combinación con ceftaroline
- Durlobactam, aprobado en combinación con sulbactam (Xacduro) para tratar neumonía bacteriana adquirida por el hospital y neumonía bacteriana asociada con ventilador (HABP/VABP) causada por neumonía bacteriana causada por Acinetobacter baumannii-calcoaceticus complejo
- Relebactam, utilizado en combinación con imipenem/cilastatina (Recarbrio).
- Inhibidores β-lactamasa con otros tipos de núcleos no β-lactam:
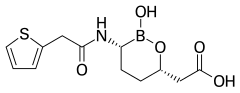
- Vaborbactam, utilizado en combinación con meropenem (Vabomere). Tiene un núcleo de ácido borónico.
Beta-lactamasa produciendo bacterias
Las bacterias que pueden producir betalactamasas incluyen, entre otras:
- Staphylococcus
- MRSA(Resistente a la meticilina Staphylococcus aureus)
- Enterobacteriaceae:
- Klebsiella pneumoniae
- Citrobacter
- Proteus vulgaris
- Morganella
- Salmonella
- Shigella
- Escherichia coli
- Haemophilus influenzae
- Moraxella catarrialis
- Neisseria gonorrhoeae
- Pseudomonas aeruginosa
- Mycobacterium tuberculosis
Research
Algunas bacterias pueden producir β-lactamasas de espectro extendido (ESBL), lo que dificulta el tratamiento de la infección y confiere resistencia adicional a las penicilinas, cefalosporinas y monobactámicos. Los derivados del ácido borónico están siendo objeto de una amplia y extensa investigación en la actualidad como nuevos inhibidores del sitio activo de las betalactamasas, ya que contienen un sitio que imita el estado de transición por el que pasan las betalactamasas cuando sufren hidrólisis a través de las betalactamasas. Se ha descubierto que, en general, encajan bien en el sitio activo de muchas betalactamasas y tienen la conveniente propiedad de no poder hidrolizarse y, por lo tanto, resultar inútiles. Este es un diseño de fármaco favorable en comparación con muchos agentes competitivos de uso clínico, porque la mayoría de ellos, como el ácido clavulánico, se hidrolizan y, por lo tanto, solo son útiles durante un período de tiempo finito. Esto generalmente hace que se necesite una concentración más alta de inhibidor competitivo que la que sería necesaria en un inhibidor no hidrolizable. Diferentes derivados del ácido borónico, como el taniborbactam, tienen el potencial de adaptarse a las diferentes isoformas de las betalactamasas y, por lo tanto, tienen el potencial de restablecer la potencia de los antibióticos betalactámicos.
Referencias
- ^ Essack SY (octubre de 2001). "El desarrollo de antibióticos beta-lactam en respuesta a la evolución de las beta-lactamasas". Pharmaceutical Research. 18 (10): 1391–9. doi:10.1023/a:1012272403776. PMID 11697463. S2CID 34318096.
- ^ "Inhibidores beta-lactamasa". Departamento de Enfermería de la Universidad Estatal de Fort Hays College of Health and Life Sciences. Octubre de 2000. Archivado desde el original el 2007-09-27. Retrieved 2007-08-17.
- ^ Georgopapadakou NH (octubre de 1993). "Proteínas de unión de penicillina y resistencia bacteriana a las beta-lactams". Agentes antimicrobianos y quimioterapia. 37 (10): 2045–53. doi:10.1128/aac.37.10.2045. PMC 192226. PMID 8257121.
- ^ Zapun A, Contreras-Martel C, Vernet T (marzo de 2008). "Proteínas de unión de penicillina y resistencia a la beta-lactam". FEMS Microbiología Reseñas. 32 2): 361–85. doi:10.1111/j.1574-6976.2007.00095.x. PMID 18248419.
- ^ Curello J, MacDougall C (julio de 2014). "Más allá Susceptible y Resistente, Parte II: Tratamiento de las Infecciones Debido a los Organismos Gram-Negativos Produciendo Extensed-Spectrum β-Lactamases". The Journal of Pediatric Pharmacology and Therapeutics. 19 3): 156 –64. doi:10.5863/1551-6776-19.3.156. 4187532. PMID 25309145.
- ^ Wolter DJ, Lister PD (2013). "Mecanismos de resistencia β-lactam entre Pseudomonas aeruginosa". Farmacéutica actual Diseño. 19 2): 209 –22. doi:10.2174/13816128130203. PMID 22894618.
- ^ Patrick, Graham L. (2017). Introducción a la química medicinal (6th ed.). Oxford, Reino Unido. ISBN 9780198749691. OCLC 987051883.
{{cite book}}: CS1 maint: localización desaparecido editor (link) - ^ Lahiri SD, Mangani S, Durand-Reville T, Benvenuti M, De Luca F, Sanyal G, Docquier JD (junio de 2013). "Introducción estructural de potente inhibición de espectro amplio con mecanismo de reciclización reversible: avibactam en complejo con CTX-M-15 y Pseudomonas aeruginosa AmpC β-lactamases". Agentes antimicrobianos y quimioterapia. 57 (6): 2496–505 doi:10.1128/AAC.02247-12. PMC 3716117. PMID 23439634.
- ^ a b Drawz SM, Bonomo RA (enero de 2010). "Tres décadas de inhibidores beta-lactamasa". Microbiología clínica Reseñas. 23 1): 160 –201. doi:10.1128/CMR.00037-09. PMC 2806661. PMID 20065329.
- ^ Biedenbach D, Bouchillon S, Hackel M, Hoban D, Kazmierczak K, Hawser S, Badal R (febrero de 2015). "Desemination of NDM metallo-β-lactamase genes among clinic isolates of Enterobacteriaceae collected during the SMART global surveillance study from 2008 to 2012". Agentes antimicrobianos y quimioterapia. 59 2): 826 –30. doi:10.1128/AAC.03938-14. PMC 4335866. PMID 25403666.
- ^ Watson ID, Stewart MJ, Platt DJ (septiembre 1988). "Clínica farmacocinética de inhibidores de enzimas en quimioterapia antimicrobiana". Farmacocinética Clínica. 15 3): 133 –64. doi:10.2165/00003088-198815030-00001. PMID 3052984. S2CID 2388750.
- ^ Hazra S, Xu H, Blanchard JS (junio de 2014). "Tebipenem, un nuevo antibiótico carbapenem, es un sustrato lento que inhibe la β-lactamasa de Mycobacterium tuberculosis". Bioquímica. 53 (22): 3671 –8. doi:10.1021/bi500339j. PMC 4053071. PMID 24846409.
- ^ "FDA aprueba nuevo tratamiento para el tracto urinario complicado y complicadas infecciones intraabdominal". Administración de Alimentos y Drogas. 17 de julio de 2019. Archivado desde el original el 20 de noviembre de 2019. Retrieved 18 de julio, 2019.
- ^ "Cilastatin/imipenem/relebactam — AdisInsight". Springer International Publicshing AG. Archivado desde el original el 31 de mayo de 2016. Retrieved 29 de abril 2016.
- ^ "FDA aprueba nuevo medicamento antibacteriano" (liberación de prensa). Administración de Alimentos y Drogas. 29 de agosto de 2017. Archivado desde el original el 23 de abril de 2019. Retrieved 18 de julio, 2019.
- ^ Livermore DM (octubre de 1995). "beta-Lactamasas en laboratorio y resistencia clínica". Microbiología clínica Reseñas. 8 4): 557–84. doi:10.1128/cmr.8.4.557. PMC 172876. PMID 8665470.
- ^ Leonard DA, Bonomo RA, Powers RA (noviembre de 2013). "Clase D β-lactamases: una reaparición después de cinco décadas". Accounts of Chemical Research. 46 (11): 2407 –15. doi:10.1021/ar300327a. PMC 4018812. PMID 23902256.
Enlaces externos
- Xu H, Hazra S, Blanchard JS (junio de 2012). "NXL104 inhibe irreversiblemente la β-lactamasa de Mycobacterium tuberculosis". Bioquímica. 51 (22): 4551 –7. doi:10.1021/bi300508r. PMC 3448018. PMID 22587688.
- Kurz SG, Wolff KA, Hazra S, Bethel CR, Hujer AM, Smith KM, Xu Y, Tremblay LW, Blanchard JS, Nguyen L, Bonomo RA (diciembre de 2013). "¿Pueden las sustituciones resistentes al inhibidor en el Mycobacterium tuberculosis β-Lactamase BlaC provocar resistencia clavulana?: una racionalidad bioquímica para el uso de combinaciones de inhibidores β-lactamasa". Agentes antimicrobianos y quimioterapia. 57 (12): 6085 –96. doi:10.1128/AAC.01253-13. PMC 3837893. PMID 24060876.