Infección por el virus del papiloma humano
infección por el virus del papiloma humano (infección por VPH) está causada por un virus ADN de la familia Papillomaviridae. Muchas infecciones por VPH no causan síntomas y el 90 % se resuelven espontáneamente en dos años. En algunos casos, la infección por VPH persiste y produce verrugas o lesiones precancerosas. Estas lesiones, dependiendo del sitio afectado, aumentan el riesgo de cáncer de cuello uterino, vulva, vagina, pene, ano, boca, amígdalas o garganta. Casi todos los cánceres de cuello uterino se deben al VPH y dos cepas, VPH16 y VPH18, representan el 70 % de los casos. HPV16 es responsable de casi el 90 % de los cánceres de orofaringe positivos para HPV. Entre el 60 % y el 90 % de los demás tipos de cáncer enumerados anteriormente también están relacionados con el VPH. HPV6 y HPV11 son causas comunes de verrugas genitales y papilomatosis laríngea.
La infección por VPH es causada por el virus del papiloma humano, un virus ADN de la familia de los papilomavirus. Se han descrito más de 200 tipos. Un individuo puede infectarse con más de un tipo de VPH, y se sabe que la enfermedad solo afecta a los humanos. Más de 40 tipos pueden propagarse a través del contacto sexual e infectar el ano y los genitales. Los factores de riesgo para la infección persistente por tipos de transmisión sexual incluyen edad temprana de la primera relación sexual, múltiples parejas sexuales, tabaquismo y función inmunológica deficiente. Estos tipos generalmente se transmiten por contacto directo sostenido de piel a piel, siendo el sexo vaginal y anal los métodos más comunes. La infección por VPH también puede transmitirse de madre a hijo durante el embarazo. No hay evidencia de que el VPH pueda propagarse a través de elementos comunes como los asientos del inodoro, pero los tipos que causan verrugas pueden propagarse a través de superficies como los pisos. Los desinfectantes y desinfectantes de manos comunes no eliminan el VPH, lo que aumenta la posibilidad de que el virus se transfiera a través de agentes infecciosos no vivos llamados fómites.
Las vacunas contra el VPH pueden prevenir los tipos de infección más comunes. Para que sea más eficaz, la inoculación debe ocurrir antes del inicio de la actividad sexual y, por lo tanto, se recomienda entre los 9 y los 13 años de edad. Las pruebas de detección del cáncer de cuello uterino, como la prueba de Papanicolaou ('papanicolau'), o el examen del cuello uterino después de aplicar ácido acético, pueden detectar tanto el cáncer temprano como las células anormales que pueden convertirse en cáncer. La detección permite un tratamiento temprano que se traduce en mejores resultados. La detección ha reducido tanto el número de casos como el número de muertes por cáncer de cuello uterino. Las verrugas genitales se pueden eliminar congelándolas.
Casi todas las personas sexualmente activas se infectan con el VPH en algún momento de sus vidas. El VPH es la infección de transmisión sexual (ITS) más común a nivel mundial. Los VPH de alto riesgo causan alrededor del 5 % de todos los cánceres en todo el mundo, con un estimado de 570 000 mujeres y 60 000 hombres que contraen un cáncer relacionado con el VPH cada año. En los Estados Unidos, ocurren alrededor de 36,000 casos de cáncer debido al VPH cada año. El cáncer de cuello uterino se encuentra entre los cánceres más comunes en todo el mundo y causó aproximadamente 604 000 casos nuevos y 342 000 muertes en 2020. Alrededor del 90 % de estos casos nuevos y muertes por cáncer de cuello uterino ocurrieron en países de ingresos bajos y medianos. Aproximadamente el 1% de los adultos sexualmente activos tienen verrugas genitales. Los casos de verrugas cutáneas se han descrito desde la época de la antigua Grecia, pero no se determinó que fueran causadas por un virus hasta 1907.
Tipos de VPH
El VPH es un grupo de más de 200 virus relacionados, que se designan con un número para cada tipo de virus. Algunos tipos de VPH, como el VPH5, pueden establecer infecciones que persisten durante toda la vida del individuo sin manifestar ningún síntoma clínico. Los tipos de VPH 1 y 2 pueden causar verrugas comunes en algunas personas infectadas. Los tipos de VPH 6 y 11 pueden causar verrugas genitales y papilomatosis laríngea.
Muchos tipos de VPH son cancerígenos. Unos catorce tipos de VPH (incluidos los tipos 16, 18, 31 y 45) se denominan de "alto riesgo" porque la infección persistente se ha relacionado con el cáncer de orofaringe, laringe, vulva, vagina, cuello uterino, pene y ano. Todos estos cánceres involucran una infección de transmisión sexual de VPH al tejido epitelial estratificado. El VPH tipo 16 es la cepa con mayor probabilidad de causar cáncer y está presente en aproximadamente el 47 % de todos los cánceres de cuello uterino, y en muchos cánceres de vagina y vulva, cánceres de pene, cánceres anales y cánceres de cabeza y cuello.
La siguiente tabla enumera los síntomas comunes de la infección por VPH y los tipos de VPH asociados.
| Enfermedad | Tipo de VPH |
|---|---|
| verrugas comunes | 2, 7, 22 |
| Plantar verrugas | 1, 2, 4, 63 |
| verrugas planas | 3, 10, 28 |
| Warts anogenital | 6, 11, 42, 44 y otros |
| Displasia anal (lesiones) | 16, 18, 31, 53, 58 |
| Cánceres genitales |
|
| Epidermodisplasia verruciformis | más de 15 tipos |
| Hiperplasia epitelial focal (mouth) | 13, 32 |
| Mouth papillomas | 6, 7, 11, 16, 32 |
| Cáncer de orofaringe | 16 |
| Verrucous cyst | 60 |
| papilomatosis laríngea | 6, 11 |
Las vacunas contra el VPH disponibles protegen contra dos, cuatro o nueve tipos de VPH. Todas las vacunas contra el VPH protegen contra al menos los tipos de VPH 16 y 18, que causan el mayor riesgo de cáncer de cuello uterino. La vacuna Gardasil original también protege contra los tipos de VPH 6 y 11. La vacuna Gardasil 9 más nueva brinda protección contra esos cuatro (6, 11, 16 y 18), junto con otros cinco tipos de VPH de alto riesgo responsables del 20 % de los cánceres de cuello uterino. (tipos 31, 33, 45, 52 y 58).
Signos y síntomas
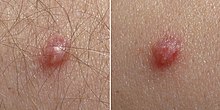
Verrugas
La infección de la piel (infección 'cutánea') por VPH está muy extendida. Las infecciones de la piel con VPH pueden causar crecimientos cutáneos no cancerosos llamados verrugas. Las verrugas son causadas por un rápido crecimiento de células en la capa externa de la piel. Si bien se han descrito casos de verrugas desde la época de la antigua Grecia, su causa viral no se conoció hasta 1907.
Las verrugas cutáneas son más comunes en la infancia y, por lo general, aparecen y desaparecen espontáneamente en el transcurso de semanas o meses. Las verrugas cutáneas recurrentes son comunes. Se cree que todos los VPH son capaces de establecer infecciones "latentes" infecciones en pequeñas cantidades de células madre presentes en la piel. Aunque es posible que estas infecciones latentes nunca se erradiquen por completo, se cree que el control inmunológico bloquea la aparición de síntomas como las verrugas. El control inmunológico es específico del tipo de VPH, lo que significa que una persona puede volverse resistente a un tipo de VPH mientras permanece susceptible a otros tipos.
Los tipos de verrugas incluyen:
- Las verrugas comunes se encuentran generalmente en las manos y los pies, pero también pueden ocurrir en otras áreas, como los codos o las rodillas. Las verrugas comunes tienen una superficie característica similar a la coliflor y suelen elevarse ligeramente por encima de la piel circundante. Los tipos de VPH cutáneos pueden causar verrugas genitales pero no están asociados con el desarrollo del cáncer.
- Las verrugas plantar se encuentran en las plantas de los pies; crecen hacia adentro, generalmente causando dolor al caminar.
- Las verrugas subunguales o periunguales se forman bajo la uñas (subungual), alrededor de la uñas, o en la cutícula (periungual). Son más difíciles de tratar que verrugas en otros lugares.
- Las verrugas planas se encuentran más comúnmente en los brazos, la cara o la frente. Como verrugas comunes, las verrugas planas ocurren con más frecuencia en niños y adolescentes. En personas con función inmune normal, las verrugas planas no están asociadas con el desarrollo del cáncer.
Las verrugas comunes, planas y plantares tienen muchas menos probabilidades de propagarse de una persona a otra.
Verrugas genitales
La infección por VPH de la piel en el área genital es la infección de transmisión sexual más común en todo el mundo. Tales infecciones están asociadas con verrugas genitales o anales (médicamente conocidas como condilomas acuminados o verrugas venéreas), y estas verrugas son el signo más fácilmente reconocible de infección genital por VPH.
Las cepas del VPH que pueden causar verrugas genitales suelen ser diferentes de las que causan verrugas en otras partes del cuerpo, como las manos o los pies, o incluso en la parte interna de los muslos. Una amplia variedad de tipos de VPH pueden causar verrugas genitales, pero los tipos 6 y 11 juntos representan alrededor del 90 % de todos los casos. Sin embargo, en total más de 40 tipos de VPH se transmiten por contacto sexual y pueden infectar la piel del ano y los genitales. Tales infecciones pueden causar verrugas genitales, aunque también pueden permanecer asintomáticas.
La gran mayoría de las infecciones genitales por VPH nunca causan ningún síntoma evidente y el sistema inmunitario las elimina en cuestión de meses. Además, las personas pueden transmitir el virus a otras incluso si no muestran síntomas evidentes de infección. La mayoría de las personas contraen infecciones genitales por VPH en algún momento de sus vidas, y alrededor del 10 % de las mujeres están infectadas actualmente. Un gran aumento en la incidencia de infección genital por VPH ocurre a la edad en que las personas comienzan a participar en la actividad sexual. Al igual que con los VPH cutáneos, se cree que la inmunidad al VPH genital es específica de una cepa específica de VPH.
Papilomatosis laríngea
Además de las verrugas genitales, la infección por los tipos 6 y 11 del VPH puede causar una afección rara conocida como papilomatosis laríngea recurrente, en la que se forman verrugas en la laringe u otras áreas del tracto respiratorio. Estas verrugas pueden reaparecer con frecuencia, pueden interferir con la respiración y, en casos extremadamente raros, pueden convertirse en cáncer. Por estas razones, puede ser aconsejable repetir la cirugía para extirpar las verrugas.
Cáncer
Estadísticas de casos
Los VPH de alto riesgo causan aproximadamente el 5 % de todos los cánceres en todo el mundo, y se estima que 570 000 mujeres y 60 000 hombres contraen un cáncer relacionado con el VPH cada año, lo que convierte al VPH en una de las causas infecciosas más importantes de cáncer. El cáncer de cuello uterino se encuentra entre los cánceres más comunes en todo el mundo y causó aproximadamente 604 000 casos nuevos y 342 000 muertes en 2020. Alrededor del 90 % de estos casos nuevos y muertes por cáncer de cuello uterino ocurrieron en países de ingresos bajos y medianos, donde las pruebas de detección y el tratamiento de los cambios tempranos de células cervicales no están fácilmente disponibles.
En los Estados Unidos, cada año se producen alrededor de 36 000 casos de cáncer debido al VPH.
| Área de cáncer | Número medio anual de casos | VPH attributed (estimated) | HPV 16/18 atribuibles (estimados) |
|---|---|---|---|
| Cervix | 11.771 | 10.700 | 7.800 |
| Oropharynx (hombres) | 12.638 | 9.100 | 8.000 |
| Oropharynx (mujeres) | 3,100 | 2.000 | 1.600 |
| Vulva | 3.554 | 2.400 | 1.700 |
| Anus (mujeres) | 3.260 | 3.000 | 2.600 |
| Anus (men) | 1.750 | 1.600 | 1.400 |
| Penis | 1.168 | 700 | 600 |
| Vagina | 802 | 600 | 400 |
| Recto (mujeres) | 513 | 500 | 400 |
| Recto (hombres) | 237 | 200 | 200 |
| Total | 38.793 | 30.700 | 24.600 |
Desarrollo del cáncer
En algunas personas infectadas, es posible que sus sistemas inmunológicos no controlen el VPH. La infección persistente con tipos de VPH de alto riesgo, como los tipos 16, 18, 31 y 45, puede favorecer el desarrollo de cáncer. Los cofactores, como el humo del cigarrillo, también pueden aumentar el riesgo de cánceres relacionados con el VPH.
Se cree que el VPH causa cáncer al integrar su genoma en el ADN nuclear. Algunos de los primeros genes expresados por el VPH, como E6 y E7, actúan como oncogenes que promueven el crecimiento tumoral y la transformación maligna. La integración del genoma del VPH también puede causar carcinogénesis al promover la inestabilidad genómica asociada con alteraciones en el número de copias de ADN.
E6 produce una proteína (también llamada E6) que se une simultáneamente a dos proteínas de la célula huésped llamadas p53 y proteína asociada a E6 (E6-AP). E6AP es una ubiquitina ligasa E3, una enzima cuyo propósito es marcar proteínas con una modificación postraduccional llamada ubiquitina. Al unirse a ambas proteínas, E6 induce a E6AP a unir una cadena de moléculas de ubiquitina a p53, lo que marca a p53 para la degradación proteosomal. Normalmente, p53 actúa para prevenir el crecimiento celular y promueve la muerte celular en presencia de daño en el ADN. p53 también regula al alza la proteína p21, que bloquea la formación del complejo ciclina D/Cdk4, lo que impide la fosforilación de la proteína de retinoblastoma (RB) y, a su vez, detiene la progresión del ciclo celular al impedir la activación de E2F. En resumen, p53 es una proteína supresora de tumores que detiene el ciclo celular e impide el crecimiento y la supervivencia celular cuando se produce daño en el ADN. Así, la degradación de p53, inducida por E6, promueve la división celular no regulada, el crecimiento celular y la supervivencia celular, todas características del cáncer.
Es importante tener en cuenta que, si bien la interacción entre E6, E6AP y p53 fue la primera en caracterizarse, existen muchas otras proteínas en la célula huésped que interactúan con E6 y ayudan a la inducción del cáncer.
Carcinoma de células escamosas de piel
Los estudios también han demostrado una relación entre una amplia gama de tipos de VPH y el carcinoma de células escamosas de la piel. En tales casos, los estudios in vitro sugieren que la proteína E6 del virus HPV puede inhibir la apoptosis inducida por la luz ultravioleta.
Cáncer de cuello uterino
Casi todos los casos de cáncer de cuello uterino están asociados con la infección por VPH, con dos tipos, VPH16 y VPH18, presentes en el 70 % de los casos. En 2012, la Agencia Internacional para la Investigación del Cáncer consideró que doce tipos de VPH son cancerígenos para el cáncer de cuello uterino: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59. El VPH es necesario para que se produzca el cáncer de cuello uterino. La infección persistente por VPH aumenta el riesgo de desarrollar carcinoma de cuello uterino. Las personas que tienen una mayor incidencia de estos tipos de infección son las mujeres con VIH/SIDA, que tienen un riesgo 22 veces mayor de cáncer de cuello uterino.
Los tipos de VPH cancerígenos en el cáncer de cuello uterino pertenecen al género alfapapilomavirus y se pueden agrupar en clados de VPH. Los dos principales clados cancerígenos del VPH, alfapapilomavirus-9 (A9) y alfapapilomavirus-7 (A7), contienen HPV16 y HPV18, respectivamente. Se demostró que estos dos clados de VPH tienen diferentes efectos sobre las características moleculares del tumor y el pronóstico del paciente, y el clado A7 se asoció con vías más agresivas y un pronóstico inferior.
En 2020, se produjeron alrededor de 604 000 casos nuevos y 342 000 muertes por cáncer de cuello uterino en todo el mundo. Alrededor del 90% de estos ocurrieron en el mundo en desarrollo.
La mayoría de las infecciones por VPH del cuello uterino son eliminadas rápidamente por el sistema inmunitario y no progresan hasta convertirse en cáncer de cuello uterino (consulte a continuación la subsección Eliminación en Virología). Debido a que el proceso de transformación de las células normales del cuello uterino en cancerosas es lento, el cáncer se presenta en personas que han estado infectadas con el VPH durante mucho tiempo, por lo general más de una década o más (infección persistente). Además, tanto la infección por VPH como el cáncer de cuello uterino provocan modificaciones metabólicas que pueden estar correlacionadas con la regulación aberrante de enzimas relacionadas con las vías metabólicas.
Las variantes no europeas (NE) de HPV16 son significativamente más cancerígenas que las variantes europeas (E) de HPV16.
Cáncer anal
Los estudios muestran un vínculo entre la infección por VPH y los cánceres anales. Los VPH de transmisión sexual se encuentran en un gran porcentaje de los cánceres anales. Además, el riesgo de cáncer anal es de 17 a 31 veces mayor entre las personas con VIH que fueron coinfectadas con el VPH de alto riesgo, y 80 veces mayor para los hombres particularmente con VIH que tienen sexo con hombres.
La prueba de Papanicolaou anal para detectar cáncer anal podría beneficiar a algunas subpoblaciones de hombres o mujeres que practican sexo anal. Sin embargo, no existe un consenso de que dicha evaluación sea beneficiosa o de quién debería hacerse una prueba de Papanicolaou anal.
Cáncer de pene
El VPH está asociado con aproximadamente el 50 % de los cánceres de pene. En los Estados Unidos, el cáncer de pene representa alrededor del 0,5 % de todos los casos de cáncer en los hombres. HPV16 es el tipo asociado más comúnmente detectado. El riesgo de cáncer de pene aumenta de 2 a 3 veces para las personas que están infectadas con el VIH y el VPH.
Cánceres de cabeza y cuello
La infección oral con tipos de VPH cancerígenos de alto riesgo (más comúnmente VPH 16) se asocia con un número creciente de cánceres de cabeza y cuello. Esta asociación es independiente del consumo de tabaco y alcohol.
Las formas de VPH de transmisión sexual representan alrededor del 25 % de los cánceres de boca y parte superior de la garganta (orofaringe) en todo el mundo, pero el porcentaje local varía ampliamente, desde el 70 % en los Estados Unidos hasta el 4 % en Brasil. Tener sexo anal u oral con una pareja infectada con el VPH puede aumentar el riesgo de desarrollar este tipo de cáncer.
En los Estados Unidos, la cantidad de cánceres de cabeza y cuello asociados con el VPH recién diagnosticados ha superado la cantidad de casos de cáncer de cuello uterino. La tasa de tales cánceres ha aumentado de un estimado de 0,8 casos por 100 000 personas en 1988 a 4,5 por 100 000 en 2012 y, a partir de 2021, la tasa ha seguido aumentando. Los investigadores explican estos datos recientes por un aumento en el sexo oral. Este tipo de cáncer es más común en hombres que en mujeres.
Se informó el perfil mutacional del cáncer de cabeza y cuello VPH positivo y VPH negativo, lo que demuestra aún más que son enfermedades fundamentalmente distintas.
Cáncer de pulmón
Algunas pruebas relacionan el VPH con tumores benignos y malignos de las vías respiratorias superiores. La Agencia Internacional para la Investigación del Cáncer descubrió que las personas con cáncer de pulmón tenían muchas más probabilidades de tener varias formas de anticuerpos contra el VPH de alto riesgo en comparación con aquellas que no tenían cáncer de pulmón. Los investigadores que buscaron el VPH entre 1,633 pacientes con cáncer de pulmón y 2,729 personas sin la enfermedad pulmonar encontraron que las personas con cáncer de pulmón tenían más tipos de VPH que los pacientes sin cáncer, y entre los pacientes con cáncer de pulmón, las posibilidades de tener ocho tipos de VPH graves aumentaron significativamente. Además, la expresión de proteínas estructurales del VPH mediante inmunohistoquímica y estudios in vitro sugieren la presencia del VPH en el cáncer bronquial y sus lesiones precursoras. Otro estudio detectó VPH en el condensado de aire exhalado (EBC), cepillado bronquial y tejido pulmonar neoplásico de los casos, y encontró presencia de infección por VPH en el 16,4% de los sujetos afectados por cáncer de pulmón de células no pequeñas, pero en ninguno de los controles. Las frecuencias medias notificadas de VPH en cánceres de pulmón fueron del 17 % y el 15 % en Europa y las Américas, respectivamente, y el número medio de VPH en muestras asiáticas de cáncer de pulmón fue del 35,7 %, con una heterogeneidad considerable entre determinados países y regiones.
Cáncer de piel
En casos muy raros, el VPH puede causar epidermodisplasia verruciforme (EV) en personas con un sistema inmunitario debilitado. El virus, sin ser controlado por el sistema inmunitario, provoca la sobreproducción de queratina por parte de las células de la piel, lo que da como resultado lesiones que se asemejan a verrugas o cuernos cutáneos que finalmente pueden transformarse en cáncer de piel, pero el desarrollo no se comprende bien. Los tipos específicos de VPH que están asociados con EV son HPV5, HPV8 y HPV14.
Causa
Transmisión
El VPH de transmisión sexual se divide en dos categorías: de bajo riesgo y de alto riesgo. Los VPH de bajo riesgo causan verrugas en los genitales o alrededor de ellos. Los tipos 6 y 11 causan el 90% de todas las verrugas genitales y la papilomatosis respiratoria recurrente que provoca tumores benignos en las vías respiratorias. Los VPH de alto riesgo causan cáncer y consisten en alrededor de catorce tipos identificados. Los tipos 16 y 18 son responsables de causar la mayoría de los cánceres causados por el VPH. Estos VPH de alto riesgo causan el 5% de los cánceres en el mundo. En los Estados Unidos, los VPH de alto riesgo causan el 3 % de todos los casos de cáncer en mujeres y el 2 % en hombres.
Los factores de riesgo de infecciones genitales persistentes por VPH, que aumentan el riesgo de desarrollar cáncer, incluyen la edad temprana de la primera relación sexual, múltiples parejas, el tabaquismo y la inmunosupresión. El VPH genital se transmite por contacto directo sostenido de piel a piel, siendo el sexo vaginal, anal y oral los métodos más comunes. De vez en cuando se puede transmitir de una madre a su bebé durante el embarazo. El VPH es difícil de eliminar mediante técnicas estándar de desinfección hospitalaria y puede transmitirse en un entorno de atención médica en equipos ginecológicos reutilizables, como transductores de ultrasonido vaginal. Todavía se desconoce el período de transmisibilidad, pero probablemente al menos mientras persistan las lesiones visibles del VPH. El VPH aún puede transmitirse incluso después de tratar las lesiones y ya no son visibles ni están presentes.
Perinatal
Aunque los tipos de VPH genital pueden transmitirse de madre a hijo durante el parto, la aparición de enfermedades relacionadas con el VPH genital en los recién nacidos es rara. Sin embargo, la falta de aparición no descarta una infección latente asintomática, ya que el virus ha demostrado ser capaz de ocultarse durante décadas. La transmisión perinatal de los tipos 6 y 11 del VPH puede provocar el desarrollo de papilomatosis respiratoria recurrente de inicio juvenil (JORRP). JORRP es muy raro, con tasas de alrededor de 2 casos por cada 100 000 niños en los Estados Unidos. Aunque las tasas de JORRP son sustancialmente más altas si una mujer presenta verrugas genitales en el momento del parto, el riesgo de JORRP en tales casos sigue siendo inferior al 1 %.
Infecciones genitales
Las infecciones genitales por VPH se transmiten principalmente por contacto con los genitales, el ano o la boca de una pareja sexual infectada.
De los 120 virus del papiloma humano conocidos, 51 especies y tres subtipos infectan la mucosa genital. Quince se clasifican como tipos de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82), tres como probable de alto riesgo (26, 53 y 66), y doce de bajo riesgo (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 y 89).
Los condones no protegen completamente del virus porque las áreas alrededor de los genitales, incluida la parte interna de los muslos, no están cubiertas, lo que expone estas áreas a la piel de la persona infectada.
Manos
Los estudios han demostrado la transmisión del VPH entre las manos y los genitales de la misma persona y sus parejas sexuales. Hernández probó los genitales y la mano dominante de cada persona en 25 parejas heterosexuales cada dos meses durante un promedio de siete meses. Encontró dos parejas en las que los genitales del hombre infectaron la mano de la mujer con VPH de alto riesgo, dos en las que la mano de ella infectó los genitales de él, una en la que los genitales de ella infectaron la mano de él, dos en las que él infectó su propia mano, y se infectó su propia mano. Las manos no fueron la principal fuente de transmisión en estas 25 parejas, pero fueron significativas.
Partridge informa que las yemas de los dedos de los hombres se volvieron positivas para el VPH de alto riesgo en más de la mitad de la tasa (26 % cada dos años) que sus genitales (48 %). Winer informa que el 14 % de las muestras de las yemas de los dedos de mujeres sexualmente activas fueron positivas.
El contacto no sexual con las manos parece tener poco o ningún papel en la transmisión del VPH. Winer encontró que las catorce muestras de las yemas de los dedos de mujeres vírgenes eran negativas al comienzo de su estudio de las yemas de los dedos. En un informe separado sobre la infección genital por VPH, el 1 % de las mujeres vírgenes (1 de 76) sin contacto sexual dieron positivo para el VPH, mientras que el 10 % de las mujeres vírgenes que reportaron contacto sexual sin penetración dieron positivo (7 de 72).
Objetos compartidos
Compartir objetos posiblemente contaminados, por ejemplo, navajas de afeitar, puede transmitir el VPH. Aunque es posible, la transmisión por vías distintas de las relaciones sexuales es menos común para la infección por VPH genital femenino. El contacto entre los dedos y los genitales es una forma posible de transmisión, pero es poco probable que sea una fuente significativa.
Sangre
Aunque tradicionalmente se ha asumido que el VPH no es transmisible a través de la sangre, ya que se cree que solo infecta los tejidos cutáneos y mucosos, estudios recientes han puesto en duda esta idea. Históricamente, el ADN del VPH se ha detectado en la sangre de pacientes con cáncer de cuello uterino. En 2005, un grupo informó que, en muestras de sangre congelada de 57 pacientes pediátricos sin experiencia sexual que tenían infección por VIH vertical o adquirida por transfusión, 8 (14,0%) de estas muestras también dieron positivo para VPH-16. Esto parece indicar que es posible que el VPH se transmita a través de una transfusión de sangre. Sin embargo, dado que la transmisión no sexual del VPH por otros medios no es infrecuente, esto no pudo probarse definitivamente. En 2009, un grupo analizó muestras de sangre de la Cruz Roja Australiana de 180 donantes masculinos sanos para detectar el VPH y, posteriormente, encontró ADN de una o más cepas del virus en 15 (8,3 %) de las muestras. Sin embargo, es importante tener en cuenta que detectar la presencia de ADN del VPH en la sangre no es lo mismo que detectar el virus en sí mismo en la sangre, y aún se desconoce si el virus en sí puede residir o reside en la sangre de personas infectadas. Como tal, queda por determinar si el VPH puede o no transmitirse a través de la sangre. Esto es preocupante, ya que las donaciones de sangre actualmente no se analizan para detectar el VPH, y al menos algunas organizaciones, como la Cruz Roja Estadounidense y otras sociedades de la Cruz Roja, actualmente no parecen prohibir que las personas con VPH positivo donen sangre.
Cirugía
Se ha documentado la transmisión hospitalaria del VPH, especialmente al personal quirúrgico. Los cirujanos, incluidos los urólogos y/o cualquier persona en la sala, están sujetos a una infección por VPH por inhalación de partículas virales nocivas durante la ablación con electrocauterización o láser de un condiloma (verruga). Ha habido un informe de caso de un cirujano láser que desarrolló una papilomatosis laríngea extensa después de realizar una ablación láser a pacientes con condilomas anogenitales.
Virología
La infección por VPH se limita a las células basales del epitelio estratificado, el único tejido en el que se replican. El virus no puede unirse al tejido vivo; en cambio, infecta los tejidos epiteliales a través de microabrasiones u otros traumatismos epiteliales que exponen segmentos de la membrana basal. El proceso infeccioso es lento y tarda de 12 a 24 horas en iniciarse la transcripción. Se cree que los anticuerpos implicados desempeñan una función neutralizadora importante mientras los viriones aún residen en la membrana basal y las superficies celulares.
Se cree que las lesiones por VPH surgen de la proliferación de queratinocitos basales infectados. La infección generalmente ocurre cuando las células basales del huésped se exponen al virus infeccioso a través de una barrera epitelial perturbada, como ocurriría durante las relaciones sexuales o después de abrasiones cutáneas menores. No se ha demostrado que las infecciones por VPH sean citolíticas; más bien, las partículas virales se liberan como resultado de la degeneración de las células descamadas. El VPH puede sobrevivir durante muchos meses ya bajas temperaturas sin un huésped; por lo tanto, una persona con verrugas plantares puede propagar el virus al caminar descalzo.
El VPH es un pequeño virus de ADN circular de doble cadena con un genoma de aproximadamente 8000 pares de bases. El ciclo de vida del VPH sigue estrictamente el programa de diferenciación del queratinocito huésped. Se cree que el virión del VPH infecta los tejidos epiteliales a través de microabrasiones, por lo que el virión se asocia con receptores putativos como integrinas alfa, lamininas y anexina A2, lo que conduce a la entrada de los viriones en las células epiteliales basales a través de endocitosis mediada por clatrina y/o endocitosis mediada por caveolina según el tipo de VPH. En este punto, el genoma viral es transportado al núcleo por mecanismos desconocidos y se establece en un número de copias de 10 a 200 genomas virales por célula. Luego se produce una cascada transcripcional sofisticada a medida que el queratinocito huésped comienza a dividirse y se diferencia cada vez más en las capas superiores del epitelio.
Evolución
La filogenia de las diversas cepas del VPH generalmente refleja los patrones de migración del Homo sapiens y sugiere que el VPH puede haberse diversificado junto con la población humana. Los estudios sugieren que el VPH evolucionó a lo largo de cinco ramas principales que reflejan el origen étnico de los huéspedes humanos y se diversificó junto con la población humana.
Los investigadores identificaron inicialmente dos variantes principales de HPV16, europea (HPV16-E) y no europea (HPV16-NE). Análisis más recientes basados en miles de genomas de HPV16 muestran que, de hecho, existen dos clados principales, que se subdividen en cuatro linajes (designados A-D) e incluso se subdividen en 16 sublinajes (A1–4, B1–4, C1–4 y D1–). 4). Los sublinajes A1-A3 constituyen la variante europea, A4 la variante asiática, B1-B4 la variante africana tipo I, C1-C4 la variante africana tipo II, D1 la variante norteamericana, D2 la variante asiática americana tipo I, D3 la variante asiática Variante americana tipo II. Los diversos linajes y sublinajes tienen diferente capacidad oncogénica, donde en general, se considera que los linajes no europeos aumentan el riesgo de cáncer. Aunque HPV16 es un virus de ADN, existen signos de recombinación entre los diferentes linajes. Según un análisis de más de 3600 genomas, entre el 0,3 y el 1,2% de ellos podrían ser recombinantes. Por lo tanto, idealmente, la genotipificación (para la evaluación del riesgo de cáncer) del VPH16 no debería basarse solo en ciertos genes, sino en todos los genes del genoma completo.
Una herramienta bioinformática denominada HPV16-Genotyper realiza i) el genotipado del linaje HPV16, ii) detecta posibles eventos de recombinación, iii) identifica, dentro de las secuencias enviadas, mutaciones/SNP que se han informado (en la literatura) para aumentar el riesgo para el cáncer
Proteínas E6/E7
Las dos oncoproteínas principales de los tipos de VPH de alto riesgo son E6 y E7. La "E" designación indica que estas dos proteínas son proteínas tempranas (expresadas temprano en el ciclo de vida del VPH), mientras que la "L" la designación indica que son proteínas tardías (expresión tardía). El genoma del VPH se compone de seis marcos de lectura abiertos (ORF) tempranos (E1, E2, E4, E5, E6 y E7), dos ORF tardíos (L1 y L2) y una región de control larga (LCR) no codificante. Después de infectar la célula huésped, se activa el promotor viral temprano y se transcribe un ARN primario policistrónico que contiene los seis ORF tempranos. Este ARN policistrónico luego se somete a empalme de ARN activo para generar múltiples isoformas de ARNm. Uno de los ARN de isoforma empalmados, E6*I, sirve como ARNm de E7 para traducir la proteína E7. Sin embargo, la transcripción viral temprana está sujeta a la regulación de E2 viral y los niveles altos de E2 reprimen la transcripción. Los genomas del VPH se integran en el genoma del huésped mediante la interrupción del ORF de E2, lo que evita la represión de E2 en E6 y E7. Por lo tanto, la integración del genoma viral en el genoma del ADN del huésped aumenta la expresión de E6 y E7 para promover la proliferación celular y la posibilidad de malignidad. El grado en que se expresan E6 y E7 se correlaciona con el tipo de lesión cervical que finalmente se puede desarrollar.
- Papel en el cáncer
Las proteínas E6/E7 inactivan dos proteínas supresoras de tumores, p53 (inactivada por E6) y pRb (inactivada por E7). Se cree que los oncogenes virales E6 y E7 modifican el ciclo celular para retener el queratinocito del hospedador en un estado que es favorable para la amplificación de la replicación del genoma viral y la consiguiente expresión génica tardía. E6 en asociación con la proteína asociada a E6 del huésped, que tiene actividad de ubiquitina ligasa, actúa para ubiquitinar p53, lo que lleva a su degradación proteosomal. E7 (en los VPH oncogénicos) actúa como proteína transformadora primaria. E7 compite por la unión de la proteína de retinoblastoma (pRb), liberando el factor de transcripción E2F para transactivar sus objetivos, lo que impulsa el ciclo celular. Todos los VPH pueden inducir una proliferación transitoria, pero solo las cepas 16 y 18 pueden inmortalizar líneas celulares in vitro. También se ha demostrado que los HPV 16 y 18 no pueden inmortalizar células primarias de rata solas; tiene que haber activación del oncogén ras. En las capas superiores del epitelio del huésped, los genes tardíos L1 y L2 se transcriben/traducen y sirven como proteínas estructurales que encapsulan los genomas virales amplificados. Una vez que el genoma está encapsulado, la cápside parece sufrir un evento de maduración/ensamblaje dependiente de redox, que está vinculado a un gradiente redox natural que se extiende por las capas de tejido epitelial suprabasal y cornificado. Este evento de ensamblaje/maduración estabiliza los viriones y aumenta su infectividad específica. Luego, los viriones pueden eliminarse en las escamas muertas del epitelio del huésped y el ciclo de vida viral continúa. Un estudio de 2010 descubrió que E6 y E7 están involucrados en la acumulación nuclear de beta-catenina y la activación de la señalización de Wnt en los cánceres inducidos por el VPH.
Período de latencia
Una vez que un virión del VPH invade una célula, se produce una infección activa y el virus puede transmitirse. Pueden transcurrir varios meses o años antes de que se desarrollen lesiones intraepiteliales escamosas (SIL) y puedan detectarse clínicamente. El tiempo que transcurre desde la infección activa hasta la enfermedad clínicamente detectable puede dificultar que los epidemiólogos establezcan qué pareja fue la fuente de infección.
Liquidación
La mayoría de las infecciones por VPH son curadas por la mayoría de las personas sin acción ni consecuencias médicas. La tabla proporciona datos para los tipos de alto riesgo (es decir, los tipos que se encuentran en los cánceres).
| Meses después de la prueba positiva inicial | 8 meses | 12 meses | 18 meses |
|---|---|---|---|
| % de hombres testados negativo | 70% | 80% | 100% |
Limpiar una infección no siempre crea inmunidad si hay una fuente de infección nueva o continua. Hernández' El estudio de 2005-6 de 25 parejas informa "Varios casos indicaron una aparente reinfección [de la pareja] después de la eliminación del virus."
Diagnóstico
Se han identificado más de 200 tipos de VPH y están designados por números. Se pueden dividir en "de bajo riesgo" y "alto riesgo" tipos Los tipos de bajo riesgo causan verrugas y los tipos de alto riesgo pueden causar lesiones o cáncer.
Pruebas cervicales
Las pautas de la Sociedad Estadounidense del Cáncer recomiendan diferentes estrategias de detección para el cáncer de cuello uterino según la edad de la mujer, el historial de detección, los factores de riesgo y la elección de las pruebas. Debido al vínculo entre el VPH y el cáncer de cuello uterino, la ACS actualmente recomienda la detección temprana del cáncer de cuello uterino en adultos asintomáticos de riesgo promedio, principalmente con citología cervical mediante prueba de Papanicolaou, independientemente del estado de vacunación contra el VPH. Las mujeres de 30 a 65 años deben hacerse la prueba preferiblemente cada 5 años tanto con la prueba del VPH como con la prueba de Papanicolaou. En otros grupos de edad, una prueba de Papanicolaou sola puede ser suficiente a menos que se les haya diagnosticado células escamosas atípicas de significado incierto (ASC-US). Se recomienda la prueba conjunta con una prueba de Papanicolaou y una prueba de VPH porque disminuye la tasa de falsos negativos. Según el Instituto Nacional del Cáncer, "La prueba más común detecta el ADN de varios tipos de VPH de alto riesgo, pero no puede identificar los tipos que están presentes. Otra prueba es específica para el ADN de los tipos de VPH 16 y 18, los dos tipos que causan la mayoría de los cánceres asociados con el VPH. Una tercera prueba puede detectar el ADN de varios tipos de VPH de alto riesgo y puede indicar si está presente el VPH-16 o el VPH-18. Una cuarta prueba detecta el ARN de los tipos de VPH de alto riesgo más comunes. Estas pruebas pueden detectar infecciones por VPH antes de que las anomalías celulares sean evidentes.
"Teóricamente, las pruebas de ADN y ARN del VPH podrían usarse para identificar infecciones por VPH en células extraídas de cualquier parte del cuerpo. Sin embargo, las pruebas están aprobadas por la FDA solo para dos indicaciones: para pruebas de seguimiento de mujeres que parecen tener resultados anormales en la prueba de Papanicolaou y para detección de cáncer de cuello uterino en combinación con una prueba de Papanicolaou en mujeres mayores de 30 años."
Pruebas bucales
Las pautas para la detección del cáncer de orofaringe del Grupo de Trabajo de Servicios Preventivos y la Asociación Dental Estadounidense en los EE. UU. sugieren un examen visual convencional, pero debido a que algunas partes de la orofaringe son difíciles de ver, este cáncer a menudo solo se detecta en etapas posteriores.
El diagnóstico de cáncer de orofaringe se realiza mediante biopsia de células o tejidos exfoliados. La Red Nacional Integral del Cáncer y el Colegio de Patólogos Estadounidenses recomiendan la prueba del VPH en el cáncer de orofaringe. Sin embargo, si bien se recomiendan las pruebas, no existe un tipo específico de prueba que se use para detectar el VPH de tumores orales que actualmente recomiende la FDA en los Estados Unidos. Debido a que el VPH tipo 16 es el tipo más común que se encuentra en el cáncer de orofaringe, la inmunohistoquímica p16 es una opción de prueba que se usa para determinar si el VPH está presente, lo que puede ayudar a determinar el curso del tratamiento, ya que los tumores que son negativos para p16 tienen mejores resultados. Otra opción que ha surgido como una opción confiable es la hibridación in situ del ADN del VPH (ISH), que permite la visualización del VPH.
Probando a los hombres
No hay una amplia gama de pruebas disponibles a pesar de que el VPH es común; la mayoría de los estudios sobre el VPH utilizaron herramientas y análisis personalizados que no están disponibles para el público en general. Los médicos a menudo dependen de la vacuna entre los jóvenes y de las altas tasas de eliminación (consulte la subsección de Eliminación en Virología) para crear un bajo riesgo de enfermedad y mortalidad, y tratar los cánceres cuando aparecen. Otros creen que reducir la infección por VPH en más hombres y mujeres, incluso cuando no presenta síntomas, es importante (inmunidad colectiva) para prevenir más cánceres en lugar de solo tratarlos. Cuando se utilizan pruebas, los resultados negativos muestran seguridad contra la transmisión y los resultados positivos muestran dónde se necesita protección (condones, guantes) para prevenir la transmisión hasta que desaparezca la infección.
Los estudios han analizado y encontrado VPH en hombres, incluidos los tipos de alto riesgo (es decir, los tipos que se encuentran en los cánceres), en los dedos, la boca, la saliva, el ano, la uretra, la orina, el semen, la sangre, el escroto y el pene.
El kit Qiagen/Digene mencionado en la sección anterior se usó con éxito fuera de etiqueta para evaluar el pene, el escroto y el ano de hombres en relaciones a largo plazo con mujeres que dieron positivo para VPH de alto riesgo. Se encontró que el 60% de ellos portaban el virus, principalmente en el pene. Otros estudios utilizaron citocepillos y análisis personalizados.
En un estudio, los investigadores tomaron muestras de sujetos' uretra, escroto y pene. Las muestras tomadas de la uretra agregaron menos del 1% a la tasa de VPH. Estudios como este llevaron a Giuliano a recomendar tomar muestras del glande, el eje y el pliegue entre ellos, junto con el escroto, ya que tomar muestras de la uretra o el ano aportaba muy poco al diagnóstico. Dunne recomienda el glande, el eje, su pliegue y el prepucio.
En un estudio se pidió a los sujetos que no se lavaran los genitales durante 12 horas antes de la toma de muestras, incluidos la uretra, el escroto y el pene. Otros estudios guardan silencio sobre el lavado, un vacío particular en los estudios de las manos.
Un pequeño estudio utilizó citocepillos húmedos, en lugar de mojar la piel. Encontró que una mayor proporción de hombres eran VPH positivos cuando se frotaba la piel con un papel de lija de grano 600 antes de frotar con el cepillo, en lugar de frotar sin preparación. No está claro si el papel de lija recogió los viriones o simplemente los aflojó para que el hisopo los recogiera.
Los estudios han encontrado que la auto-recolección (con papel de lija e hisopos de Dacron) es tan efectiva como la recolección realizada por un médico y, a veces, más, ya que los pacientes estaban más dispuestos que un médico a raspar vigorosamente. Las mujeres tuvieron un éxito similar en el auto-muestreo utilizando tampones, hisopos, citocepillos y lavado.
Varios estudios utilizaron citocepillos para tomar muestras de las yemas de los dedos y debajo de las uñas, sin mojar el área ni el cepillo.
Otros estudios analizaron la orina, el semen y la sangre y encontraron cantidades variables de VPH, pero todavía no hay una prueba disponible para el público.
Otras pruebas
Aunque es posible realizar pruebas de ADN del VPH en otros tipos de infecciones, no existen pruebas aprobadas por la FDA para la detección general en los Estados Unidos ni pruebas aprobadas por el gobierno canadiense, ya que las pruebas no son concluyentes y se consideran médicamente innecesarias.
Las verrugas genitales son el único signo visible del VPH genital de bajo riesgo y se pueden identificar con una revisión visual. Estos crecimientos visibles, sin embargo, son el resultado de tipos de VPH no cancerígenos. El ácido acético al cinco por ciento (vinagre) se usa para identificar tanto las verrugas como las lesiones de neoplasia intraepitelial escamosa (SIL) con un éxito limitado al hacer que el tejido anormal se vea blanco, pero la mayoría de los médicos han encontrado que esta técnica es útil solo en áreas húmedas, como los genitales femeninos. tracto. En este momento, las pruebas de VPH para hombres se usan solo en investigación.
Se han realizado investigaciones sobre las pruebas de VPH por presencia de anticuerpos. El enfoque busca una respuesta inmune en la sangre, que contenga anticuerpos contra el VPH si el paciente es VPH positivo. La confiabilidad de dichas pruebas no ha sido probada, ya que no ha habido un producto aprobado por la FDA hasta agosto de 2018; la prueba de sangre sería una prueba menos invasiva para fines de detección.
Prevención
Las vacunas contra el VPH pueden prevenir los tipos de infección más comunes. Para que sean efectivos, deben usarse antes de que ocurra una infección y, por lo tanto, se recomiendan entre los nueve y los trece años. Las pruebas de detección del cáncer de cuello uterino, como la prueba de Papanicolaou (Pap) o la observación del cuello uterino después de usar ácido acético, pueden detectar cáncer temprano o células anormales que pueden convertirse en cáncer. Esto permite un tratamiento temprano que se traduce en mejores resultados. La detección ha reducido tanto el número como las muertes por cáncer de cuello uterino en el mundo desarrollado. Las verrugas se pueden eliminar congelando.
Vacunas
Hay tres vacunas disponibles para prevenir la infección por algunos tipos de VPH: Gardasil, Gardasil 9 y Cervarix; los tres protegen contra la infección inicial con los tipos de VPH 16 y 18, que causan la mayoría de los casos de cáncer asociados con el VPH. Gardasil también protege contra los tipos de VPH 6 y 11, que causan el 90 % de las verrugas genitales. Gardasil es una vacuna tetravalente recombinante, mientras que Cervarix es bivalente y se prepara a partir de partículas similares a virus (VLP) de la proteína de la cápside L1. Gardasil 9 no es avalente, tiene el potencial de prevenir alrededor del 90 % de los cánceres de cuello uterino, vulva, vagina y ano. Puede proteger contra los tipos de VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58; los últimos cinco causan hasta el 20% de los cánceres de cuello uterino que antes no estaban cubiertos.
Las vacunas brindan pocos beneficios a las mujeres que ya están infectadas con los tipos 16 y 18 del VPH. Por esta razón, la vacuna se recomienda principalmente para aquellas mujeres que aún no han estado expuestas al VPH durante las relaciones sexuales. El documento de posición de la Organización Mundial de la Salud sobre la vacunación contra el VPH describe claramente estrategias apropiadas y rentables para usar la vacuna contra el VPH en los programas del sector público.
Existe evidencia de certeza alta de que las vacunas contra el VPH protegen contra las lesiones precancerosas de cuello uterino en mujeres jóvenes, en particular aquellas vacunadas entre los 15 y los 26 años. Las vacunas contra el VPH no aumentan el riesgo de eventos adversos graves. Se necesita un seguimiento más prolongado para monitorear el impacto de las vacunas contra el VPH en el cáncer de cuello uterino.
Los CDC recomiendan que las vacunas se administren en dos inyecciones en un intervalo de al menos 6 meses para las personas de 11 a 12 años, y tres dosis para las personas mayores de 13 años. En la mayoría de los países, están financiados solo para uso femenino, pero están aprobados para uso masculino en muchos países y financiados para adolescentes en Australia. La vacuna no tiene ningún efecto terapéutico sobre las infecciones por VPH existentes o las lesiones cervicales. En 2010, el 49% de las adolescentes en los EE. UU. recibieron la vacuna contra el VPH.
Después de estudios que sugirieron que la vacuna es más efectiva en niñas más jóvenes que en adolescentes mayores, el Reino Unido, Suiza, México, los Países Bajos y Quebec comenzaron a ofrecer la vacuna en un programa de dos dosis para niñas menores de 15 años en 2014.
Las recomendaciones de detección del cáncer de cuello uterino no han cambiado para las mujeres que reciben la vacuna contra el VPH. Sigue siendo una recomendación que las mujeres continúen con las pruebas de detección del cuello uterino, como la prueba de Papanicolaou, incluso después de recibir la vacuna, ya que no previene todos los tipos de cáncer de cuello uterino.
Tanto hombres como mujeres son portadores del VPH. La vacuna Gardasil también protege a los hombres contra el cáncer anal y las verrugas y las verrugas genitales.
Duración de ambas vacunas' se ha observado eficacia desde que se desarrollaron por primera vez, y se espera que sea duradera.
En diciembre de 2014, la FDA aprobó una vacuna basada en Gardasil novalente, Gardasil 9, para proteger contra la infección con las cuatro cepas de VPH cubiertas por la primera generación de Gardasil, así como otras cinco cepas responsables del 20 % de las cánceres de cuello uterino (VPH-31, VPH-33, VPH-45, VPH-52 y VPH-58).
Condones
Los Centros para el Control y la Prevención de Enfermedades afirman que "el uso de condones masculinos puede reducir el riesgo de infección genital por el virus del papiloma humano (VPH)" pero brinda un menor grado de protección en comparación con otras enfermedades de transmisión sexual "porque el VPH también puede transmitirse por exposición a áreas (p. ej., piel infectada o superficies mucosas) que no están cubiertas o protegidas por el condón."
Desinfección
El virus es excepcionalmente resistente y es inmune a la mayoría de los desinfectantes comunes. Es el primer virus que ha demostrado ser resistente a la inactivación por glutaraldehído, que se encuentra entre los desinfectantes fuertes más comunes que se usan en los hospitales. El blanqueador de hipoclorito de sodio diluido es efectivo, pero no se puede usar en algunos tipos de equipos reutilizables, como los transductores de ultrasonido. Como resultado de estas dificultades, existe una creciente preocupación por la posibilidad de transmitir el virus en el equipo de atención médica, en particular el equipo ginecológico reutilizable que no se puede esterilizar en autoclave. Para dicho equipo, algunas autoridades sanitarias fomentan el uso de desinfección UV o un "desinfectante [lejía] de alto nivel a base de oxidantes sin hipoclorito con declaraciones en la etiqueta para virus no envueltos", como una solución fuerte de peróxido de hidrógeno o toallitas de dióxido de cloro. Se espera que tales métodos de desinfección sean relativamente efectivos contra el VPH.
Administración
Actualmente no existe un tratamiento específico para la infección por VPH. Sin embargo, la infección viral generalmente se elimina a niveles indetectables por el sistema inmunitario. Según los Centros para el Control y la Prevención de Enfermedades, el sistema inmunitario del cuerpo elimina el VPH de forma natural en dos años en el 90 % de los casos (consulte la subsección Eliminación en Virología para obtener más detalles). Sin embargo, los expertos no se ponen de acuerdo sobre si el virus se elimina o se reduce a niveles indetectables, y es difícil saber cuándo es contagioso.
La atención de seguimiento suele recomendarse y practicarse en muchas clínicas de salud. El seguimiento a veces no es exitoso porque una parte de los tratados no regresan para ser evaluados. Además de los métodos normales de llamadas telefónicas y correo, los mensajes de texto y el correo electrónico pueden mejorar la cantidad de personas que regresan para recibir atención. A partir de 2015, no está claro cuál es el mejor método de seguimiento después del tratamiento de la neoplasia intraepitelial cervical.
Epidemiología
A nivel mundial, el 12 % de las mujeres son positivas para el ADN del VPH, con tasas que varían según la edad y el país. Las tasas más altas de VPH se encuentran en mujeres más jóvenes, con una tasa del 24% en mujeres menores de 25 años. Las tasas disminuyen en los grupos de mayor edad en Europa y las Américas, pero menos en África y Asia. Las tasas son más altas en África Subsahariana (24 %) y Europa del Este (21 %) y más bajas en América del Norte (5 %) y Asia Occidental (2 %).
Los tipos de VPH más comunes en todo el mundo son VPH16 (3,2 %), VPH18 (1,4 %), VPH52 (0,9 %), VPH31 (0,8 %) y VPH58 (0,7 %). Los tipos de VPH de alto riesgo también se distribuyen de manera desigual: el VPH16 tiene una tasa de alrededor del 13 % en África y del 30 % en Asia occidental y central.
Al igual que muchas enfermedades, el VPH afecta de manera desproporcionada a los países de bajos ingresos y escasos recursos. Las tasas más altas de VPH en el África subsahariana, por ejemplo, pueden estar relacionadas con la alta exposición al virus de la inmunodeficiencia humana (VIH) en la región. Otros factores que afectan la propagación global de la enfermedad son los comportamientos sexuales, incluida la edad de inicio sexual, el número de parejas sexuales y la facilidad de acceso a la anticoncepción de barrera, todos los cuales varían a nivel mundial.
Estados Unidos
| Edad (años) | Prevalencia (%) |
|---|---|
| 14 a 19 | 24,5% |
| 20 a 24 | 44.8% |
| 25 a 29 | 27,4% |
| 30 a 39 | 27.5% |
| 40 a 49 | 25.2% |
| 50 a 59 | 19.6% |
| 14 a 59 | 26,8% |
Se estima que el VPH es la infección de transmisión sexual más común en los Estados Unidos. La mayoría de los hombres y mujeres sexualmente activos probablemente adquieran la infección genital por VPH en algún momento de sus vidas. La Asociación Estadounidense de Salud Social estima que alrededor del 75 al 80 % de los estadounidenses sexualmente activos se infectarán con el VPH en algún momento de su vida. A la edad de 50 años, más del 80 % de las mujeres estadounidenses habrán contraído al menos una cepa del VPH genital. Se estimó que, en el año 2000, hubo aproximadamente 6,2 millones de nuevas infecciones por VPH entre estadounidenses de 15 a 44 años; de estos, aproximadamente el 74 % ocurrieron en personas de entre 15 y 24 años. De las ETS estudiadas, el VPH genital fue el más comúnmente adquirido. En los Estados Unidos, se estima que el 10 % de la población tiene una infección activa por VPH, el 4 % tiene una infección que ha causado anomalías citológicas y un 1 % adicional tiene una infección que causa verrugas genitales.
Las estimaciones de la prevalencia del VPH varían del 14 % a más del 90 %. Una de las razones de la diferencia es que algunos estudios informan sobre mujeres que actualmente tienen una infección detectable, mientras que otros estudios informan sobre mujeres que alguna vez han tenido una infección detectable. Otra causa de discrepancia es la diferencia en las cepas que se analizaron.
Un estudio encontró que, durante 2003–2004, en un momento dado, el 26,8 % de las mujeres de 14 a 59 años estaban infectadas con al menos un tipo de VPH. Esto fue más alto que las estimaciones anteriores; El 15,2% estaba infectado con uno o más de los tipos de alto riesgo que pueden causar cáncer.
La prevalencia de los tipos de alto y bajo riesgo es aproximadamente similar a lo largo del tiempo.
El virus del papiloma humano no está incluido entre las enfermedades que normalmente se deben informar a los CDC a partir de 2011.
Irlanda
En promedio, se diagnosticaron 538 casos de cánceres asociados con el VPH por año en Irlanda durante el período de 2010 a 2014. El cáncer de cuello uterino fue el cáncer asociado con el VPH más frecuente con un promedio de 292 casos por año (74 % del total de mujeres, y el 54% del total general de cánceres asociados al VPH). Un estudio de 996 muestras de citología cervical en una población de mujeres urbanas irlandesas, examinadas de forma oportunista, encontró una prevalencia general del VPH del 19,8 %, el VPH 16 del 20 % y el VPH 18 del 12 % fueron los tipos de alto riesgo más comunes detectados. En Europa, los tipos 16 y 18 son responsables de más del 70 % de los cánceres de cuello uterino. Las tasas generales de cánceres invasivos asociados con el VPH pueden estar aumentando. Entre 1994 y 2014, hubo un aumento del 2 % en la tasa de cánceres invasivos asociados al VPH por año para ambos sexos en Irlanda.
Como se sabe que el VPH está asociado con las verrugas anogenitales, estas se deben notificar al Centro de Vigilancia de Protección de la Salud (HPSC). Las verrugas genitales son la segunda ITS más común en Irlanda. Hubo 1281 casos de verrugas anogenitales notificados en 2017, lo que supuso una disminución con respecto a la cifra de 2016 de 1593. La tasa específica por edad más alta tanto para hombres como para mujeres se encontraba en el rango de edad de 25 a 29 años; El 53% de los casos fueron entre hombres.
Sri Lanka
En Sri Lanka, la prevalencia del VPH es del 15,5% independientemente de sus anomalías citológicas.
Mongolia Interior
En la Región Autónoma de Mongolia Interior, la prevalencia general del VPH es del 14,5 %, pero muestra una disparidad étnica sustancial; la prevalencia en las mujeres mongolas (14,9 %) es mucho mayor que la de las participantes Han (4,3 %). La urbanización, el número de parejas sexuales y el historial de PAP aparecen como factores de riesgo para la infección por VPH en las mujeres Han, pero no en las mongolas. La región es así un ejemplo importante de que la epidemiología del VPH está más relacionada con factores culturales y étnicos y no con la geografía per se.
Historia
En 1972, Stefania Jabłońska en Polonia propuso la asociación de los virus del papiloma humano con el cáncer de piel en la epidermodisplasia verruciforme. En 1978, Jabłońska y Gerard Orth del Instituto Pasteur descubrieron el VPH-5 en el cáncer de piel. En 1976, Harald zur Hausen publicó la hipótesis de que el virus del papiloma humano desempeña un papel importante en la causa del cáncer de cuello uterino. En 1983 y 1984, zur Hausen y sus colaboradores identificaron HPV16 y HPV18 en el cáncer de cuello uterino.
La línea celular HeLa contiene ADN adicional en su genoma que se originó a partir del VPH tipo 18.
Investigación
La cohorte de VPH de Ludwig-McGill es uno de los estudios longitudinales más grandes del mundo sobre la historia natural de la infección por el virus del papiloma humano (VPH) y el riesgo de cáncer de cuello uterino. Fue establecido en 1993 por Ludwig Cancer Research y la Universidad McGill en Montreal, Canadá.
Contenido relacionado
Dieta macrobiótica
Técnica Alexander
Acción contra el Hambre