Infección por Clostridioides difficile
Infección por Clostridioides difficile (CDI o C-diff), también conocida como infección por Clostridium difficile, es una infección sintomática debida a la Bacteria formadora de esporas Clostridioides difficile. Los síntomas incluyen diarrea acuosa, fiebre, náuseas y dolor abdominal. Representa aproximadamente el 20% de los casos de diarrea asociada a antibióticos. Los antibióticos pueden contribuir a cambios perjudiciales en la microbiota intestinal; específicamente, disminuyen la absorción de ácidos grasos de cadena corta, lo que produce diarrea osmótica o acuosa. Las complicaciones pueden incluir colitis pseudomembranosa, megacolon tóxico, perforación del colon y sepsis.
La infecciónClostridioides difficile se transmite mediante esporas bacterianas que se encuentran en las heces. Las superficies pueden contaminarse con las esporas y una mayor propagación se produce a través de las manos de los trabajadores de la salud. Los factores de riesgo de infección incluyen el uso de antibióticos o inhibidores de la bomba de protones, la hospitalización, otros problemas de salud y la edad avanzada. El diagnóstico se realiza mediante cultivo de heces o pruebas de ADN o toxinas de la bacteria. Si una persona da positivo pero no presenta síntomas, la afección se conoce como C. difficile colonización en lugar de una infección.
Los esfuerzos de prevención incluyen la limpieza de las salas terminales en los hospitales, la limitación del uso de antibióticos y campañas de lavado de manos en los hospitales. El desinfectante para manos a base de alcohol no parece eficaz. La interrupción de los antibióticos puede dar lugar a la resolución de los síntomas en tres días en aproximadamente el 20% de los infectados. Los antibióticos metronidazol, vancomicina o fidaxomicina curarán la infección. No se recomienda volver a realizar la prueba después del tratamiento, siempre que los síntomas hayan desaparecido, ya que a menudo la persona puede permanecer colonizada. Se han informado recurrencias en hasta el 25% de las personas. Alguna evidencia provisional indica que el trasplante de microbiota fecal y los probióticos pueden disminuir el riesgo de recurrencia.
C. difficile ocurren en todas partes del mundo. En 2011 se produjeron unos 453.000 casos en Estados Unidos, que provocaron 29.000 muertes. Las tasas globales de enfermedad aumentaron entre 2001 y 2016. C. difficile ocurren con más frecuencia en mujeres que en hombres. La bacteria fue descubierta en 1935 y se descubrió que causaba enfermedades en 1978. En Estados Unidos, las infecciones asociadas a la atención médica aumentan el costo de la atención en 1.500 millones de dólares cada año. Aunque C. difficile es una infección común asociada a la atención sanitaria; como máximo el 30% de las infecciones se transmiten dentro de los hospitales. La mayoría de las infecciones se adquieren fuera de los hospitales, donde se cree que los medicamentos y un historial reciente de enfermedades diarreicas (por ejemplo, abuso de laxantes o intoxicación alimentaria debido a la salmonelosis) aumentan el riesgo de colonización.
Signos y síntomas
Los signos y síntomas de la CDI varían desde diarrea leve hasta inflamación grave del colon que pone en peligro la vida.
En adultos, una regla de predicción clínica encontró que los mejores signos son diarrea significativa ("nueva aparición de más de tres deposiciones acuosas o parcialmente formadas por período de 24 horas"), exposición reciente a antibióticos, dolor abdominal, fiebre (hasta 40,5 °C o 105 °F) y un mal olor distintivo en las heces parecido al estiércol de caballo. En una población hospitalaria, el tratamiento antibiótico previo más diarrea o dolor abdominal tuvo una sensibilidad del 86% y una especificidad del 45%. En este estudio, con una prevalencia de ensayos de citotoxinas positivos del 14%, el valor predictivo positivo fue del 18% y el valor predictivo negativo fue del 94%.
En los niños, el síntoma más frecuente de una CDI es la diarrea acuosa con al menos tres deposiciones al día durante dos o más días, que puede ir acompañada de fiebre, pérdida de apetito, náuseas y/o dolor abdominal. Las personas con una infección grave también pueden desarrollar una inflamación grave del colon y tener poca o ninguna diarrea.
Causa

Infección por C. difficile es la bacteria responsable de C. diarrea difficile.
C. difícil

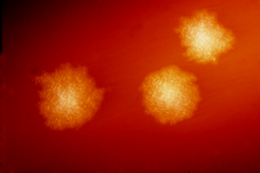
Los clostridios son bacterias móviles anaeróbicas, ubicuas en la naturaleza y especialmente frecuentes en el suelo. Bajo el microscopio, aparecen como células largas e irregulares (a menudo en forma de muslo o de huso) con un bulto en sus extremos terminales. Bajo tinción de Gram, C. difficile son grampositivas y muestran un crecimiento óptimo en agar sangre a la temperatura del cuerpo humano en ausencia de oxígeno. Cuando están estresadas, las bacterias producen esporas que pueden tolerar condiciones extremas que las bacterias activas no pueden tolerar.
C. difficile puede colonizar el colon humano sin presentar síntomas; Aproximadamente entre el 2% y el 5% de la población adulta son portadores, aunque varía considerablemente según la demografía. El riesgo de colonización se ha relacionado con antecedentes de enfermedades diarreicas no relacionadas (por ejemplo, abuso de laxantes e intoxicación alimentaria debido a salmonelosis o infección por Vibrio cholerae).
Patogénica C. difficile producen múltiples toxinas. Las mejor caracterizadas son la enterotoxina (toxina A de Clostridium difficile) y la citotoxina (toxina B de Clostridium difficile), las cuales pueden producir diarrea e inflamación en personas infectadas, aunque se han debatido sus contribuciones relativas. Las toxinas A y B son glucosiltransferasas que atacan e inactivan la familia Rho de GTPasas. La toxina B (citotoxina) induce la despolimerización de la actina mediante un mecanismo correlacionado con una disminución en la ribosilación de ADP de las proteínas Rho de unión a GTP de bajo peso molecular. También se ha descrito otra toxina, la toxina binaria, pero no se comprende completamente su papel en las enfermedades.
El tratamiento con antibióticos de las CDI puede resultar difícil, debido tanto a la resistencia a los antibióticos como a factores fisiológicos de las bacterias (formación de esporas, efectos protectores de la pseudomembrana). La aparición de una cepa nueva y altamente tóxica de C. difficile que es resistente a los antibióticos fluoroquinolonas como la ciprofloxacina y la levofloxacina, que se dice que causa brotes geográficamente dispersos en América del Norte, se informó en 2005. Los Centros para el Control y la Prevención de Enfermedades de Estados Unidos en Atlanta advirtieron sobre la aparición de una epidemia cepa con mayor virulencia, resistencia a los antibióticos o ambas.
C. difficile se transmite de persona a persona por vía fecal-oral. El organismo forma esporas resistentes al calor que no mueren con limpiadores de manos a base de alcohol ni con la limpieza rutinaria de superficies. Así, estas esporas sobreviven en ambientes clínicos durante largos períodos. Debido a esto, las bacterias se pueden cultivar en casi cualquier superficie. Una vez que se ingieren las esporas, su resistencia a los ácidos les permite pasar ilesas por el estómago. Tras la exposición a los ácidos biliares, germinan y se multiplican en células vegetativas en el colon. Las personas sin antecedentes de trastornos gastrointestinales debido al uso de antibióticos o enfermedades diarreicas tienen menos probabilidades de ser colonizadas por C. difícil.
En 2005, el análisis molecular condujo a la identificación del C. difficile caracterizada como grupo BI mediante análisis de endonucleasa de restricción, como NAP1 de campo pulsado norteamericano mediante electroforesis en gel de campo pulsado y como ribotipo 027; la diferente terminología refleja las técnicas predominantes utilizadas para la tipificación epidemiológica. Esta cepa se conoce como C. difficile BI/NAP1/027.
Factores de riesgo
Antibióticos
C. difficile se asocia más fuertemente con el uso de estos antibióticos: fluoroquinolonas, cefalosporinas y clindamicina.
Algunas investigaciones sugieren que el uso rutinario de antibióticos en la cría de ganado está contribuyendo a brotes de infecciones bacterianas como C. difícil.
Entorno sanitario
Las personas se infectan con mayor frecuencia en hospitales, residencias de ancianos u otras instituciones médicas, aunque la infección fuera de los entornos médicos está aumentando. Las personas pueden desarrollar la infección si tocan objetos o superficies contaminadas con heces y luego se tocan la boca o las membranas mucosas. Los trabajadores de la salud posiblemente podrían propagar las bacterias o contaminar las superficies mediante el contacto con las manos. La tasa de C. difficile se estima que es del 13% en aquellos con estancias hospitalarias de hasta dos semanas, y del 50% en estancias superiores a cuatro semanas.
La hospitalización prolongada o la residencia en un asilo de ancianos durante el año anterior son factores de riesgo independientes para una mayor colonización.
Medicamentos para suprimir el ácido
Las tasas crecientes de ICD adquirida en la comunidad están asociadas con el uso de medicamentos para suprimir la producción de ácido gástrico: los antagonistas de los receptores H2 aumentaron el riesgo 1,5 veces, y los inhibidores de la bomba de protones 1,7 con el uso una vez al día y 2,4 con más de uso una vez al día. También se encuentra un mayor riesgo de CDI recurrente con el uso de represión del ácido gástrico en estudios observacionales, con una tasa del 22,1%, en comparación con pacientes sin represión del ácido gástrico que tiene una tasa del 17,3% de CDI recurrente.
Enfermedades diarreicas
Las personas con antecedentes recientes de enfermedades diarreicas tienen un mayor riesgo de ser colonizadas por C. difficile cuando se expone a esporas, incluido el abuso de laxantes y patógenos gastrointestinales. Se cree que las alteraciones que aumentan la motilidad intestinal elevan transitoriamente la concentración de azúcares dietéticos disponibles, lo que permite C. difficile para proliferar y afianzarse en el intestino. Aunque no todos los eventos de colonización conducen a la enfermedad, los portadores asintomáticos permanecen colonizados durante años. Durante este tiempo, la abundancia de C. difficile varía considerablemente de un día a otro, lo que provoca períodos de mayor diseminación que podrían contribuir sustancialmente a las tasas de infección adquirida en la comunidad.
Otro
Como resultado de la supresión de bacterias saludables, a través de la pérdida de una fuente de alimento bacteriano, el uso prolongado de una dieta elemental aumenta el riesgo de desarrollar C. difficile infección. Los niveles bajos de albúmina sérica son un factor de riesgo para el desarrollo de C. difficile y cuando se infecta por enfermedad grave. Los efectos protectores de la albúmina sérica pueden estar relacionados con la capacidad de esta proteína para unirse al C. difficile toxina A y toxina B, lo que impide la entrada a los enterocitos.
La enfermedad renal crónica (ERC) se ha identificado como un factor de riesgo en el desarrollo de una C. difficile infección. Los pacientes con ERC tienen un mayor riesgo de infección inicial y recurrente, así como una mayor probabilidad de infección grave, que aquellos sin ERC.
Fisiopatología
El uso de antibióticos sistémicos, incluidas penicilinas/cefalosporinas de amplio espectro, fluoroquinolonas y clindamicina, provoca que se altere la microbiota normal del intestino. En particular, cuando el antibiótico elimina otras bacterias competidoras en el intestino, las bacterias que queden tendrán menos competencia por el espacio y los nutrientes. El efecto neto es permitir un crecimiento más extenso de lo normal de ciertas bacterias. C. difficile es uno de esos tipos de bacteria. Además de proliferar en el intestino, C. difficile también produce toxinas. Sin toxina A ni B, C. difficile puede colonizar el intestino, pero es poco probable que cause colitis pseudomembranosa. La colitis asociada con una infección grave es parte de una reacción inflamatoria, en la que la "pseudomembrana" Formado por una colección viscosa de células inflamatorias, fibrina y células necróticas.
Diagnóstico
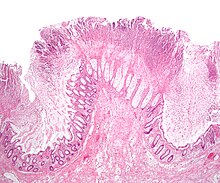


Antes de la llegada de las pruebas para detectar C. difficile, el diagnóstico se realizó con mayor frecuencia mediante colonoscopia o sigmoidoscopia. La aparición de "pseudomembranas" en la mucosa del colon o del recto es muy sugerente, pero no diagnóstica de la afección. Las pseudomembranas están compuestas por un exudado formado por restos inflamatorios, glóbulos blancos. Aunque todavía se emplean la colonoscopia y la sigmoidoscopia, ahora se realizan pruebas de heces para detectar la presencia de C. difficile es frecuentemente el enfoque diagnóstico de primera línea. Por lo general, sólo se analizan dos toxinas (la toxina A y la toxina B), pero el organismo produce varias otras. Esta prueba no es 100% precisa y presenta una tasa considerable de falsos negativos incluso si se repite la prueba.
Clasificación
La CDI se puede clasificar en CDI no grave, CDI grave y CDI fulminante según los parámetros de creatinina y recuento de glóbulos blancos.
Ensayo de citotoxicidad
C. difficile tienen un efecto citopático en el cultivo celular, y la neutralización de cualquier efecto observado con antisueros específicos es el estándar de oro práctico para los estudios que investigan nuevas técnicas de diagnóstico de ICD. El cultivo toxigénico, en el que los organismos se cultivan en medios selectivos y se analizan para determinar la producción de toxinas, sigue siendo el estándar de oro y es la prueba más sensible y específica, aunque es lento y requiere mucho trabajo.
ELISA de toxina
La evaluación de las toxinas A y B mediante un ensayo inmunoabsorbente ligado a enzimas (ELISA) para la toxina A o B (o ambas) tiene una sensibilidad del 63 al 99 % y una especificidad del 93 al 100 %, dependiendo de los ensayos de detección.
Anteriormente, los expertos recomendaban enviar hasta tres muestras de heces para descartar enfermedades si las pruebas iniciales son negativas, pero la evidencia sugiere que las pruebas repetidas durante el mismo episodio de diarrea tienen un valor limitado y se deben desalentar. C. difficile debe eliminarse de las heces de alguien previamente infectado si el tratamiento es eficaz. Muchos hospitales solo realizan pruebas para detectar la toxina A prevalente. Sin embargo, ahora en muchos hospitales hay cepas que expresan solo la toxina B, por lo que se deben realizar pruebas para ambas toxinas. No realizar pruebas para ambos puede contribuir a retrasar la obtención de resultados de laboratorio, lo que a menudo es la causa de enfermedades prolongadas y malos resultados.
Otras pruebas de heces
Las mediciones de leucocitos en heces y los niveles de lactoferrina en heces también se han propuesto como pruebas de diagnóstico, pero pueden tener una precisión diagnóstica limitada.
Reacción en cadena de la polimerasa (PCR)
Las pruebas de muestras de heces mediante la reacción en cadena de la polimerasa en tiempo real pueden detectar C. difficile aproximadamente el 93% de las veces y cuando es positivo es incorrectamente positivo aproximadamente el 3% de las veces. Esto es más preciso que el cultivo citotoxigénico o el ensayo de citotoxicidad celular. Otro beneficio es que el resultado se puede lograr en tres horas. Los inconvenientes incluyen un mayor costo y el hecho de que la prueba sólo busca el gen de la toxina y no la toxina en sí. Esto último significa que si la prueba se utiliza sin confirmación, puede ocurrir un sobrediagnóstico. Repetir las pruebas puede ser engañoso y es muy poco probable que analizar muestras más de una vez cada siete días en personas sin nuevos síntomas arroje información útil. La especificidad de la detección es relativamente baja debido al elevado número de casos falsos positivos de infección asintomática.
Prevención
La autocontención alojando a las personas en habitaciones privadas es importante para evitar la propagación del C. difícil. Las precauciones de contacto son una parte importante para prevenir la propagación de C. difficile. C. difficile no suele aparecer en personas que no toman antibióticos, por lo que limitar el uso de antibióticos disminuye el riesgo.
Antibióticos
El método más eficaz para prevenir la ICD es la prescripción adecuada de antibióticos. En el ámbito hospitalario, donde la CDI es más común, la mayoría de las personas que desarrollan CDI están expuestas a antibióticos. Aunque se recomienda encarecidamente la prescripción adecuada de antibióticos, alrededor del 50% se considera inapropiada. Esto es consistente ya sea en el hospital, la clínica, la comunidad o el entorno académico. Se ha demostrado que una disminución de la CDI al limitar los antibióticos o al limitar las prescripciones innecesarias en general, tanto en un entorno de brote como en otros lugares, está más fuertemente asociada con una reducción de la CDI. Además, las reacciones a los medicamentos pueden ser graves: las infecciones por CDI fueron el factor más común que contribuyó a los eventos adversos por medicamentos observados en hospitales de EE. UU. en 2011. En algunas regiones del Reino Unido, la reducción del uso de antibióticos de fluoroquinolonas parece conducir a tasas reducidas de CDI.
Probióticos
Alguna evidencia indica que los probióticos pueden ser útiles para prevenir infecciones y recurrencias. Tratamiento con Saccharomyces boulardii en personas no inmunocomprometidas con C. difficile también puede resultar útil. Inicialmente, en 2010, la Sociedad Estadounidense de Enfermedades Infecciosas recomendó contra su uso debido al riesgo de complicaciones. Sin embargo, revisiones posteriores no encontraron un aumento de los efectos adversos con el tratamiento y el tratamiento general parece seguro y moderadamente eficaz para prevenir la diarrea asociada a Clostridium difficile.
Un estudio en particular encontró que parece haber un "efecto protector" de probióticos, reduciendo específicamente el riesgo de diarrea asociada a antibióticos (DAA) en un 51% en 3.631 pacientes ambulatorios, pero es importante señalar que no se especificaron los tipos de infecciones en los sujetos. El yogur, las tabletas y los suplementos dietéticos son sólo algunos ejemplos de probióticos disponibles para las personas.
Control de infecciones
Se requieren protocolos de infección rigurosos para minimizar este riesgo de transmisión. Las medidas de control de infecciones, como el uso de guantes y dispositivos médicos no críticos utilizados por una sola persona con CDI, son efectivas en la prevención. Esto funciona limitando la propagación de C. difficile en el ámbito hospitalario. Además, lavarse con agua y jabón eliminará las esporas de las manos contaminadas, pero los desinfectantes para manos a base de alcohol no son efectivos. Estas precauciones deben mantenerse entre las personas hospitalizadas durante al menos 2 días después de que haya cesado la diarrea.
Se ha demostrado que las toallitas blanqueadoras que contienen 0,55 % de hipoclorito de sodio matan las esporas y previenen la transmisión. Instalar inodoros con tapa y cerrar la tapa antes de tirar de la cadena también reduce el riesgo de contaminación.
Aquellos que tienen CDI deben estar en habitaciones con otras personas con CDI o solos cuando estén en el hospital.
Los desinfectantes hospitalarios comunes no son eficaces contra el C. difficile y pueden promover la formación de esporas, pero varios oxidantes (por ejemplo, una solución de hipoclorito de sodio al 1%) las destruyen rápidamente. Se ha demostrado que los sistemas de vapor de peróxido de hidrógeno (VPH) utilizados para esterilizar una habitación después de completar el tratamiento reducen las tasas de infección y reducen el riesgo de infección para otras personas. La incidencia de CDI se redujo en un 53% o un 42% mediante el uso del VPH. Dispositivos de limpieza ultravioleta y personal de limpieza especialmente dedicado a la desinfección de las habitaciones de personas con C. difficile después del alta puede ser eficaz.
Tratamiento
Llevando C. difficile sin síntomas es común. El tratamiento en personas sin síntomas es controvertido. En general, los casos leves no requieren un tratamiento específico. La terapia de rehidratación oral es útil para tratar la deshidratación asociada con la diarrea.
Medicamentos
Se utilizan varios antibióticos diferentes para la C. difficile, siendo los agentes disponibles más o menos igualmente eficaces.
La vancomicina o la fidaxomicina por vía oral son las que normalmente se recomiendan para infecciones leves, moderadas y graves. También son el tratamiento de primera línea para mujeres embarazadas, especialmente porque el metronidazol puede causar defectos de nacimiento. La vancomicina típica, 125 mg, se toma cuatro veces al día por vía oral durante 10 días. La fidaxomicina se toma en dosis de 200 mg dos veces al día durante 10 días. También se puede administrar por vía rectal si la persona desarrolla un íleo.
La fidaxomicina se tolera tan bien como la vancomicina y puede tener un menor riesgo de recurrencia. Se ha descubierto que la fidaxomicina es tan eficaz como la vancomicina en personas con enfermedad leve a moderada, y puede ser mejor que la vancomicina en personas con enfermedad grave. La fidaxomicina se puede usar en personas que tienen infecciones recurrentes y no han respondido a otros antibióticos. Se recomienda metronidazol (500 mg 3 veces al día durante 10 días) por vía oral como tratamiento alternativo sólo para C. difficile cuando la persona afectada es alérgica a los tratamientos de primera línea, no los tolera o tiene dificultades económicas que le impiden acceder a ellos. En la enfermedad fulminante, la vancomicina por vía oral y el metronidazol intravenoso se utilizan comúnmente juntos.
Los medicamentos utilizados para retardar o detener la diarrea, como la loperamida, sólo pueden usarse después de iniciar el tratamiento.
La colestiramina, una resina de intercambio iónico, es eficaz para unir las toxinas A y B, ralentizar la motilidad intestinal y ayudar a prevenir la deshidratación. Se recomienda colestiramina con vancomicina. Un tratamiento de último recurso en personas inmunodeprimidas es la inmunoglobulina intravenosa. Los anticuerpos monoclonales contra la toxina A y la toxina B de C. difficile están aprobados para prevenir la recurrencia de C. difficile incluyendo bezlotoxumab.
Probióticos
La evidencia que respalda el uso de probióticos en el tratamiento de enfermedades activas es insuficiente. Recientemente, los investigadores han comenzado a adoptar un enfoque mecánico para los productos derivados de las heces. Se sabe que ciertos microbios con actividad 7α-deshidroxilasa pueden metabolizar ácidos biliares primarios a secundarios, que inhiben C. difficile. Por tanto, la incorporación de dichos microbios en productos terapéuticos como los probióticos puede tener un efecto protector, aunque se necesitan más investigaciones preclínicas.
Trasplante de microbiota fecal
El trasplante de microbiota fecal, también conocido como trasplante de heces, tiene aproximadamente entre un 85% y un 90% de efectividad en aquellos para quienes los antibióticos no han funcionado. Se trata de la infusión de la microbiota adquirida de las heces de un donante sano para revertir el desequilibrio bacteriano responsable de la naturaleza recurrente de la infección. El procedimiento repone la microbiota normal del colon que había sido eliminada por los antibióticos y restablece la resistencia a la colonización por Clostridioides difficile. Los efectos secundarios, al menos inicialmente, son pocos.
La microbiota fecal viva (Rebyota) fue aprobada para uso médico en los Estados Unidos en noviembre de 2022.
Las esporas vivas de microbiota fecal (Vowst) se aprobaron para uso médico en los Estados Unidos en abril de 2023. Es el primer producto de microbiota fecal que se ingiere por vía oral.
Cirugía
En personas con C grave. difficile colitis, la colectomía puede mejorar los resultados. Se pueden utilizar criterios específicos para determinar quién se beneficiará más de la cirugía.
Infección recurrente
La ICD recurrente ocurre en 20 a 30% de los pacientes, con tasas de recurrencia crecientes con cada episodio posterior. En entornos clínicos, es prácticamente imposible distinguir una recurrencia que se desarrolla como una recaída de CDI con la misma cepa de C. difficile versus reinfección que es el resultado de una nueva cepa.
Existen varias opciones de tratamiento para la infección recurrente por C difficile. Para el primer episodio de infección recurrente por C difficile, las pautas de la IDSA de 2017 recomiendan vancomicina oral en una dosis de 125 mg cuatro veces al día durante 10 días si se usó metronidazol para el episodio inicial. Si se utilizó vancomicina oral para el episodio inicial, entonces se administró una dosis prolongada de pulsos de vancomicina oral de 125 mg cuatro veces al día durante 10 a 14 días, seguida de una reducción gradual (dos veces al día durante una semana, luego cada dos o tres días durante 2 a 8 semanas).) o fidaxomicina 200 mg dos veces al día durante 10 días. Para un segundo episodio recurrente, la IDSA recomienda opciones que incluyen la dosis oral en pulsos de vancomicina oral antes mencionada seguida de una reducción gradual prolongada; vancomicina oral 125 mg cuatro veces al día durante 10 días seguida de rifaximina 400 mg tres veces al día durante 20 días; fidaxomicina 200 mg dos veces al día durante 10 días, o un trasplante de microbiota fecal.
Para los pacientes con infecciones por C. diff que no se resuelven con regímenes antibióticos tradicionales, los trasplantes de microbioma fecal cuentan con una tasa de curación promedio de>90%. En una revisión de 317 pacientes, se demostró que conducía a la resolución en el 92% de los casos de enfermedades persistentes y recurrentes. Está claro que la restauración de la flora intestinal es primordial en la lucha contra la ICD recurrente. Con una terapia antibiótica eficaz, se puede reducir C. difficile y desarrollar resistencia a la colonización natural con el tiempo a medida que la comunidad microbiana natural se recupera. La reinfección o la recurrencia pueden ocurrir antes de que se complete este proceso. El trasplante de microbiota fecal puede acelerar esta recuperación al reemplazar directamente a los miembros faltantes de la comunidad microbiana. Sin embargo, la materia fecal de origen humano es difícil de estandarizar y tiene múltiples riesgos potenciales, incluida la transferencia de material infeccioso y las consecuencias a largo plazo de inocular el intestino con material fecal extraño. Como resultado, se necesitan más investigaciones para estudiar los resultados efectivos a largo plazo del FMT.
Pronóstico
Después de un primer tratamiento con metronidazol o vancomicina, C. difficile reaparece en aproximadamente el 20% de las personas. Esto aumenta al 40% y al 60% con recurrencias posteriores.
Epidemiología
C. Se estima que la diarrea difficile ocurre en ocho de cada 100.000 personas cada año. Entre los que ingresan en el hospital, se produce entre cuatro y ocho personas por cada 1.000. En 2011, provocó alrededor de medio millón de infecciones y 29.000 muertes en Estados Unidos.
Debido en parte a la aparición de una cepa resistente a las fluoroquinolonas, C. difficile las muertes relacionadas aumentaron un 400% entre 2000 y 2007 en Estados Unidos. Según los CDC, "C. difficile se ha convertido en la causa microbiana más común de infecciones asociadas a la atención médica en los hospitales de EE. UU. y cuesta hasta $4.8 mil millones cada año en costos excesivos de atención médica solo para los centros de cuidados intensivos."
Historia
Ivan C. Hall y Elizabeth O'Toole nombraron por primera vez a la bacteria Bacillus difficilis en 1935, eligiendo su epíteto específico porque era resistente a los primeros intentos de aislamiento y crecía muy lentamente en cultivo. André Romain Prévot lo transfirió posteriormente a Clostridium, binomen Clostridium difficile. Su combinación se cambió posteriormente a Clostridiodes difficile después de ser transferida al nuevo género Clostridioides.
La colitis pseudomembranosa se describió por primera vez como una complicación de C. difficile en 1978, cuando se aisló una toxina de personas con colitis pseudomembranosa y se cumplieron los postulados de Koch.
Brotes notables
- On 4 June 2003, two outbreaks of a highly virulent strain of this bacterium were reported in Montreal, Quebec, and Calgary, Alberta. Las fuentes sitúan el número de muerte en 36 y en 89, con alrededor de 1.400 casos en 2003 y en los primeros meses de 2004. Los CDI continuaron siendo un problema en el sistema de salud de Quebec a finales de 2004. En marzo de 2005 se había extendido a la zona de Toronto, hospitalizando a 10 personas. Uno murió mientras los otros estaban siendo liberados.
- Entre 2003 y 2005 se produjo un brote similar en el Hospital Stoke Mandeville del Reino Unido. La epidemiología local C. difficile puede ofrecer pistas sobre cómo su propagación puede relacionarse con el tiempo que un paciente pasa en el hospital y / o un centro de rehabilitación. También muestra la capacidad de las instituciones para detectar mayores tasas y su capacidad para responder con campañas más agresivas de lavado de manos, métodos de cuarentena y la disponibilidad de yogur que contengan culturas vivas a pacientes en riesgo de infección.
- Tanto los brotes canadienses como el inglés posiblemente estaban relacionados con la cepa aparentemente más virulenta NAP1/027 de la bacteria. Conocido como cepa de Quebec, se ha implicado en una epidemia en dos hospitales holandeses (Harderwijk y Amersfoort, ambos 2005). Una teoría para explicar el aumento de la virulencia de 027 es que es un hiperproductor de ambas toxinas A y B y que ciertos antibióticos pueden estimular la bacteria a hiperproducir.
- On 1 October 2006, C. difficile se dijo que había matado al menos 49 personas en los hospitales de Leicester, Inglaterra, más de ocho meses, según una investigación del Servicio Nacional de Salud. Otros 29 casos similares fueron investigados por coroners. Un memo filtrado del Departamento de Salud del Reino Unido poco después reveló una preocupación significativa en el gobierno acerca de la bacteria, descrita como "endémica en todo el servicio de salud"
- On 27 October 2006, nine deaths were attributed to the bacterium in Quebec.
- On 18 November 2006, the bacterium was reported to have been responsible for 12 deaths in Quebec. Este 12 reportó que la muerte fue sólo dos días después de que el Honoré Mercier de San Hyacinthe anunciara que el brote estaba bajo control. Se diagnosticó a 31 personas con ICD. Los equipos de limpieza tomaron medidas en un intento de despejar el brote.
- C. difficile fue mencionado en 6.480 certificados de defunción en 2006 en el Reino Unido.
- On 27 February 2007, a new outbreak was identified at Trillium Health Centre in Mississauga, Ontario, where 14 people were diagnosed with CDIs. Las bacterias eran de la misma tensión que la de Quebec. Los funcionarios no han podido determinar si C. difficile fue responsable de la muerte de cuatro personas durante los dos meses anteriores.
- Entre febrero y junio de 2007, tres personas en el Hospital Loughlinstown de Dublín (Irlanda) fueron encontradas por el forense que murieron como resultado de la muerte de C. difficile infección. In an inquest, the Coroner's Court found the hospital had no designated infection control team or consultant microbiologist on staff.
- Entre junio de 2007 y agosto de 2008, Northern Health and Social Care Trust Northern Ireland, Antrim Area, Braid Valley, Mid Ulster Hospitals fueron objeto de investigación. During the inquiry, expert reviewers concluded that C. difficile fue implicado en 31 de estas muertes, como causa subyacente en 15, y como causa contribuyente en 16. Durante ese tiempo, el examen también observó 375 casos de ICD en los que se estaban tratando en el hospital.
- En octubre de 2007, Maidstone y Tunbridge Wells NHS La Comisión de Salud criticó fuertemente la confianza en lo que respecta a su manejo de un brote importante de C. difficile in its hospitals in Kent from April 2004 to September 2006. En su informe, la Comisión estimó que aproximadamente 90 personas "definidamente o probablemente" murieron como resultado de la infección.
- En noviembre de 2007, la tensión 027 se diseminó en varios hospitales del sur de Finlandia, con 10 muertes de 115 personas infectadas reportadas el 2007-12-14.
- En noviembre de 2009, cuatro muertes en el Hospital Nuestra Señora de Lourdes en Irlanda tienen posibles vínculos con el CDI. Otras 12 personas probaron positivo para la infección, y otras 20 mostraron signos de infección.
- De febrero de 2009 a febrero de 2010, 199 personas en el hospital Herlev de Dinamarca fueron sospechosas de estar infectadas con la cepa 027. En la primera mitad de 2009, 29 murieron en los hospitales de Copenhague después de estar infectados con la bacteria.
- En mayo de 2010, un total de 138 personas en cuatro hospitales diferentes en Dinamarca se infectaron con la cepa 027 más hubo algunas ocurrencias aisladas en otros hospitales.
- En mayo de 2010, 14 víctimas mortales estaban relacionadas con la bacteria en el estado australiano de Victoria. Dos años después, se detectó la misma cepa de la bacteria en Nueva Zelanda.
- El 28 de mayo de 2011, se informó de un brote en Ontario, con 26 muertes al 24 de julio de 2011.
- En 2012/2013, un total de 27 personas en un hospital en el sur de Suecia (Ystad) fueron infectadas con 10 muertes. Cinco murieron por la tensión 017.
Etimología y pronunciación
El nombre del género proviene del griego klōstēr (κλωστήρ), "huso", y el nombre específico proviene del latín difficile, forma singular neutra de difficilis "difícil, obstinado", elegido en referencia al fastidio en el cultivo.
Con respecto a la pronunciación de las asignaciones de género actuales y anteriores, Clostridioides es y Clostridium es. Ambos géneros todavía tienen especies asignadas, pero esta especie ahora se clasifica en el primero. A través de las normas de nomenclatura binomial, se entiende que el antiguo nombre binomial de esta especie es ahora un alias.
En cuanto al nombre específico, es la norma tradicional, que refleja cómo el inglés médico suele pronunciar palabras del nuevo latín naturalizadas (que a su vez refleja en gran medida la pronunciación inglesa tradicional del latín), aunque a veces también se utiliza una pronunciación restaurada de (la pronunciación latina clásica se reconstruye como [kloːsˈtrɪdɪ.ũː dɪfˈfɪkɪlɛ]). El nombre específico también se pronuncia comúnmente como si fuera francés, lo que desde un punto de vista prescriptivo es una "mala pronunciación" pero desde un punto de vista lingüísticamente descriptivo no puede calificarse de erróneo por su uso muy extendido entre los profesionales de la salud; se puede describir como "la variante no preferida" desde el punto de vista de ceñirse con mayor regularidad al nuevo latín en la nomenclatura binomial, que también es un punto de vista válido, aunque los nombres específicos del nuevo latín contienen una gama tan amplia de raíces extralatinas (incluidos apellidos y referencias jocosas) que la pronunciación extralatina está involucrada. de todos modos (como se ve, por ejemplo, con Ba humbugi, Spongiforma squarepantsii y cientos de otros).
Investigación
- A partir de 2019, los candidatos a vacunas que proporcionan inmunidad contra C. difficile toxin A y C. difficile toxin B han avanzado más en la investigación clínica, pero no previenen la colonización bacteriana. Un candidato a vacunas por Pfizer está en un ensayo clínico de fase 3 que se estima que se completará en septiembre de 2021 y un candidato a vacunas por GlaxoSmithKline se encuentra en un ensayo clínico de fase 1 que se estima que se completará en julio de 2021.
- CDA-1 y CDB-1 (también conocido como MDX-066/MDX-1388 y MBL-CDA1/MBL-CDB1) es una combinación de anticuerpos monoclonal codesarrollada por los Laboratorios biológicos Medarex y Massachusetts (MBL) para apuntar y neutralizar C. difficile toxinas A y B, para el tratamiento del CDI. Merck & Co., Inc. adquirió derechos mundiales para desarrollar y comercializar CDA-1 y CDB-1 mediante un acuerdo de licencia exclusivo firmado en abril de 2009. Se pretende como terapia adicional a uno de los antibióticos existentes para tratar el CDI.
- Nitazoxanida es un derivado de nitrothiazol-salicylamida sintético indicado como un agente antiprotozoal (Aprobado por la FDA para el tratamiento de la diarrea infecciosa causada por Cryptosporidium parvum y Giardia lamblia) y también se está estudiando en C. difficile infecciones vs. vancomycin.
- Rifaximin, es un antibiótico semisintético en estadio clínico, basado en rifamicina, no sistémico para la ICD. Es aprobado por la FDA para el tratamiento de la diarrea infecciosa y está siendo desarrollado por Salix Pharmaceuticals.
- Otros medicamentos para el tratamiento del CDI están en desarrollo e incluyen rifalazil, tigeciclina, ramoplanina, ridinilazol y SQ641.
- La investigación ha estudiado si el apéndice tiene alguna importancia C. difficile. Se cree que el apéndice tiene una función de vivienda buena flora intestinal. En un estudio realizado en 2011, se demostró que cuando C. difficile bacterias fueron introducidas en el intestino, el apéndice células alojadas que aumentaron la respuesta anticuerpo del cuerpo. Las células B del apéndice migran, maduran y aumentan la producción de anticuerpos IgA e IgG específicos de toxina, lo que da lugar a una mayor probabilidad de que la flora intestinal viva contra la C. difficile bacterias.
- Tomando tipos no tóxicos C. difficile después de una infección tiene resultados prometedores con respecto a la prevención de futuras infecciones.
- Tratamiento con bacteriófagos dirigidos contra cepas específicas de producción de toxina C difficile también están siendo probados.
- Un estudio en 2017 enlazó la enfermedad severa a la traición en la dieta.
Otros animales
- Colitis-X (en caballos)