Implantación (embriología)
La implantación, también conocida como nidación, es la etapa del desarrollo embrionario de los mamíferos en la que el blastocisto eclosiona, se adhiere e invade el endometrio del útero de la hembra. La implantación es la primera etapa de la gestación y, cuando se logra, se considera que la hembra está embarazada. Un embrión implantado se detecta por la presencia de niveles elevados de gonadotropina coriónica humana (hCG) en una prueba de embarazo. El embrión implantado recibirá oxígeno y nutrientes para crecer.
Para que se produzca la implantación, el útero debe volverse receptivo. La receptividad uterina implica una gran comunicación cruzada entre el embrión y el útero, lo que inicia cambios en el endometrio. Esta etapa genera una sincronía que abre una ventana de implantación que permite la implantación exitosa de un embrión viable. El sistema endocannabinoide desempeña un papel vital en esta sincronía en el útero, influyendo en la receptividad uterina y la implantación del embrión. El embrión expresa receptores cannabinoides en las primeras etapas de su desarrollo que responden a la anandamida (AEA) secretada en el útero. La AEA se produce en niveles más altos antes de la implantación y luego se regula a la baja en el momento de la implantación. Esta señalización es importante en la comunicación cruzada embrión-útero para regular el momento de la implantación embrionaria y la receptividad uterina. Se necesitan concentraciones adecuadas de AEA que no sean ni demasiado altas ni demasiado bajas para una implantación exitosa.
Existe una amplia variación en el tipo de células del trofoblasto y las estructuras de la placenta en las diferentes especies de mamíferos. De las cinco etapas reconocidas de implantación, incluidas dos etapas previas a la implantación que preceden a la placentación, las primeras cuatro son similares en todas las especies. Las cinco etapas son migración y eclosión, precontacto, unión, adhesión e invasión. Las dos etapas previas a la implantación están asociadas con el embrión previo a la implantación.
En los seres humanos, tras la etapa de eclosión que tiene lugar alrededor de cuatro o cinco días después de la fecundación, comienza el proceso de implantación. Al final de la primera semana, el blastocisto se adhiere superficialmente al endometrio uterino. Al final de la segunda semana, la implantación se ha completado.
Etapas de implantación
Existen cinco etapas reconocidas de implantación en los mamíferos, incluidas dos etapas previas a la implantación que preceden a la formación de la placenta. Son: migración y eclosión, precontacto, unión, adhesión e invasión. Las primeras cuatro etapas son similares en todas las especies y el proceso de invasión es variable. Estas tres etapas de aposición, unión e invasión también se denominan alternativamente contacto (aposición), adhesión (unión) y penetración (invasión), y solo pueden tener lugar durante un período de tiempo limitado conocido como la ventana de implantación, cuando el útero está en su punto más receptivo.
Migración y pillaje
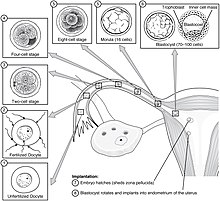
En la implantación intervienen dos etapas de migración: la primera es la migración del cigoto y la segunda es la migración del trofoblasto. La fecundación del ovocito se lleva a cabo en la ampolla de la trompa de Falopio. Los cilios que recubren la trompa mueven al cigoto en su migración hacia el útero.
Durante esta migración, el cigoto sufre una serie de divisiones celulares que dan lugar a una bola de 16 blastómeros compactados llamada mórula. La mórula entra en el útero después de tres o cuatro días y, al hacerlo, se forma en la mórula una cavidad llamada blastocele para producir el blastocisto. El blastocisto contiene la masa celular interna que se desarrollará hasta convertirse en el embrión propiamente dicho y una capa celular externa de trofoblastos que se convertirá en las membranas extraembrionarias (membranas fetales).
El blastocisto todavía está encerrado en la capa del huevo, conocida como zona pelúcida, y para poder implantarse en la pared uterina debe deshacerse de esta cubierta. Esta etapa se conoce como eclosión de la zona y, cuando hay suficiente disolución, el blastocisto puede iniciar la etapa de aposición de la implantación. Los factores líticos de la cavidad uterina, así como los factores del propio blastocisto, son esenciales para la descomposición de la capa del huevo. Los mecanismos en este último caso están indicados por el hecho de que la zona pelúcida permanece intacta si se coloca un óvulo no fertilizado en el útero en las mismas condiciones.
Entre los reguladores moleculares conocidos que promueven la eclosión se encuentran predominantemente las proteasas que son estimuladas por varios factores de crecimiento. El blastocisto también produce citocinas, tanto proinflamatorias como antiinflamatorias, que tienen papeles cruciales durante la implantación y otras etapas del embarazo. Ambos tipos de citocinas modulan la actividad de las proteasas, incluyendo las MMP, los activadores del plasminógeno y las catepsinas. Se desconoce si las citocinas involucradas en la eclosión son proinflamatorias o antiinflamatorias, o qué proteasas están involucradas. Sin embargo, es bien aceptado que las citocinas proinflamatorias son dominantes durante la implantación. Las citocinas también están presentes en la leche uterina que podría regular el desarrollo y la función del blastocisto, pero no hay evidencia que respalde su participación en la eclosión. El factor inhibidor de la leucemia (LIF) es una citocina proinflamatoria expresada en el endometrio durante la fase lútea del ciclo menstrual, con la expresión más alta observada durante la ventana de implantación. El LIF desempeña un papel en la adhesión y la invasión.
La eclosión asistida puede tener lugar en la reproducción asistida, en la que la zona pelúcida puede perforarse artificialmente para facilitar la eclosión.
Propuesta
Después de la eclosión de la zona, la primera conexión o contacto suelto entre el blastocisto y el endometrio se denomina aposición. La aposición se produce normalmente cuando hay una pequeña cripta en el endometrio y también cuando se ha producido una ruptura suficiente de la zona pelúcida para permitir que el trofoblasto del blastocisto entre en contacto directo con el endometrio subyacente. En última instancia, la masa celular interna (también embrioblasto), dentro de la capa del trofoblasto, se alinea más cerca de la decidua. Si la masa celular interna no está alineada con la decidua en la aposición, tiene la capacidad de rotar libremente dentro del trofoblasto y lograr esta alineación. La aposición es solo una interacción débil del trofectodermo con el epitelio uterino que es inestable a la tensión de corte. La aposición también es reversible, lo que permite el reposicionamiento del blastocisto en el útero.
Adhesión
La adhesión es una unión mucho más fuerte con el endometrio que la aposición laxa.
Los trofoblastos se adhieren penetrando el endometrio, con protrusiones de células trofoblásticas.
Esta actividad de adhesión se lleva a cabo mediante microvellosidades que se encuentran en el trofoblasto. El trofoblasto tiene conexiones de fibras de unión, laminina, colágeno tipo IV e integrinas que ayudan en este proceso de adhesión.
La mucina-16 es una mucina transmembrana expresada en la superficie apical de los epitelios uterinos. Esta mucina evita que el blastocisto se implante en un lugar no deseado del epitelio. Por lo tanto, la mucina-16 inhibe la adhesión entre células. Se ha demostrado que su eliminación durante la formación de pinópodos facilita la invasión del trofoblasto in vitro.
La identidad de las moléculas del trofoblasto y del epitelio endometrial que median la interacción inicial entre ambos permanece sin identificar. Sin embargo, varios grupos de investigación han propuesto que MUC1, un miembro de la familia de las mucinas de proteínas glicosiladas, está implicada. MUC1 es una glicoproteína transmembrana expresada en la superficie apical de las células epiteliales endometriales durante la ventana de implantación en humanos y se ha demostrado que se expresa de manera diferencial entre sujetos fértiles e infértiles durante este tiempo. MUC1 presenta fracciones de carbohidratos en su dominio extracelular que son ligandos de la L-selectina, una molécula de adhesión celular en la superficie de las células del trofoblasto. Un modelo in vitro de implantación proporcionó evidencia para apoyar la hipótesis de que la L-selectina media la aposición del blastocisto al epitelio uterino al interactuar con sus ligandos.
Invasión
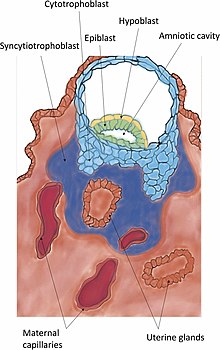
La invasión es el establecimiento posterior del blastocisto en el endometrio. Las protuberancias de células del trofoblasto que se adhieren al endometrio continúan proliferando y penetrando en el endometrio utilizando las gelatinasas A (MMP-2) y B (MMP-9). Los trofoblastos invaden el útero intentando alcanzar el suministro de sangre materna, para establecer las bases para el flujo sanguíneo fetal. También secretan factor de preimplantación, un péptido que ayuda a su invasión y a la formación de la placenta. A medida que estos trofoblastos penetran, se fusionan con sus vecinos, diferenciándose terminalmente en un tejido multinucleado, un sincitio conocido como sinciciotrofoblasto. Entre esta capa y el blastocisto se encuentra el citotrofoblasto.
Cuando el sinciciotrofoblasto alcanza la membrana basal debajo de las células deciduales, las desaloja para invadir aún más el estroma uterino. El desalojo se logra degradando las moléculas de adhesión celular (CAM) que unen las células deciduales y la matriz extracelular asociada. La degradación se logra mediante la secreción del factor de necrosis tumoral alfa del sinciciotrofoblasto, que inhibe la expresión de CAM y beta-catenina. La matriz extracelular es degradada por metaloproteinasas como colagenasas, gelatinasas y metaloproteinasas de matriz, y por serina proteasas. Las colagenasas digieren el colágeno de tipos I, II, III, VII y X. Las gelatinasas existen en dos formas: una que digiere el colágeno de tipo IV y otra que digiere la gelatina. La matriz extracelular es degradada por serina endopeptidasas y metaloproteinasas. El sinciciotrofoblasto puede entonces invadir el endometrio y llevarse consigo al embrión, donde se incrustará. Finalmente, el sinciciotrofoblasto entra en contacto con la sangre materna y forma vellosidades coriónicas, el comienzo de la placentación. Después de la invasión, la brecha en el epitelio uterino creada por la entrada del blastocisto se sella con un tapón de fibrina. El tapón de fibrina es una coagulación de un coágulo de sangre y restos celulares.
Trofoblatos extraordinarios
Los trofoblastos extravellosos son células de las vellosidades invasoras que migran al miometrio del útero de la madre. Estas células remodelan las arterias espirales para mejorar y asegurar el flujo sanguíneo materno al embrión en crecimiento. También hay evidencia de que este proceso ocurre con las venas uterinas, estabilizándolas para mejorar el drenaje de la sangre fetal y los desechos metabólicos. También se ha documentado que los trofoblastos migran a varios tejidos de la madre. Debido a esto, los trofoblastos han sido implicados en un fenómeno conocido como microquimerismo fetomaterno, donde las células fetales establecen líneas celulares en los tejidos maternos.
Secretos
Se ha demostrado que los blastocistos preimplantacionales son capaces de secretar factores de crecimiento, hormonas y proteasas similares a la tripsina para participar en el proceso de eclosión.
Durante la invasión, el blastocisto secreta factores con múltiples propósitos. Secreta varios factores autocrinos, que se dirigen a sí mismos y los estimulan para que sigan invadiendo el endometrio. La gonadotropina coriónica humana (hCG) es un factor de crecimiento autocrino para el blastocisto, mientras que el factor de crecimiento similar a la insulina 2 estimula su capacidad invasiva. La gonadotropina coriónica humana no solo actúa como inmunosupresor, sino que también le indica a la madre que está embarazada, lo que evita la luteólisis del cuerpo lúteo y la menstruación al mantener la función del cuerpo lúteo. Las secreciones separan las células deciduales entre sí, evitan que la madre rechace al embrión, desencadenan la decidualización final y previenen la menstruación. El factor de preimplantación es secretado por las células del trofoblasto antes de la formación de la placenta.
Immunosuppressive
El embrión es diferente de las células de la madre y, si no segregara agentes inmunosupresores, el sistema inmunitario de la madre lo rechazaría como parásito. Entre estos agentes se encuentran el factor activador de plaquetas, la gonadotropina coriónica humana, el factor de embarazo temprano, la prostaglandina E2, la interleucina-1 alfa, la interleucina 6, el interferón alfa, el factor inhibidor de la leucemia y el factor estimulante de colonias.
Otros factores
Otros factores secretados por el blastocisto son:
- Factor de liberación de la histamina derivado del embrionario
- Tissue plasminogen activador, así como sus inhibidores
- Estradiol
- β1-integrinos
- Factor de crecimiento fibroblasto
- Factor de crecimiento transformador alfa
- Inhibin
Receptividad Uterus
Para permitir la implantación, el útero pasa por cambios para poder recibir el producto de la concepción. La receptividad incluye cambios en las células endometriales en la formación de pinópodos que ayudan a absorber el líquido uterino; cambios en el espesor del endometrio y el desarrollo de su irrigación sanguínea, y la formación de la decidua. En conjunto, estos cambios se conocen como transformación de la membrana plasmática y acercan el blastocisto al endometrio y lo inmovilizan. Durante esta etapa, el blastocisto aún puede eliminarse mediante el lavado fuera del útero.
El éxito de la implantación depende de la viabilidad del embrión y de la receptividad del útero. Un factor decisivo es la sincronía del desarrollo entre el embrión y el útero. La sincronía proporciona un breve período de receptividad conocido como ventana de implantación, e implica una gran interacción entre el blastocisto y el endometrio en esta etapa.
El sistema endocannabinoide desempeña un papel vital en esta sincronía en el útero, influyendo en la receptividad uterina y la implantación del embrión. El embrión expresa receptores cannabinoides en las primeras etapas de su desarrollo que responden a la anandamida (AEA) secretada en el útero. Esta señalización es importante en la comunicación entre el embrión y el útero para regular el momento de la implantación embrionaria y la receptividad uterina. Para que la implantación sea exitosa, se necesitan concentraciones adecuadas de AEA que no sean ni demasiado altas ni demasiado bajas. La IL-6 y la FAAH son cruciales para la receptividad uterina y, junto con la AEA, se ha observado que existe un vínculo con un grosor endometrial adecuado que sustenta el embarazo.
Durante la adhesión, la comunicación cruzada se transmite por interacciones entre el receptor y el ligando, tanto de la integrina y la matriz como de los proteoglicanos. Los receptores de proteoglicanos se encuentran en la superficie de la decidua, y sus contrapartes, los proteoglicanos, se encuentran alrededor de las células del trofoblasto del blastocisto. Este sistema de ligando-receptor también está presente justo en la ventana de implantación. El blastocisto envía señales al endometrio para que se adapte más a su presencia, por ejemplo mediante cambios en el citoesqueleto de las células deciduales. Esto, a su vez, desaloja las células deciduales de su conexión con la lámina basal subyacente, lo que permite al blastocisto realizar la invasión posterior.
Ventana de implante
La ventana de implantación es un período de tiempo limitado para la unión exitosa del blastocisto. En los seres humanos, la receptividad uterina es óptima en los días 20 a 24 de la fase secretora del ciclo menstrual, cuando los niveles de hormona luteinizante están en su punto máximo. La comunicación cruzada entre el embrión y el endometrio tiene lugar durante este tiempo. Las células epiteliales endoteliales que recubren el útero son las primeras células que detectan las señales del blastocisto y las transducen a vías de señalización posteriores. En los seres humanos, la ventana de implantación solo está disponible durante 24 a 36 horas.
Se ha señalado que el microbioma endometrial tiene un papel importante en el éxito de la implantación, ya que controla la función de las células endometriales y la función del sistema inmunitario local que impide el crecimiento de patógenos. Esto está asociado con la secreción de sustancias protectoras.
Pinopodos
Los pinópodos se forman al comienzo de la ventana de implantación y se encuentran en muchas especies. Son protuberancias con forma de hongo que surgen de la membrana celular apical de las células epiteliales uterinas. Los pinópodos se forman por la hinchazón de estas células epiteliales y la fusión de una serie de microvellosidades para alcanzar un tamaño máximo. Aparecen entre el día 19 y el día 21 de la edad gestacional y se forman completamente el día 20. Esto corresponde a una edad de fertilización de aproximadamente cinco a siete días, que se corresponde bien con el momento de la implantación. Los pinópodos solo persisten durante un máximo de dos días y se consideran marcadores ultraestructurales de receptividad.
Su desarrollo se ve potenciado por la progesterona y es inhibido por los estrógenos. Durante la ventana de implantación, la adhesión entre células se ve inhibida por la MUC1, una glucoproteína de la superficie celular que pertenece al glucocáliz. Los pinópodos son más altos que las microvellosidades y sobresalen a través del glucocáliz, lo que permite el contacto directo con el trofoblasto adherido. El atributo más importante de los pinópodos es esta eliminación de glucoproteínas de las superficies celulares de las células epiteliales uterinas. También se ha demostrado que la MUC16 desaparece de las superficies celulares con el desarrollo de los pinópodos. Algunos estudios han informado de que los pinópodos atrapan cilios, lo que impide el movimiento del embrión, y durante la implantación permite el contacto cercano y la adherencia del embrión.
Los pinópodos introducen el líquido uterino y sus macromoléculas en las células mediante el proceso de endocitosis. Esto disminuye el volumen del útero, acercando las paredes al blastocisto que flota en él. Por lo tanto, el período de actividad de los pinópodos podría limitar la ventana de implantación. Los pinópodos continúan absorbiendo líquido y eliminan la mayor parte durante las primeras etapas de la implantación.
Predecidualización
El endometrio aumenta de grosor, se vasculariza y sus glándulas se vuelven tortuosas y se multiplican en sus secreciones. Estos cambios alcanzan su máximo alrededor de siete días después de la ovulación.
Además, la superficie del endometrio produce una especie de células redondeadas que cubren toda la zona hacia la cavidad uterina. Esto ocurre aproximadamente entre 9 y 10 días después de la ovulación. Estas células se denominan células deciduales, lo que subraya que toda la capa de ellas se desprende en cada menstruación si no se produce un embarazo, al igual que las hojas de los árboles de hoja caduca. Las glándulas uterinas, por otro lado, disminuyen su actividad y se degeneran alrededor de 8 a 9 días después de la ovulación en ausencia de embarazo.
Las células deciduales se originan a partir de las células del estroma que siempre están presentes en el endometrio y forman una nueva capa, la decidua. El resto del endometrio, además, expresa diferencias entre el lado luminal y el basal. Las células luminales forman el estrato compacto del endometrio, en contraste con el estrato esponjoso basalolateral, que consiste en las células del estroma, más bien esponjosas.
Decidualización

La decidualización se expande si se produce un embarazo, lo que permite un mayor desarrollo de las glándulas uterinas, la zona compacta y el epitelio de células deciduales que la recubren. Las células deciduales se llenan de lípidos y glucógeno y adoptan la forma poliédrica característica de las células deciduales. Los factores del blastocisto también desencadenan la formación final de las células deciduales en su forma adecuada. Por el contrario, algunas células deciduales en la proximidad del blastocisto se degeneran, lo que le proporciona nutrientes. Un indicio de la influencia embrionaria es que la decidualización se produce en mayor grado en los ciclos de concepción que en los ciclos de no concepción. Además, se observan cambios similares cuando se dan estímulos que imitan la invasión natural del embrión.
El embrión libera proteasas de serina que provocan la despolarización de la membrana de la célula epitelial y activan el canal de sodio epitelial. Esto desencadena una afluencia de iones de calcio (Ca2+) y la fosforilación de CREB. La fosforilación de CREB regula positivamente la expresión de COX2, lo que conduce a la liberación de prostaglandina E2 (PGE2) de las células epiteliales. La PGE2 actúa sobre las células del estroma activando las vías relacionadas con el AMPc en las células del estroma, lo que conduce a la decidualización.
Partes de decidua
La decidua puede organizarse en secciones separadas, aunque tengan la misma composición.
- Decidua basalis – Esta es la parte de la decidua que se encuentra basalolateral al embrión después de la implantación.
- Decidua capsularis – Decidua capsularis crece sobre el embrión en el lado luminal, encerrándolo en el endometrio. Envuelve el embrión junto con decidua basalis.
- Decidua parietalis – Toda otra decidua en la superficie uterina pertenece a decidua parietalis.
Decidua durante el embarazo
Después de la implantación, la decidua permanece, al menos durante el primer trimestre. Sin embargo, su momento más destacado es durante las primeras etapas del embarazo, durante la implantación. Su función como tejido circundante es reemplazada por la placenta definitiva. Sin embargo, algunos elementos de la decidualización permanecen durante todo el embarazo.
Durante el embarazo, las capas compacta y esponjosa se pueden observar debajo de la decidua. Las glándulas de la capa esponjosa siguen secretando durante el primer trimestre, cuando se degeneran. Sin embargo, antes de esa desaparición, algunas glándulas secretan de forma desigual. Este fenómeno de hipersecreción se denomina fenómeno de Arias-Stella, en honor al patólogo Javier Arias-Stella.
glándulas uterinas

| Proteínas, glucoproteínas y péptidos secretado por las glándulas uterinas |
| Matrix-asociado: |
| Fibronectin |
| Laminin |
| Entactin |
| Colágeno tipo IV |
| Sulfato de helicópteros |
| Proteoglycan |
| Integrinos |
| – |
| Otros: |
| Mucins |
| Prolactin |
| IGFBP-1 |
| Glycodelin |
| Proteína endometrial 15 |
| Albumin |
| Beta-Lipoproteína |
| Relaxin |
| Factor de crecimiento fibroblasto 1 |
| Factor de crecimiento fibroblasto 2 |
| Pappalysin-1 |
| Proteína de respuesta al estrés 27 (SRP-27) |
| CA-125 |
| Beta-endorphin |
| Leu-enkephalin |
| Diamine oxidase |
| Tissue plasminogen activador |
| Renin |
| Anhidrato carbónico dependiente de la progesterona |
| Lactoferrin |
No sólo se transforma el revestimiento del útero, sino que también cambia la secreción de sus glándulas. Este cambio es inducido por el aumento de los niveles de progesterona del cuerpo lúteo. El objetivo de las secreciones es el embrioblasto, y tiene varias funciones sobre él.
Nourishment
El embrión pasa aproximadamente 72 horas en la cavidad uterina antes de implantarse. Durante ese tiempo, no puede recibir nutrición directamente de la sangre de la madre y debe depender de nutrientes secretados en la cavidad uterina, como por ejemplo hierro y vitaminas liposolubles.
Crecimiento e implantación
Además de la nutrición, el endometrio secreta varias proteínas dependientes de esteroides, importantes para el crecimiento y la implantación. También se secretan colesterol y esteroides. La implantación se facilita aún más mediante la síntesis de sustancias de la matriz, moléculas de adhesión y receptores de superficie para las sustancias de la matriz.
Significado clínico
Fallo de implantación
La reproducción en humanos no es muy eficiente. Sólo alrededor del 30% de las concepciones naturales resultan en embarazos exitosos. De los embarazos fallidos, alrededor del 85% se deben a un fallo de implantación. Se considera que el fallo de implantación se debe a una receptividad uterina inadecuada en dos tercios de los casos y a problemas con el embrión en el otro tercio. La mayoría de los procedimientos de FIV fracasan debido a un fallo de implantación, lo que representa casi la mitad de todos los embarazos fallidos.
La receptividad uterina inadecuada puede ser causada por una señalización hormonal y de citocinas anormal, así como por alteraciones epigenéticas. El fracaso recurrente de la implantación es una causa de infertilidad femenina. Por lo tanto, las tasas de embarazo pueden mejorarse optimizando la receptividad endometrial para la implantación. La evaluación de los marcadores de implantación puede ayudar a predecir el resultado del embarazo y detectar deficiencias ocultas de implantación. Como parte del programa de órganos en un chip, se ha desarrollado un endometrio en un chip para modelar el funcionamiento del endometrio que podría identificar más claramente las causas del fracaso de la implantación. También se han desarrollado organoides para modelar el endometrio y su papel en la implantación.
En mujeres con más de tres fallos de implantación en reproducción asistida, una revisión de varios estudios controlados aleatorizados pequeños estimó que el uso de heparina de bajo peso molecular como complemento mejora la tasa de nacidos vivos en aproximadamente un 80%. El apoyo de la fase lútea puede incluir el uso de progesterona y gonadotropina coriónica humana (hCG) para mejorar las probabilidades de una implantación exitosa.
Deficiencia de zinc
El zinc es crucial en la etapa previa a la concepción (y en el éxito del embarazo), y su deficiencia puede provocar un desarrollo deficiente del blastocisto. Una vez que se fertiliza un óvulo, el zinc se libera en una chispa de zinc que promueve cambios que incluyen el endurecimiento de la zona pelúcida, lo que previene la poliespermia.
Hemorragia de implantes
El sangrado y el manchado son comunes durante la fase lútea del ciclo menstrual y las primeras etapas del embarazo, pero no están relacionados con la implantación. El sangrado de implantación ocurre entre 7 y 14 días después de la fertilización y es una pequeña cantidad de sangrado vaginal leve o manchado que puede ocurrir al comienzo del embarazo debido a que el blastocisto penetra el revestimiento del útero durante la implantación. Para el día 13, el sitio de penetración en el endometrio generalmente se ha cerrado con un tapón de fibrina, pero el aumento del flujo sanguíneo hacia los espacios del sinciciotrofoblasto a veces puede causar sangrado en ese sitio. El sangrado de implantación puede estar acompañado de síntomas como calambres, náuseas, sensibilidad en los senos y dolores de cabeza. El sangrado de implantación se puede distinguir del sangrado menstrual por el color, la coagulación, la fuerza y la duración del flujo.
Véase también
- Cannabinoides
- Diapausa embrionaria
- Células Hofbauer
- Capacidad homeostática
- Sobrepoblación humana
- La membrana del Reichert
Referencias
- ^ "Definición de implante". www.merriam-webster.com. Retrieved 26 de abril 2023.
- ^ Niringiyumukiza JD, Cai H, Xiang W (mayo de 2018). "Prostaglandin E2 implicación en la fertilidad femenina mamífera: ovulación, fertilización, desarrollo embrionario e implantación temprana". Biología reproductiva y endocrinología. 16 1): 43. doi:10.1186/s12958-018-0359-5. PMC 5928575. PMID 29716588.
- ^ a b Wilcox AJ, Harmon Q, Doody K, Wolf DP, Adashi EY (abril 2020). "Pérdida de preimplantación de ova humana fertilizada: estimación de lo inservible". Reproducción humana. 35 (4): 743-750. doi:10.1093/humrep/deaa048. PMC 8287936. PMID 32296829.
- ^ a b Yang Y, Zhu QY, Liu JL (noviembre 2021). "Descifrar la receptividad uterina del ratón para el implante embrionario en la resolución de una sola célula". Proliferación de las células. 54 (11): e13128. doi:10.1111/cpr.13128. PMC 8560620. PMID 34558134.
- ^ a b c d e Ezechukwu HC, Diya CA, Shrestha N, Hryciw DH (septiembre 2020). "Role for endocannabinoids in early pregnancy: recent advances and the effects of cannabis use". American Journal of Physiology. Endocrinología y Metabolismo. 319 (3): E557–E561. doi:10.1152/ajpendo.00210.2020. PMID 32744098. S2CID 220943305.
- ^ Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, Finazzi-Agrò A (2000). "Relación entre las concentraciones de anandamida hidrolase reducidas en linfocitos humanos y abortos erróneos". Lancet. 355 (9212): 1326-9. doi:10.1016/S0140-6736(00)02115-2. PMID 10776746. S2CID 39733100.
- ^ Dennedy MC, Friel AM, Houlihan DD, Broderick VM, Smith T, Morrison JJ (enero de 2004). "Cannabinoides y el útero humano durante el embarazo" (PDF). American Journal of Obstetrics and Gynecology. 190 (1): 2–9, discusión 3A. doi:10.1016/j.ajog.2003.07.013. PMID 14749627.
- ^ a b c Imakawa K, Bai R, Fujiwara H, Kusama K (enero de 2016). "Implantación y placentación conceptual: moléculas relacionadas con la transición epitelial-mesenquimal, el homenaje linfocitos, retrovirus endógenos y exosomas". Medicina reproductiva y biología. 15 (1): 1–11. doi:10.1007/s12522-015-0215-7. PMC 5715838. PMID 29259417.
- ^ a b c d e Kim SM, Kim JS (diciembre de 2017). "Una revisión de los mecanismos de implante". Desarrollo " Reproducción. 21 (4): 351–359. doi:10.12717/DR.2017.21.4.351. PMC 5769129. PMID 29359200.
- ^ a b McGowen MR, Erez O, Romero R, Wildman DE (2014). "La evolución de la implantación embrionaria". The International Journal of Developmental Biology. 58 (2–4): 155–161. doi:10.1387/ijdb.140020dw. PMC 6053685. PMID 25023681.
- ^ a b Moore KL (2020). El ser humano en desarrollo: embriología clínica (Elevento ed.). Edimburgo. pp. 35–42. ISBN 978-0-323-61154-1.
{{cite book}}: CS1 maint: localización desaparecido editor (link) - ^ Cakmak H, Taylor HS (marzo de 2011). "Falta de implantación: mecanismos moleculares y tratamiento clínico". Actualización de la reproducción humana. 17 (2): 242–253. doi:10.1093/humupd/dmq037. PMC 3039220. PMID 20729534.
- ^ a b Ochoa-Bernal MA, Fazleabas AT (marzo 2020). "Acontecimientos hipotológicos de la implantación y la decisión de embriones en primates humanos y no humanos". International Journal of Molecular Sciences. 21 (6): 1973. doi:10.3390/ijms21061973. PMC 7139778. PMID 32183093.
- ^ a b Gauster M, Moser G, Wernitznig S, Kupper N, Huppertz B (junio 2022). "Desarrollo trofoblasto humano: de morfología a función". Ciencias de la vida celular y molecular. 79 (6): 345. doi:10.1007/s00018-022-04377-0. PMC 9167809. PMID 35661923.
- ^ Sadler TW (2010). La embriología médica de Langman (11a edición). Philadelphia: Lippincott William & Wilkins. p. 45. ISBN 978-0-7817-9069-7.
- ^ Boron 2004, pág. 1172.
- ^ a b c Seshagiri PB, Vani V, Madhulika P (marzo 2016). "Cytokines y Blastocyst Hatching". American Journal of Reproductive Immunology. 75 (3): 208-17. doi:10.1111/aji.12464. PMID 26706391. S2CID 11540123.
- ^ IVF-infertility.com
- ^ Singh H, Aplin JD (julio de 2009). "Las moléculas de adherencia en el epitelio endometrial: integridad del tejido e implantación del embrión". Journal of Anatomy. 215 (1): 3–13. doi:10.1111/j.1469-7580.2008.01034.x. PMC 2714633. PMID 19453302.
- ^ Gipson IK, Blalock T, Tisdale A, Spurr-Michaud S, Allcorn S, Stavreus-Evers A, et al. (enero de 2008). "MUC16 se pierde de la superficie de uterodome (pinopodo) del endometrio humano receptivo: evidencia in vitro de que MUC16 es una barrera para la adherencia trofoblast". Biología de la Reproducción. 78 (1): 134–142. doi:10.1095/biolreprod.106.058347. PMID 17942799. S2CID 44999196.
- ^ a b Margarit L, Taylor A, Roberts MH, Hopkins L, Davies C, Brenton AG, et al. (diciembre de 2010). "MUC1 como discriminador entre endometrio de pacientes fértiles e infértiles con PCOS y endometriosis". The Journal of Clinical Endocrinology and Metabolism. 95 (12): 5320–5329. doi:10.1210/jc.2010-0603. PMID 20826587.
- ^ Carson DD, Julian J, Lessey BA, Prakobphol A, Fisher SJ (septiembre de 2006). "MUC1 es un andamio para ligandos selectinos en el útero humano". Frontiers in Bioscience. 11 (1): 2903–2908. doi:10.2741/2018. PMID 16720361.
- ^ Francis LW, Yao SN, Powell LC, Griffiths S, Berquand A, Piasecki T, et al. (Febrero 2021). "MuC1 altamente glucosilado media alta afinidad L-selectina en la superficie endometrial humana". Journal of Nanobiotechnology. 19 (1): 50. doi:10.1186/s12951-021-00793-9. PMC 7890821. PMID 33596915.
- ^ Genbacev OD, Prakobphol A, Foulk RA, Krtolica AR, Ilic D, Singer MS, et al. (enero de 2003). "Adhesión mediada por Trophoblast L-selectin en la interfaz maternal-fetal". Ciencia. 299 (5605): 405–408. Bibcode:2003Sci...299..405G. doi:10.1126/science.1079546. PMID 12532021. S2CID 15462671.
- ^ Zhu JY, Pang ZJ, Yu YH (2012). "Regulación de la invasión trofoblast: el papel de la matriz metalloproteinasa". Opiniones en Obstetricia & Ginecología. 5 (3–4): e137–e143. PMC 3594863. PMID 23483768.
- ^ Carter AM, Enders AC, Pijnenborg R (Marzo 2015). "El papel del trofoblast invasivo en la implantación y placentación de primates". Transacciones filosóficas de la Royal Society de Londres. Serie B, Ciencias Biológicas. 370 (1663): 20140070. doi:10.1098/rstb.2014.0070. PMC 4305171. PMID 25602074.
- ^ a b Zare F, Seifati SM, Dehghan-Manshadi M, Fesahat F (mayo 2020). "Preimplantation Factor (PIF): un péptido con diversas funciones". JBRA Assist Reprod. 24 (2): 214–218. doi:10.5935/1518-0557.20190082. PMC 7169918. PMID 32202400.
- ^ Gardiner C, Tannetta DS, Simms CA, Harrison P, Redman CW, Sargent IL (2011). "Microvesicles Syncytiotrophoblast liberados de pre-eclampsia placentae exhiben mayor actividad de factor de tejido". PLOS ONE. 6 (10): e26313. Bibcode:2011PLoSO...626313G. doi:10.1371/journal.pone.0026313. PMC 3194796. PMID 22022598.
- ^ Cindrova-Davies T, Sferruzzi-Perri AN (1 noviembre 2022). "Desarrollo y función placental humano". Seminarios en Celular de Desarrollo Biología. 131: 66–77. doi:10.1016/j.semcdb.2022.03.039. PMID 35393235.
- ^ a b c d e f h i j k l m n o p q r s t Boron W, Boulpaep E (2004). Fisiología médica: un aparejo celular y molecular. Elsevier. ISBN 1-4160-2328-3. OCLC 61527528.
- ^ Moser G, Weiss G, Sundl M, Gauster M, Siwetz M, Lang-Olip I, et al. (Marzo 2017). "Los trofoblastos raros invaden más que las arterias uterinas: evidencia para la invasión de las venas uterinas". Histoquímica y Biología Celular. 147 (3): 353-366. doi:10.1007/s00418-016-1509-5. PMC 5344955. PMID 27774579.
- ^ Dawe GS, Tan XW, Xiao ZC (enero de 2007). "Celar la migración de bebé a madre". Adhesión celular y migración. 1 (1): 19–27. doi:10.4161/cam.4082. PMC 2633676. PMID 19262088.
- ^ a b c Hennes A, Devroe J, De Clercq K, Ciprietti M, Held K, Luyten K, et al. (abril 2023). "Las secreciones de proteínas del blastocisto invasor inducen oscilaciones de calcio en las células epiteliales endometriales a través del receptor 2 activado por proteasa". Reprod Biol Endocrinol. 21 1): 37. doi:10.1186/s12958-023-01085-7. PMC 10105462. PMID 37060079.
- ^ Murphy CR (agosto de 2004). "Receptividad uterina y transformación de la membrana plasmática". Cell Research. 14 (4): 259–267. doi:10.1038/sj.cr.7290227PMID 15353123. S2CID 24023502.
- ^ Murphy CR, Shaw TJ (diciembre de 1994). "La transformación de la membrana del plasma: una respuesta común de las células epiteliales uterinas durante el período de implantación perinatal". Cell Biology International. 18 (12): 1115–1128. doi:10.1006/cbir.1994.1038. PMID 7703952. S2CID 22769575.
- ^ Teh WT, McBain J, Rogers P (noviembre 2016). "¿Cuál es la contribución de la asincronía embrionaria-endometrial al fracaso de implantación?". Journal of Assisted Reproduction and Genetics. 33 11): 1419-1430. doi:10.1007/s10815-016-0773-6. PMC 5125144. PMID 27480540.
- ^ Sternberg AK, Buck VU, Classen-Linke I, Leube RE (agosto 2021). "Cómo las fuerzas mecánicas cambian el endometrio humano durante el ciclo menstrual en preparación para la implantación del embrionario". Celdas. 10 (8): 2008. doi:10.3390/cells10082008. PMC 8391722. PMID 34440776.
- ^ Wu HM, Chen LH, Hsu LT, Lai CH (noviembre 2022). "Immune Tolerance of Embryo Implantation and Pregnancy: The Role of Human Decidual Stromal Cell- and Embryonic-Derived Extracellular Vesicles". Int J Mol Sci. 23 (21): 13382. doi:10.3390/ijms232113382. PMC 9658721. PMID 36362169.
- ^ Liang J, Wang S, Wang Z (noviembre de 2017). "Role of microRNAs in embrión implantation". Reprod Biol Endocrinol. 15 (1): 90. doi:10.1186/s12958-017-0309-7. PMC 5699189. PMID 29162091.
- ^ Maccarrone M, Valensise H, Bari M, Lazzarin N, Romanini C, Finazzi-Agrò A (2000). "Relación entre las concentraciones de anandamida hidrolase reducidas en linfocitos humanos y abortos erróneos". Lancet. 355 (9212): 1326-9. doi:10.1016/S0140-6736(00)02115-2. PMID 10776746. S2CID 39733100.
- ^ a b c d e Quinn KE, Matson BC, Wetendorf M, Caron KM (Febrero 2020). "Pinopodos: avances recientes, perspectivas actuales y direcciones futuras". Endocrinología molecular y celular. 501: 110644. doi:10.1016/j.mce.2019.110644. PMC 6962535. PMID 31738970.
- ^ Xiao Y, Sun X, Yang X, Zhang J, Xue Q, Cai B, et al. (junio de 2010). "El factor inhibidor de la leucemia se disregula en el endometrio y fluido de enrojecimiento uterino de pacientes con adenomyosis durante la ventana de implantación". Fertilidad y Esterilidad. 94 (1): 85–89. doi:10.1016/j.fertnstert.2009.03.012. PMID 19361790.
- ^ Ng SW, Norwitz GA, Pavlicev M, Tilburgs T, Simón C, Norwitz ER (junio 2020). "Decidualización endometrial: el conductor primario de la salud del embarazo". Int J Mol Sci. 21 (11): 4092. doi:10.3390/ijms21114092. PMC 7312091. PMID 32521725.
- ^ Crha I, Ventruba P, Žáková J, Ješeta M, Pilka R, Lousová E, et al. (2019). "Microbioma intraterno y receptividad endometrial". Ceska Gynekologie. 84 (1): 49–54. PMID 31213058.
- ^ Moreno I, Codoñer FM, Vilella F, Valbuena D, Martinez-Blanch JF, Jimenez-Almazán J, et al. (diciembre 2016). "Evidence that the endometrial microbiota has an effect on implantation success or failure". American Journal of Obstetrics and Gynecology. 215 (6): 684–703. doi:10.1016/j.ajog.2016.09.075. PMID 27717732.
- ^ a b c Zhao Y, He D, Zeng H, Luo J, Yang S, Chen J, et al. (septiembre 2021). "Expresión y significado de miR-30d-5p y SOCS1 en pacientes con insuficiencia de implante recurrente durante la ventana de implante". Reprod Biol Endocrinol. 19 (1): 138. doi:10.1186/s12958-021-00820-2. PMC 8425163. PMID 34496883.
- ^ Sharma A, Kumar P (enero de 2012). "Understanding implantation window, a crucial phenomenon". J Hum Reprod Sci. 5 (1): 2-6. doi:10.4103/0974-1208.97777. PMC 3409914. PMID 22870007. (Retracted, see doi:10.4103/0974-1208.165155, PMID 26538866)
- ^ Ruan YC, Guo JH, Liu X, Zhang R, Tsang LL, Dong JD, et al. (Julio de 2012). "Activación del canal epitelial Na+ activa la liberación y producción prostaglandina E2 necesaria para el implante embrionario". Nature Medicine. 18 (7): 1112–1117. doi:10.1038/nm.2771. PMID 22729284. S2CID 5116022.
- ^ a b Wang Y, Jiang X, Jia L, Wu X, Wu H, Wang Y, et al. (2022). "Una Caracterización Única de la Postimplantación Humana Embryos Cultural In Vitro Delinea la Morfogenesis en la Sincitialización Primaria". Frontiers in Cell and Developmental Biology. 10: 835445. doi:10.3389/fcell.2022.835445. PMC 9240912. PMID 35784461.
- ^ Melford SE, Taylor AH, Konje JC (2013). "De ratones y (mujeres): factores que influyen en la implantación exitosa incluyendo endocannabinoides". Actualización de la reproducción humana. 20 (3): 415-428. doi:10.1093/humupd/dmt060. PMID 24306146.
- ^ a b c Cakmak H, Taylor HS (2010). "Falta de implantación: mecanismos moleculares y tratamiento clínico". Actualización de la reproducción humana. 17 (2): 242–253. doi:10.1093/humupd/dmq037. PMC 3039220. PMID 20729534.
- ^ Ahn J, Yoon MJ, Hong SH, Cha H, Lee D, Koo HS, et al. (septiembre 2021). "Endometrio vascularizado tridimensional endometrio-en-a-chip". Reproducción humana. 36 (10): 2720–2731. doi:10.1093/humrep/deab186. 8450871. PMID 34363466.
- ^ Rawlings TM, Makwana K, Tryfonos M, Lucas ES (Julio 2021). "Organoides para modelar el endometrio: implantación y más allá". Reprod Fertil. 2 (3): R85-R101. doi:10.1530/RAF-21-0023. PMC 8801025. PMID 35118399.
- ^ Potdar N, Gelbaya TA, Konje JC, Nardo LG (2013). "Heparina de bajo peso molecular adjunta para mejorar la tasa de natalidad en vivo después de la falla de implantación recurrente: una revisión sistemática y metaanálisis". Actualización de la reproducción humana. 19 (6): 674-684. doi:10.1093/humupd/dmt032. PMID 23912476.
- ^ Farquhar C, Marjoribanks J (agosto 2018). "Tecnología reproductiva consistente: una visión general de las reseñas de Cochrane". La base de datos Cochrane de revisiones sistemáticas. 2018 (8): CD010537. doi:10.1002/14651858.CD010537.pub5. 6953328. PMID 30117155.
- ^ Garner TB, Hester JM, Carothers A, Diaz FJ (Mayo 2021). "Rolla de zinc en reproducción femenina". Biología de la Reproducción. 104 (5): 976–994. doi:10.1093/biolre/ioab023. PMC 8599883. PMID 33598687.
- ^ "Implantation Bleeding vs A Period: How To Tell The Difference". ReUnite Rx. 2020-12-09. Retrieved 2021-07-29.
- ^ a b Sadler TW (2010). La embriología médica de Langman (11a edición). Philadelphia: Lippincott William & Wilkins. pp. 50–51. ISBN 978-0-7817-9069-7.
- ^ Sheiner E (2011). Sangrado durante el embarazo una guía integral. Nueva York: Springer. p. 9. ISBN 978-1-4419-9810-1.
- ^ Harville EW, Wilcox AJ, Baird DD, Weinberg CR (septiembre de 2003). "Sangrado vaginal en un embarazo muy temprano". Reproducción humana. 18 (9): 1944–1947. doi:10.1093/humrep/deg379. PMID 12923154.
- ^ Heger, L. Demosthenes E (ed.). "¿Cómo se sienten los calambres de implantación? Cómo distinguir entre implante y calambre menstrual". Insider. Retrieved 2021-07-29.
- ^ Aggarwal K (2020). "Bleeding vaginal en el embarazo temprano". En Sharma A (ed.). Emergencias de la sala de trabajo. Singapur: Springer. pp. 155–161. doi:10.1007/978-981-10-4953-8_18. ISBN 978-981-10-4953-8. S2CID 212812977.
- ^ "¿Cómo puedo saber si es la mezcla de implantes?". MedicineNet. Retrieved 2021-07-29.
Libros
- Boron W, Boulpaep E (2004). Fisiología médica: un aparejo celular y molecular. Elsevier. ISBN 1-4160-2328-3. OCLC 61527528.
Más lectura
- "Implantación del blastocyst..."
- "Implantación"
Enlaces externos
- embrión humano virtual detallando etapas de desarrollo