Imina
Una imina es un grupo funcional o compuesto orgánico que contiene un doble enlace carbono-nitrógeno. El átomo de nitrógeno puede estar unido a un hidrógeno oa un grupo orgánico (R). El átomo de carbono tiene dos enlaces simples adicionales. Las iminas son comunes en compuestos sintéticos y naturales y participan en muchas reacciones.
Estructura
Para las cetiminas y las aldiminas, respectivamente, los cinco átomos centrales (C 2 C=NX y C(H)C=NX, X = H o C) son coplanares. La planaridad resulta de la hibridación sp de los átomos de carbono y nitrógeno con doble enlace mutuo. La distancia C=N es de 1,29-1,31 Å para las iminas no conjugadas y de 1,35 Å para las iminas conjugadas. Por el contrario, las distancias CN en aminas y nitrilos son 1,47 y 1,16 Å, respectivamente. La rotación sobre el enlace C=N es lenta. Usando espectroscopía de RMN, se han detectado isómeros E y Z de aldiminas. Debido a los efectos estéricos, se favorece el isómero E.
Nomenclatura y clasificación
El término "imine" fue acuñado en 1883 por el químico alemán Albert Ladenburg.
Por lo general, las iminas se refieren a compuestos con la conectividad R 2 C=NR, como se analiza a continuación. En la literatura más antigua, imina se refiere al análogo aza de un epóxido. Así, la etilenimina es la especie de anillo de tres miembros C 2 H 4 NH. La relación de las iminas con las aminas que tienen enlaces dobles y sencillos se transmite a las imidas y amidas, como en acetamida frente a succinimida.
Las iminas están relacionadas con las cetonas y los aldehídos mediante la sustitución del oxígeno por un grupo NR. Cuando R = H, el compuesto es una imina primaria, cuando R es hidrocarbilo, el compuesto es una imina secundaria. Si este grupo no es un átomo de hidrógeno, entonces el compuesto a veces puede denominarse base de Schiff. Cuando R es OH, la imina se llama oxima, y cuando R es NH 2, la imina se llama hidrazona.
Una imina primaria en la que C está unido tanto a un hidrocarbilo como a un H se denomina aldimina primaria; una imina secundaria con tales grupos se denomina aldimina secundaria. Una imina primaria en la que C está unido a dos hidrocarbilos se denomina cetimina primaria; una imina secundaria con tales grupos se denomina cetimina secundaria.
 Aldimina primaria, isómero E
Aldimina primaria, isómero E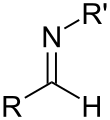 Aldimina secundaria, isómero E
Aldimina secundaria, isómero E cetimina primaria
cetimina primaria cetimina secundaria
cetimina secundaria La aziridina y sus derivados a veces se denominan iminas.
La aziridina y sus derivados a veces se denominan iminas.
Las N-sulfinil iminas son una clase especial de iminas que tienen un grupo sulfinilo unido al átomo de nitrógeno.
Síntesis de iminas
Condensación de carbonilamina
Las iminas normalmente se preparan mediante la condensación de aminas primarias y aldehídos o cetonas. Las cetonas experimentan reacciones similares, pero con menos frecuencia que los aldehídos. En términos de mecanismo, tales reacciones proceden a través de la adición nucleófila dando un intermedio hemiaminal -C(OH)(NHR)-, seguido de una eliminación de agua para producir la imina (ver alquilimino-de-oxo-bisustitución para un mecanismo detallado). El equilibrio en esta reacción suele favorecer al compuesto de carbonilo y la amina, por lo que se requiere la destilación azeotrópica o el uso de un agente deshidratante, como tamices moleculares o sulfato de magnesio, para favorecer la formación de imina. En los últimos años, varios reactivos como el borato de tris(2,2,2-trifluoroetilo) [B(OCH 2 CF 3) 3 ], la pirrolidinao etóxido de titanio [Ti(OEt) 4 ] se ha demostrado que catalizan la formación de iminas.
Más raro que las aminas primarias es el uso de amoníaco para dar una imina primaria. En el caso de la hexafluoroacetona, se puede aislar el intermedio hemiaminal.
De nitrilos
Las cetiminas primarias se pueden sintetizar mediante una reacción de Grignard con un nitrilo. Este método se conoce como síntesis de cetimina Moureu-Mignonac. Por ejemplo, la imina de benzofenona también se puede sintetizar mediante la adición de bromuro de fenilmagnesio al benzonitrilo seguido de una hidrólisis cuidadosa (para que la imina no se hidrolice):C 6 H 5 CN + C 6 H 5 MgBr → (C 6 H 5) 2 C=NMgBr(C 6 H 5) 2 C=NMgBr + H 2 O → (C 6 H 5) 2 C=NH + MgBr(OH)
Métodos especializados
Existen varios otros métodos para la síntesis de iminas.
- Reacción de azidas orgánicas con carbenoides metálicos (producidos a partir de compuestos de diazocarbonilo).
- Condensación de ácidos carbónicos con compuestos nitrosos.
- El reordenamiento de tritil N-haloaminas en el reordenamiento de Stieglitz.
- Por reacción de alquenos con ácido hidrazoico en la reacción de Schmidt.
- Por reacción de un nitrilo, ácido clorhídrico y un areno en la reacción de Hoesch.
- Síntesis multicomponente de 3-tiazolinas en la reacción de Asinger.
- Descomposición térmica de oximas.
Reacciones
Hidrólisis
La principal reacción de las iminas, a menudo indeseable, es su hidrólisis de regreso a la amina y al precursor de carbonilo.R 2 C=NR' + H 2 O ⇌ R 2 C=O + R'NH 2
Precursores de heterociclos
Las iminas se utilizan ampliamente como productos intermedios en la síntesis de heterociclos.
- Las iminas aromáticas reaccionan con un enol éter a una quinolina en la reacción de Povarov.
- Las iminas reaccionan térmicamente con las cetenas en cicloadiciones [2+2] para formar β-lactámicos en la síntesis de Staudinger. Se han descrito varias variantes.
- La reacción de la interacción imina y dienos en la reacción de Imina Diels-Alder para dar tetragidropiridina.
- Las tosiliminas reaccionan con un compuesto carbonilo α, β-insaturado para dar aminas alílicas en la reacción de Aza-Baylis-Hillman.
Reacciones ácido-base
Al igual que las aminas originales, las iminas son levemente básicas y se protonan reversiblemente para dar sales de iminio:R 2 C = NR '+ H [R 2 C = NHR'] <img src="https://wikimedia.org/api/rest_v1/media/math/render/svg/286de75351feddd1cbac5e7ebd53c4e682104d56" alt="{ estilo de visualización { ce {>}}}">
Alternativamente, las iminas primarias son suficientemente ácidas para permitir la N-alquilación, como se ilustra con la benzofenona imina:(C 6 H 5) 2 C=NH + CH 3 Li → (C 6 H 5) 2 C=NLi + CH 4(C 6 H 5) 2 C=NLi + CH 3 I → (C 6 H 5) 2 C=NCH 3 + LiI
Reacciones ácido-base de Lewis
Las iminas son ligandos comunes en la química de coordinación. Se encuentran ejemplos particularmente populares con ligandos de base de Schiff derivados de salicaldehído, los ligandos salen. Las reacciones de iminas catalizadas por metales proceden a través de tales complejos. En los complejos de coordinación clásicos, las iminas se unen a los metales a través del nitrógeno. Para metales de baja valencia, se observan ligandos de η -imina.
Adiciones nucleófilas
Muy análogas a las cetonas y los aldehídos, las iminas primarias son susceptibles al ataque de los equivalentes de carbaniones. El método permite la síntesis de aminas secundarias:R 2 C=NR' + R"Li → R 2 R"CN(Li)R'R2R"CN(Li) R ' + H2O → R2R " CNHR ' + LiOH
Reducciones de imina
Las iminas se reducen mediante aminación reductora. Una imina se puede reducir a una amina mediante hidrogenación, por ejemplo, en una síntesis de m -tolilbencilamina: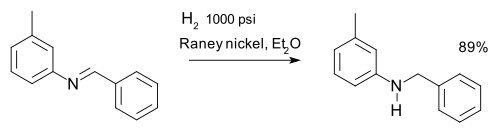
Otros agentes reductores son el hidruro de litio y aluminio y el borohidruro de sodio.
La reducción asimétrica de iminas se ha logrado mediante hidrosililación utilizando un catalizador de rodio-DIOP. Muchos sistemas han sido investigados desde entonces.
Debido a su electrofilia mejorada, los derivados de iminio son particularmente susceptibles de reducción a las aminas. Tales reducciones se pueden lograr por hidrogenación por transferencia o por la acción estequiométrica del cianoborohidruro de sodio. Dado que las iminas derivadas de cetonas asimétricas son proquirales, su reducción define una ruta hacia las aminas quirales.
Polimerización
Las aldiminas sin obstáculos tienden a ciclarse, como lo ilustra la condensación de metilamina y formaldehído, que da la hexahidro-1,3,5-triazina.
Los polímeros de imina (poliiminas) se pueden sintetizar a partir de aldehídos y aminas multivalentes. La reacción de polimerización procede directamente cuando los monómeros de aldehído y amina se mezclan a temperatura ambiente. En la mayoría de los casos, aún se pueden requerir (pequeñas) cantidades de solvente. Las poliiminas son materiales particularmente interesantes por su aplicación como vitrímeros. Debido a la naturaleza covalente dinámica de los enlaces imina, las poliiminas se pueden reciclar con relativa facilidad. Además, las poliiminas son conocidas por su comportamiento de autorreparación.
Reacciones misceláneas
Al igual que los acoplamientos de pinacol, las iminas son susceptibles al acoplamiento reductivo que conduce a 1,2-diaminas. acoplamiento reductivo
Las iminas se oxidan con ácido metacloroperoxibenzoico (mCPBA) para dar oxaziridinas.
Las iminas son productos intermedios en la alquilación de aminas con ácido fórmico en la reacción de Eschweiler-Clarke.
Un reordenamiento en la química de los carbohidratos que involucra una imina es el reordenamiento de Amadori.
Una reacción de transferencia de metileno de una imina por un iluro de sulfonio no estabilizado puede dar lugar a un sistema de aziridina. La reacción de imina y dialquilfosfito en la reacción de Pudovik y la reacción de Kabachnik-Fields
Rol biológico
Las iminas son comunes en la naturaleza. Las enzimas dependientes de fosfato de piridoxal (enzimas PLP) catalizan miríadas de reacciones que involucran aldiminas (o bases de Schiff).

Contenido relacionado
Clorito
Svante Arrhenius
Cerio