Historia evolutiva de las plantas

La evolución de las plantas ha dado lugar a una amplia gama de complejidades, desde los primeros tapices de algas de arqueoplástidos unicelulares que evolucionaron mediante endosimbiosis, pasando por las algas verdes multicelulares marinas y de agua dulce, hasta las briofitas terrestres portadoras de esporas, los licopodios y los helechos, y finalmente hasta las complejas gimnospermas y angiospermas (plantas con flores) portadoras de semillas de la actualidad. Si bien muchos de los primeros grupos siguen prosperando, como lo ejemplifican las algas rojas y verdes en ambientes marinos, los grupos derivados más recientemente han desplazado a los que antes eran ecológicamente dominantes; por ejemplo, el ascenso de las plantas con flores sobre las gimnospermas en ambientes terrestres.
Existe evidencia de que las cianobacterias y los eucariotas taloides multicelulares vivieron en comunidades de agua dulce en la tierra hace mil millones de años, y que comunidades de organismos fotosintetizadores complejos y multicelulares existieron en la tierra a fines del Precámbrico, hace alrededor de 850 millones de años.
Las primeras evidencias de la aparición de plantas terrestres embrionarias aparecen a mediados del Ordovícico (hace unos 470 millones de años) y, a mediados del Devónico (hace unos 390 millones de años), ya estaban presentes muchas de las características que se reconocen en las plantas terrestres actuales, incluidas las raíces y las hojas. A finales del Devónico (hace unos 370 millones de años), algunas plantas con esporas libres, como Archaeopteris, tenían tejido vascular secundario que producía madera y habían formado bosques de árboles altos. También a finales del Devónico, Elkinsia, un helecho con semillas primitivo, había desarrollado semillas. La innovación evolutiva continuó durante el resto del eón Fanerozoico y continúa hasta hoy. La mayoría de los grupos de plantas resultaron relativamente ilesos tras la extinción masiva del Pérmico-Triásico, aunque las estructuras de las comunidades cambiaron. Esto puede haber preparado el escenario para la aparición de las plantas con flores en el Triásico (hace unos 200 millones de años), y su posterior diversificación en el Cretácico y el Paleógeno. El último grupo importante de plantas en evolucionar fueron las gramíneas, que cobraron importancia a mediados del Paleógeno, hace unos 40 millones de años. Las gramíneas, así como muchos otros grupos, desarrollaron nuevos mecanismos metabólicos para sobrevivir a las bajas concentraciones de CO2 y a las condiciones cálidas y secas de los trópicos durante los últimos 10 millones de años.
Colonization of land
Divergence
Las plantas terrestres evolucionaron a partir de un grupo de algas verdes de agua dulce, tal vez hace 850 millones de años, pero las plantas similares a las algas podrían haber evolucionado hace mil millones de años. Los parientes vivos más cercanos de las plantas terrestres son las carófitas, específicamente las Charales; si las Charales modernas son similares a los ancestros lejanos que comparten con las plantas terrestres, esto significa que las plantas terrestres evolucionaron a partir de un alga filamentosa ramificada que habitaba en agua dulce poco profunda, tal vez al borde de charcas que se desecaban estacionalmente. Sin embargo, algunas evidencias recientes sugieren que las plantas terrestres podrían haberse originado a partir de carófitas terrestres unicelulares similares a las Klebsormidiophyceae actuales. El alga habría tenido un ciclo de vida haplóntico. Solo habría tenido cromosomas apareados muy brevemente (la condición diploide) cuando el óvulo y el espermatozoide se fusionaron por primera vez para formar un cigoto que se habría dividido inmediatamente por meiosis para producir células con la mitad del número de cromosomas no apareados (la condición haploide). Las interacciones cooperativas con hongos pueden haber ayudado a las primeras plantas a adaptarse a las tensiones del mundo terrestre.

Retos para la colonización de tierras
Las plantas no fueron los primeros organismos fotosintéticos en la tierra. Las tasas de erosión sugieren que los organismos capaces de realizar la fotosíntesis ya vivían en la tierra hace 1.200 millones de años, y se han encontrado fósiles microbianos en depósitos de lagos de agua dulce de hace 1.000 millones de años, pero el registro de isótopos de carbono sugiere que eran demasiado escasos como para afectar la composición atmosférica hasta hace unos 850 millones de años. Estos organismos, aunque filogenéticamente diversos, probablemente eran pequeños y simples, y formaban poco más que una espuma de algas.
Dado que los líquenes inician el primer paso en la sucesión ecológica primaria en los contextos contemporáneos, una hipótesis ha sido que los líquenes llegaron primero a la tierra y facilitaron la colonización por parte de las plantas; sin embargo, tanto las filogenias moleculares como el registro fósil parecen contradecir esto.
Existen múltiples razones posibles por las que las plantas terrestres tardaron tanto en aparecer. Podría ser que el "envenenamiento" atmosférico impidiera que los eucariotas colonizaran la tierra antes de la aparición de las plantas terrestres, o simplemente podría haber tardado mucho tiempo en desarrollarse la complejidad necesaria. Un desafío importante para la adaptación a la tierra habría sido la ausencia de un suelo apropiado. A lo largo del registro fósil, el suelo se conserva, lo que proporciona información sobre cómo eran los suelos primitivos. Antes de las plantas terrestres, el suelo de la tierra era pobre en recursos esenciales para la vida, como el nitrógeno y el fósforo, y tenía poca capacidad para retener agua.
Adaptaciones a la colonización terrestre
Hay evidencias de la existencia de las primeras plantas terrestres hace unos 470 millones de años, en rocas del Ordovícico medio inferior de Arabia Saudita y Gondwana, en forma de esporas conocidas como criptosporas. Estas esporas tienen paredes hechas de esporopolenina, un material extremadamente resistente a la descomposición, lo que significa que están bien conservadas según el registro fósil. Estas esporas se produjeron de forma individual (mónadas), en pares (díadas) o en grupos de cuatro (tétradas), y su microestructura se asemeja a la de las esporas de la hepática moderna, lo que sugiere que comparten un grado de organización equivalente. Sus paredes contienen esporopolenina, otra prueba de una afinidad embriofítica.
Poco después, en rocas del Ordovícico Superior, hace unos 455 millones de años, aparecen esporas triletes similares a las de las plantas vasculares. Dependiendo del momento exacto en que se divida la tétrada, cada una de las cuatro esporas puede presentar una "marca trilete", una forma de Y, que refleja los puntos en los que cada célula se aplastó contra sus vecinas. Sin embargo, esto requiere que las paredes de las esporas sean fuertes y resistentes en una etapa temprana. Esta resistencia está estrechamente relacionada con tener una pared exterior resistente a la desecación, un rasgo que solo es útil cuando las esporas deben sobrevivir fuera del agua. De hecho, incluso aquellas embriofitas que han regresado al agua carecen de una pared resistente, por lo que no presentan marcas triletes. Un examen minucioso de las esporas de algas muestra que ninguna tiene esporas triletes, ya sea porque sus paredes no son lo suficientemente resistentes o, en los raros casos en que lo son, porque las esporas se dispersan antes de que se las comprima lo suficiente para desarrollar la marca o no encajan en una tétrada tetraédrica.
Los primeros megafósiles de plantas terrestres eran organismos taloides que habitaban en humedales fluviales y que, según se ha descubierto, cubrían la mayor parte de una llanura de inundación del Silúrico temprano. Solo podían sobrevivir cuando la tierra estaba anegada. También había esteras microbianas.
Una vez que las plantas llegaron a la tierra, había dos enfoques para lidiar con la desecación. Las briofitas modernas la evitaban o cedían a ella, restringiendo sus áreas de distribución a ambientes húmedos o secándose y poniendo su metabolismo "en pausa" hasta que llegase más agua, como en el género de hepáticas Targionia. Las traqueofitas resisten la desecación controlando la tasa de pérdida de agua. Todas tienen una capa de cutícula externa impermeable dondequiera que estén expuestas al aire (como algunas briofitas), para reducir la pérdida de agua, pero como una cubierta total las aislaría del CO2 en la atmósfera, las traqueofitas usan aberturas variables, los estomas, para regular la tasa de intercambio de gases. Las traqueofitas también desarrollaron tejido vascular para ayudar al movimiento del agua dentro de los organismos (ver más abajo) y se alejaron de un ciclo de vida dominado por gametofitos (ver más abajo). El tejido vascular finalmente también facilitó el crecimiento vertical sin el apoyo del agua y allanó el camino para la evolución de plantas más grandes en la tierra.
Consecuencias
Se cree que un evento de glaciación global llamado Tierra Bola de Nieve, de alrededor de 720-635 millones de años en el período Criogénico, fue causado al menos parcialmente por los primeros organismos fotosintéticos, que redujeron la concentración de dióxido de carbono y disminuyeron el efecto invernadero en la atmósfera, lo que llevó a un clima de invernadero. Basándose en estudios de relojes moleculares de la década anterior aproximadamente, un estudio de 2022 observó que el momento estimado para el origen de los estreptofitos multicelulares (todos excepto el clado basal unicelular Mesostigmatophyceae) cayó en el Criogénico frío, mientras que el de la posterior separación de los estreptofitos cayó en el Ediacárico cálido, lo que interpretaron como una indicación de la presión selectiva del período glacial sobre los organismos fotosintetizadores, un grupo de los cuales logró sobrevivir en entornos relativamente más cálidos que permanecieron habitables, y posteriormente floreció en la tierra en el Ediacárico tardío y el Fanerozoico como embriofitos. El estudio también planteó la teoría de que la morfología unicelular y otras características únicas de las Zygnematophyceae pueden reflejar adaptaciones posteriores a un estilo de vida amante del frío. El establecimiento de una flora terrestre aumentó la tasa de acumulación de oxígeno en la atmósfera, ya que las plantas terrestres producían oxígeno como producto de desecho. Cuando esta concentración superó el 13%, hace unos 450 millones de años, se hicieron posibles los incendios forestales, como lo demuestra el carbón en el registro fósil. Aparte de un controvertido vacío en el Devónico tardío, el carbón ha estado presente desde entonces.
La carbonización es un modo tafonómico importante. Los incendios forestales o el enterramiento en cenizas volcánicas calientes eliminan los compuestos volátiles, dejando solo un residuo de carbono puro. Esta no es una fuente de alimento viable para hongos, herbívoros o detritívoros, por lo que es propensa a la conservación. También es robusta y puede soportar la presión, mostrando detalles exquisitos, a veces subcelulares, en los restos.
Además de la aparición del carbón en el registro de rocas, la terrestralización de las plantas ha contribuido significativamente a los cambios en la geología y los paisajes. El Ordovícico y el Silúrico muestran una proporción 1,4 veces mayor de lodo rocoso en el registro geológico que el 90% anterior de la historia de la Tierra y se considera que este aumento de lodo rocoso es el resultado de que las plantas terrestres retienen lodo en un entorno terrestre.
Evolución de los ciclos de vida

Todas las plantas multicelulares tienen un ciclo de vida que comprende dos generaciones o fases. La fase gametofítica tiene un único conjunto de cromosomas (denominado 1n) y produce gametos (espermatozoides y óvulos). La fase esporofita tiene cromosomas apareados (denominado 2n) y produce esporas. Las fases gametofítica y esporofita pueden ser homomórficas, pareciendo idénticas en algunas algas, como la Ulva lactuca, pero son muy diferentes en todas las plantas terrestres modernas, una condición conocida como heteromorfia.
El patrón de evolución de las plantas ha sido un cambio de homomorfía a heteromorfía. Los ancestros algales de las plantas terrestres eran casi con certeza haplobiónicos, es decir, haploides durante todos sus ciclos de vida, con un cigoto unicelular que proporciona la etapa 2N. Todas las plantas terrestres (es decir, embriofitas) son diplobiónicas, es decir, tanto la etapa haploide como la diploide son multicelulares. Se observan dos tendencias: las briofitas (hepáticas, musgos y antocerotes) han desarrollado el gametofito como la fase dominante del ciclo de vida, y el esporofito se ha vuelto casi completamente dependiente de él; las plantas vasculares han desarrollado el esporofito como la fase dominante, y los gametofitos se han reducido particularmente en las plantas con semillas.
Se ha propuesto como base para la aparición de la fase diploide del ciclo de vida como la fase dominante que la diploidía permite enmascarar la expresión de mutaciones deletéreas a través de la complementación genética. Así, si uno de los genomas parentales en las células diploides contiene mutaciones que conducen a defectos en uno o más productos genéticos, estas deficiencias podrían ser compensadas por el otro genoma parental (que, no obstante, puede tener sus propios defectos en otros genes). A medida que la fase diploide se volvía predominante, el efecto de enmascaramiento probablemente permitió que el tamaño del genoma, y por lo tanto el contenido de información, aumentara sin la restricción de tener que mejorar la precisión de la replicación. La oportunidad de aumentar el contenido de información a bajo costo es ventajosa porque permite codificar nuevas adaptaciones. Esta visión ha sido cuestionada, con evidencia que muestra que la selección no es más efectiva en las fases haploide que en las diploides del ciclo de vida de los musgos y las angiospermas.
Existen dos teorías que compiten para explicar la aparición de un ciclo de vida diplobiónico.
La teoría de la interpolación (también conocida como teoría antitética o intercalar) sostiene que la interpolación de una fase de esporofito multicelular entre dos generaciones sucesivas de gametofitos fue una innovación causada por una meiosis anterior en un cigoto recién germinado con una o más rondas de división mitótica, produciendo así algún tejido multicelular diploide antes de que finalmente la meiosis produjera esporas. Esta teoría implica que los primeros esporofitos tenían una morfología muy diferente y más simple que el gametofito del que dependían. Esto parece encajar bien con lo que se sabe de los briofitos, en los que un gametofito taloide vegetativo nutre a un esporofito simple, que consiste en poco más que un esporangio no ramificado sobre un tallo. La creciente complejidad del esporofito, ancestralmente simple, incluida la eventual adquisición de células fotosintéticas, lo liberaría de su dependencia de un gametofito, como se observa en algunas plantas antoceros (Anthoceros), y eventualmente resultaría en el desarrollo de órganos y tejido vascular del esporofito, y se convertiría en la fase dominante, como en las traqueofitas (plantas vasculares). Esta teoría puede ser apoyada por observaciones de que los individuos más pequeños de Cooksonia deben haber sido sostenidos por una generación de gametofito. La aparición observada de tamaños axiales más grandes, con espacio para tejido fotosintético y, por lo tanto, autosostenibilidad, proporciona una posible ruta para el desarrollo de una fase de esporofito autosuficiente.
La hipótesis alternativa, llamada teoría de la transformación (o teoría homóloga), postula que el esporofito podría haber aparecido repentinamente al retrasar la aparición de la meiosis hasta que se hubiera formado un esporofito multicelular completamente desarrollado. Dado que el mismo material genético sería empleado tanto por la fase haploide como por la diploide, tendrían el mismo aspecto. Esto explica el comportamiento de algunas algas, como la Ulva lactuca, que producen fases alternas de esporofitos y gametofitos idénticos. La adaptación posterior al entorno terrestre desecante, que dificulta la reproducción sexual, podría haber dado lugar a la simplificación del gametofito sexualmente activo y a la elaboración de la fase de esporofito para dispersar mejor las esporas impermeables. El tejido de los esporofitos y gametofitos de plantas vasculares como la Rhynia conservado en el sílex de Rhynie es de una complejidad similar, lo que se considera que apoya esta hipótesis. Por el contrario, las plantas vasculares modernas, con excepción de Psilotum, tienen esporofitos y gametofitos heteromórficos en los que los gametofitos rara vez tienen tejido vascular.
Evolución de la anatomía vegetal
Simbiosis micorrorizal abuscular
No hay evidencia de que las primeras plantas terrestres del Silúrico y del Devónico temprano tuvieran raíces, aunque hay evidencia fósil de rizoides en varias especies, como Horneophyton. Las primeras plantas terrestres tampoco tenían sistemas vasculares para el transporte de agua y nutrientes. Aglaophyton, una planta vascular sin raíces conocida a partir de fósiles del Devónico en el sílex de Rhynie, fue la primera planta terrestre de la que se descubrió que tenía una relación simbiótica con hongos que formaban micorrizas arbusculares, literalmente "raíces fúngicas parecidas a árboles", en un cilindro bien definido de células (anillo en sección transversal) en la corteza de sus tallos. Los hongos se alimentaban de los azúcares de la planta, a cambio de nutrientes generados o extraídos del suelo (especialmente fosfato), a los que la planta de otra manera no habría tenido acceso. Al igual que otras plantas terrestres sin raíces del Silúrico y principios del Devónico, el Aglaophyton puede haber dependido de hongos micorrízicos arbusculares para la adquisición de agua y nutrientes del suelo.
Los hongos pertenecían al filo Glomeromycota, un grupo que probablemente apareció por primera vez hace mil millones de años y que todavía hoy forma asociaciones micorrízicas arbusculares con todos los grupos principales de plantas terrestres, desde briofitas hasta pteridofitas, gimnospermas y angiospermas, y con más del 80% de las plantas vasculares.
La evidencia del análisis de secuencias de ADN indica que el mutualismo micorrízico arbuscular surgió en el ancestro común de estos grupos de plantas terrestres durante su transición a la tierra y puede incluso haber sido el paso crítico que les permitió colonizar la tierra. Al aparecer como lo hicieron antes de que estas plantas desarrollaran raíces, los hongos micorrízicos habrían ayudado a las plantas en la adquisición de agua y nutrientes minerales como el fósforo, a cambio de compuestos orgánicos que no podían sintetizar por sí mismos. Estos hongos aumentan la productividad incluso de plantas simples como las hepáticas.
Cuticle, stomata y espacios intercelulares
Para realizar la fotosíntesis, las plantas deben absorber CO2 de la atmósfera. Sin embargo, si se deja que el CO2 entre en los tejidos, el agua se evapora, lo que tiene un precio. El agua se pierde mucho más rápido de lo que se absorbe el CO2, por lo que las plantas necesitan reemplazarlo. Las primeras plantas terrestres transportaban el agua de forma apoplástica, dentro de las paredes porosas de sus células. Más tarde, desarrollaron tres características anatómicas que les permitieron controlar la inevitable pérdida de agua que acompañaba a la adquisición de CO2. En primer lugar, se desarrolló una cubierta exterior impermeable o cutícula que reducía la pérdida de agua. En segundo lugar, las aberturas variables, los estomas que podían abrirse y cerrarse para regular la cantidad de agua perdida por evaporación durante la absorción de CO2 y, en tercer lugar, el espacio intercelular entre las células del parénquima fotosintético que permitía una mejor distribución interna del CO2 a los cloroplastos. Este sistema de tres partes proporcionó una mejor homoiohidra, la regulación del contenido de agua de los tejidos, lo que proporciona una ventaja particular cuando el suministro de agua no es constante. Las altas concentraciones de CO2 del Silúrico y principios del Devónico, cuando las plantas colonizaron la tierra por primera vez, significaron que utilizaban el agua de manera relativamente eficiente. A medida que las plantas absorbían CO2 de la atmósfera, se perdía más agua en su captura y se desarrollaron mecanismos de adquisición y transporte de agua más sofisticados. Las plantas que crecían hacia arriba en el aire necesitaban un sistema para transportar agua desde el suelo a todas las partes de la planta que se encontraban sobre el suelo, especialmente a las partes que realizaban la fotosíntesis. A finales del Carbonífero, cuando las concentraciones de CO2 se habían reducido a algo parecido a lo que son hoy, se perdía alrededor de 17 veces más agua por unidad de absorción de CO2. Sin embargo, incluso en los primeros tiempos "fáciles", el agua siempre era un bien escaso y tenía que transportarse a partes de la planta desde el suelo húmedo para evitar la desecación.
El agua puede desplazarse por capilaridad a lo largo de un tejido con pequeños espacios. En columnas de agua estrechas, como las que se encuentran dentro de las paredes celulares de las plantas o en las traqueidas, cuando las moléculas se evaporan desde un extremo, arrastran a las moléculas que se encuentran detrás de ellas a lo largo de los canales. Por lo tanto, la evaporación por sí sola proporciona la fuerza impulsora para el transporte de agua en las plantas. Sin embargo, sin vasos de transporte especializados, este mecanismo de cohesión-tensión puede causar presiones negativas suficientes para colapsar las células conductoras de agua, limitando el agua de transporte a no más de unos pocos centímetros y, por lo tanto, limitando el tamaño de las primeras plantas.

Xylem
Para liberarse de las limitaciones de tamaño pequeño y humedad constante que el sistema de transporte parenquimático infligía, las plantas necesitaban un sistema de transporte de agua más eficiente. A medida que las plantas crecían hacia arriba, evolucionaron tejidos vasculares especializados en el transporte de agua, primero en forma de hidroides simples del tipo que se encuentra en las setas de los esporofitos del musgo. Estas células simples y alargadas estaban muertas y llenas de agua en la madurez, proporcionando un canal para el transporte de agua, pero sus paredes delgadas y no reforzadas colapsarían bajo una tensión hídrica moderada, limitando la altura de la planta. Las traqueidas del xilema, células más anchas con paredes celulares reforzadas con lignina que eran más resistentes al colapso bajo la tensión causada por el estrés hídrico, aparecen en más de un grupo de plantas a mediados del Silúrico, y pueden tener un único origen evolutivo, posiblemente dentro de las antocerotis, uniendo a todas las traqueofitas. Alternativamente, pueden haber evolucionado más de una vez. Mucho más tarde, en el Cretácico, las traqueidas fueron seguidas por vasos en las plantas con flores. A medida que evolucionaron los mecanismos de transporte de agua y las cutículas impermeables, las plantas pudieron sobrevivir sin estar continuamente cubiertas por una película de agua. Esta transición de la poiquilohidria a la homoiohidria abrió un nuevo potencial para la colonización.
Los primeros traqueófitos del Devónico temprano, Aglaophyton y Horneophyton, tienen tubos de transporte de agua no reforzados con estructuras de pared muy similares a los hidroides de los musgos, pero crecieron junto a varias especies de traqueófitos, como Rhynia gwynne-vaughanii, que tenían traqueidas de xilema bien reforzadas por bandas de lignina. Los primeros macrofósiles conocidos que tenían traqueidas de xilema son pequeñas plantas del Silúrico medio del género Cooksonia. Sin embargo, las bandas engrosadas en las paredes de fragmentos de tubos aislados son evidentes desde el Silúrico temprano en adelante.
Las plantas continuaron innovando en formas de reducir la resistencia al flujo dentro de sus células, aumentando progresivamente la eficiencia de su transporte de agua y aumentando la resistencia de las traqueidas a colapsar bajo tensión. Durante el Devónico temprano, el diámetro máximo de las traqueidas aumentó con el tiempo, pero puede haberse estabilizado en las zosterofilas a mediados del Devónico. La tasa de transporte general también depende del área transversal general del haz de xilema en sí, y algunas plantas del Devónico medio, como las trimerófitas, tenían estelas mucho más grandes que sus antecesores primitivos. Si bien las traqueidas más anchas proporcionaban tasas más altas de transporte de agua, aumentaban el riesgo de cavitación, la formación de burbujas de aire resultantes de la rotura de la columna de agua bajo tensión. Los pequeños hoyos en las paredes de las traqueidas permiten que el agua pase por alto una traqueida defectuosa al tiempo que evitan que las burbujas de aire pasen a través de ellas, pero a costa de tasas de flujo restringidas. En el Carbonífero, las gimnospermas habían desarrollado fosas bordeadas, estructuras similares a válvulas que permiten que las fosas de alta conductividad se sellen cuando se despresuriza un lado de una traqueida.
Las traqueidas tienen paredes terminales no perforadas con hoyos, que imponen una gran resistencia al flujo de agua, pero pueden haber tenido la ventaja de aislar las embolias aéreas causadas por cavitación o congelación. Los vasos evolucionaron por primera vez durante los períodos secos y bajos en CO2 del Pérmico tardío, en las colas de caballo, los helechos y las selaginellales de forma independiente, y luego aparecieron a mediados del Cretácico en las gnetofitas y las angiospermas. Los miembros de los vasos son tubos abiertos sin paredes terminales y están dispuestos de extremo a extremo para funcionar como si fueran un vaso continuo. Los vasos permitieron que la misma área de sección transversal de madera transportara mucha más agua que las traqueidas. Esto permitió que las plantas llenaran más de sus tallos con fibras estructurales y también abrió un nuevo nicho para las vides, que podían transportar agua sin ser tan gruesas como el árbol en el que crecían. A pesar de estas ventajas, la madera a base de traqueidas es mucho más ligera, por lo que es más barata de fabricar, ya que los vasos necesitan ser mucho más reforzados para evitar la cavitación. Una vez que las plantas desarrollaron este nivel de control sobre la evaporación y el transporte de agua, fueron verdaderamente homoiohídricas, capaces de extraer agua de su entorno a través de órganos similares a raíces en lugar de depender de una película de humedad superficial, lo que les permitió crecer hasta alcanzar un tamaño mucho mayor, pero como resultado de su mayor independencia de su entorno, la mayoría de las plantas vasculares perdieron su capacidad de sobrevivir a la desecación, un rasgo que fue costoso perder. En las primeras plantas terrestres, el soporte lo proporcionaba principalmente la presión de turgencia, en particular de la capa externa de células conocida como traqueidas esteromas, y no el xilema, que era demasiado pequeño, demasiado débil y estaba en una posición demasiado central para proporcionar mucho soporte estructural. Las plantas con xilema secundario que habían aparecido a mediados del Devónico, como las trimerófitas y las progimnospermas, tenían secciones transversales vasculares mucho más grandes que producían tejido leñoso fuerte.
Endodermis
Es posible que en las primeras raíces de las plantas se haya desarrollado una endodermis durante el Devónico, pero la primera evidencia fósil de dicha estructura se remonta al Carbonífero. La endodermis de las raíces rodea el tejido de transporte de agua y regula el intercambio de iones entre el agua subterránea y los tejidos, y evita que patógenos no deseados, etc., entren en el sistema de transporte de agua. La endodermis también puede ejercer una presión ascendente, expulsando el agua de las raíces cuando la transpiración no es suficiente.
Evolución de la morfología vegetal
Hojas


Las hojas son los órganos fotosintéticos primarios de una planta moderna. El origen de las hojas fue casi seguro provocado por la disminución de las concentraciones de CO2 atmosférico durante el período Devónico, lo que aumentó la eficiencia con la que se podía capturar el dióxido de carbono para la fotosíntesis.
Las hojas evolucionaron más de una vez. Según su estructura, se clasifican en dos tipos: micrófilas, que carecen de venación compleja y pueden haberse originado como excrecencias espinosas conocidas como enaciones, y megafilas, que son grandes y tienen venación compleja que pueden haber surgido de la modificación de grupos de ramas. Se ha propuesto que estas estructuras surgieron de forma independiente. Las megafilas, según la teoría de los telomas de Walter Zimmerman, han evolucionado a partir de plantas que mostraban una arquitectura de ramificación tridimensional, a través de tres transformaciones: sobreposición, que condujo a la posición lateral típica de las hojas, planación, que implicó la formación de una arquitectura plana, membrana o fusión, que unió las ramas planas, lo que llevó a la formación de una lámina foliar adecuada. Los tres pasos sucedieron varias veces en la evolución de las hojas actuales.
Se cree ampliamente que la teoría de los telomas está bien respaldada por evidencia fósil. Sin embargo, Wolfgang Hagemann la cuestionó por razones morfológicas y ecológicas y propuso una teoría alternativa. Mientras que según la teoría de los telomas las plantas terrestres más primitivas tienen un sistema de ramificación tridimensional de ejes radialmente simétricos (telomas), según la alternativa de Hagemann se propone lo contrario: las plantas terrestres más primitivas que dieron origen a las plantas vasculares eran planas, taloides, con forma de hoja, sin ejes, algo así como un prótalo de hepática o helecho. Los ejes como tallos y raíces evolucionaron más tarde como nuevos órganos. Rolf Sattler propuso una visión global orientada al proceso que deja un espacio limitado tanto para la teoría de los telomas como para la alternativa de Hagemann y, además, tiene en cuenta todo el continuo entre las estructuras dorsoventrales (planas) y radiales (cilíndricas) que se pueden encontrar en plantas terrestres fósiles y vivas. Esta visión está respaldada por la investigación en genética molecular. Así, James (2009) concluyó que "hoy en día se acepta ampliamente que... la radialidad [característica de los ejes, como los tallos] y la dorsoventralidad [característica de las hojas] no son más que extremos de un espectro continuo. De hecho, se trata simplemente del momento de la expresión del gen KNOX".
Antes de la evolución de las hojas, las plantas tenían el aparato fotosintético en los tallos, que conservan aunque las hojas han asumido en gran medida esa función. Las hojas megafílicas actuales probablemente se volvieron comunes hace unos 360 millones de años, unos 40 millones de años después de que las plantas simples sin hojas colonizaran la tierra en el Devónico temprano. Esta expansión se ha relacionado con la caída de las concentraciones atmosféricas de dióxido de carbono en la era Paleozoica tardía asociada con un aumento en la densidad de estomas en la superficie de las hojas. Esto habría resultado en mayores tasas de transpiración e intercambio de gases, pero especialmente con altas concentraciones de CO2, las hojas grandes con menos estomas se habrían calentado a temperaturas letales a plena luz del sol. El aumento de la densidad estomática permitió una hoja mejor refrigerada, lo que hizo posible su expansión, pero aumentó la absorción de CO2 a expensas de una menor eficiencia en el uso del agua.
Las riniófitas del sílex de Rhynie consistían únicamente en ejes delgados y sin ornamentación. Las trimerófitas del Devónico temprano a medio pueden considerarse frondosas. Este grupo de plantas vasculares se reconoce por sus masas de esporangios terminales, que adornan los extremos de los ejes que pueden bifurcarse o trifurcarse. Algunos organismos, como Psilophyton, tenían enaciones. Se trata de pequeñas excrecencias espinosas del tallo, que carecen de su propio suministro vascular.
Las zosterofilas ya eran importantes a finales del Silúrico, mucho antes que cualquier riniófito de complejidad comparable. Este grupo, reconocible por sus esporangios en forma de riñón que crecían en ramas laterales cortas cerca de los ejes principales, a veces se ramificaban en una distintiva forma de H. Muchas zosterofilas tenían enaciones (pequeñas excrecencias de tejido en la superficie con morfologías variables) en sus ejes, pero ninguna de ellas tenía un rastro vascular. La primera evidencia de enaciones vascularizadas se encuentra en un licopodio fósil conocido como Baragwanathia que ya había aparecido en el registro fósil a finales del Silúrico. En este organismo, estos rastros foliares continúan en la hoja para formar su nervio central. Una teoría, la "teoría de la enación", sostiene que las hojas micrófilas de los licopodios se desarrollaron por excrecencias de la protóstela que se conectaban con enaciones existentes. Las hojas del género Rhynie Asteroxylon, que se conservó en el sílex de Rhynie casi 20 millones de años después que Baragwanathia, tenían un suministro vascular primitivo, en forma de rastros de hojas que partían de la protóstela central hacia cada "hoja" individual. Asteroxylon y Baragwanathia son ampliamente considerados como licopodios primitivos, un grupo aún existente en la actualidad, representado por las quillworts, los spikemosses y los licopodios. Los licopodios tienen micrófilas distintivas, definidas como hojas con un solo rastro vascular. Los micrófilos pueden alcanzar cierto tamaño, los de Lepidodendrales alcanzan más de un metro de longitud, pero casi todos tienen un solo haz vascular. Una excepción es la rara ramificación en algunas especies de Selaginella.
Se cree que las hojas más conocidas, las megafilas, se originaron cuatro veces de forma independiente: en los helechos, las colas de caballo, las progimnospermas y las plantas con semillas. Parece que se originaron modificando ramas dicotómicas, que primero se superpusieron (o "sobrepasaron") unas a otras, se aplanaron o se plantaron y finalmente desarrollaron una "membrana" y evolucionaron gradualmente hacia estructuras más parecidas a las hojas. Las megafilas, según la teoría de los telomas de Zimmerman, están compuestas por un grupo de ramas membranosas y, por lo tanto, el "hueco foliar" que queda donde el haz vascular de la hoja deja el de la rama principal se asemeja a dos ejes que se dividen. En cada uno de los cuatro grupos que desarrollaron megafilas, sus hojas evolucionaron por primera vez durante el Devónico tardío hasta el Carbonífero temprano, diversificándose rápidamente hasta que los diseños se establecieron a mediados del Carbonífero.
El cese de una mayor diversificación puede atribuirse a limitaciones del desarrollo, lo que plantea la pregunta de por qué las hojas tardaron tanto en evolucionar en primer lugar. Las plantas habían estado en la tierra durante al menos 50 millones de años antes de que los megafilos se volvieran significativos. Sin embargo, se conocen mesófilos pequeños y raros del género Eophyllophyton del Devónico temprano, por lo que el desarrollo no pudo haber sido una barrera para su aparición. La mejor explicación hasta ahora es que el CO2 atmosférico estaba disminuyendo rápidamente durante este tiempo, cayendo alrededor del 90% durante el Devónico. Esto requirió un aumento de la densidad estomática de 100 veces para mantener la tasa de fotosíntesis. Cuando los estomas se abren para permitir que el agua se evapore de las hojas, tiene un efecto de enfriamiento, resultante de la pérdida del calor latente de la evaporación. Parece que la baja densidad estomática en el Devónico temprano significó que la evaporación y el enfriamiento por evaporación eran limitados, y que las hojas se habrían sobrecalentado si crecían hasta cualquier tamaño. La densidad estomática no podía aumentar, ya que las estelas primitivas y los sistemas radiculares limitados no podrían suministrar agua con la suficiente rapidez para igualar la tasa de transpiración. Claramente, las hojas no siempre son beneficiosas, como lo ilustra la frecuente ocurrencia de pérdida secundaria de hojas, ejemplificada por los cactus y el helecho de hoja ancha Psilotum.
La evolución secundaria puede ocultar el verdadero origen evolutivo de algunas hojas. Algunos géneros de helechos presentan hojas complejas que están unidas a la pseudoestela por una prolongación del haz vascular, sin dejar ningún espacio entre las hojas.
Los árboles de hoja caduca tienen otra desventaja de tener hojas. La creencia popular de que las plantas pierden sus hojas cuando los días se hacen demasiado cortos es errónea; los árboles de hoja perenne prosperaron en el Círculo Polar Ártico durante la última época de invernadero. La razón generalmente aceptada para perder hojas durante el invierno es hacer frente al clima: la fuerza del viento y el peso de la nieve se soportan mucho mejor sin hojas para aumentar la superficie. La pérdida estacional de hojas ha evolucionado de forma independiente varias veces y se manifiesta en las ginkgo, algunas pinofitas y ciertas angiospermas. La pérdida de hojas también puede haber surgido como respuesta a la presión de los insectos; puede haber sido menos costoso perder hojas por completo durante el invierno o la estación seca que seguir invirtiendo recursos en su reparación.
Roots
La evolución de las raíces tuvo consecuencias a escala global. Al perturbar el suelo y promover su acidificación (al absorber nutrientes como el nitrato y el fosfato), permitieron que se erosionara más profundamente, inyectando compuestos de carbono a mayor profundidad en los suelos, con enormes implicaciones para el clima. Estos efectos pueden haber sido tan profundos que llevaron a una extinción masiva.
Aunque existen rastros de impresiones similares a raíces en los suelos fósiles del Silúrico Tardío, los fósiles corporales muestran que las primeras plantas carecían de raíces. Muchas tenían ramas postradas que se extendían por el suelo, con ejes verticales o talos dispersos aquí y allá, y algunas incluso tenían ramas subterráneas no fotosintéticas que carecían de estomas. Las raíces tienen un casquete radicular, a diferencia de las ramas especializadas. Así, mientras que las plantas del Siluro-Devónico, como Rhynia y Horneophyton poseían el equivalente fisiológico de las raíces, las raíces (definidas como órganos diferenciados de los tallos) no llegaron hasta más tarde. Desafortunadamente, las raíces rara vez se conservan en el registro fósil.
Los rizoides (pequeñas estructuras que cumplen la misma función que las raíces, generalmente de un diámetro celular) probablemente evolucionaron muy temprano, tal vez incluso antes de que las plantas colonizaran la tierra; se reconocen en las Characeae, un grupo de algas hermano de las plantas terrestres. Dicho esto, los rizoides probablemente evolucionaron más de una vez; las rizinas de los líquenes, por ejemplo, cumplen una función similar. Incluso algunos animales (Lamellibrachia) tienen estructuras similares a raíces. Los rizoides son claramente visibles en los fósiles de sílex de Rhynie y estaban presentes en la mayoría de las primeras plantas vasculares, y sobre esta base parecen haber presagiado verdaderas raíces vegetales.
En el sílex de Rhynie son comunes estructuras más avanzadas, y muchos otros fósiles de una edad Devónica temprana comparable presentan estructuras que parecen raíces y se comportan como tales. Los riniófitos tenían rizoides finos, y los trimerófitos y los licopodios herbáceos del sílex tenían estructuras similares a raíces que penetraban unos pocos centímetros en el suelo. Sin embargo, ninguno de estos fósiles muestra todas las características de las raíces modernas, con la excepción de Asteroxylon, que recientemente ha sido reconocido como portador de raíces que evolucionaron independientemente de las de las plantas vasculares actuales. Las raíces y las estructuras similares a raíces se hicieron cada vez más comunes y penetraban más profundamente durante el Devónico, y los licopodios formaban raíces de unos 20 cm de largo durante el Eifeliense y el Givetiense. A estos se unieron las progimnospermas, que enraizaban hasta aproximadamente un metro de profundidad, durante la etapa Frasniense posterior. Las gimnospermas verdaderas y los helechos zigopteridos también formaron sistemas de raíces poco profundas durante el Fameniano.
Los rizóforos de los licopodios proporcionan un enfoque ligeramente diferente al enraizamiento. Eran equivalentes a tallos, con órganos equivalentes a hojas que desempeñaban el papel de raicillas. Una construcción similar se observa en el licopodio actual Isoetes, y esto parece ser evidencia de que las raíces evolucionaron independientemente al menos dos veces, en los licopodios y otras plantas, una proposición respaldada por estudios que muestran que las raíces se inician y su crecimiento es promovido por diferentes mecanismos en los licopodios y eufilofitos.
Las plantas de raíces tempranas son un poco más avanzadas que sus antecesoras silúricas, sin un sistema de raíces específico; sin embargo, se puede ver claramente que los ejes planos tienen crecimientos similares a los rizoides de las briofitas actuales.
En el Devónico medio y tardío, la mayoría de los grupos de plantas habían desarrollado de forma independiente un sistema de raíces de algún tipo. A medida que las raíces se hicieron más grandes, pudieron sostener árboles más grandes y el suelo se erosionó hasta alcanzar una mayor profundidad. Esta erosión más profunda tuvo efectos no solo en la mencionada reducción de CO2, sino que también abrió nuevos hábitats para la colonización de hongos y animales.
Las raíces más estrechas de las plantas modernas tienen apenas 40 μm de diámetro y no podrían transportar físicamente agua si fueran más estrechas. Las primeras raíces fósiles recuperadas, en cambio, se estrecharon de 3 mm a menos de 700 μm de diámetro; por supuesto, la tafonomía es el control definitivo del grosor que se puede ver.
Forma de árbol


El paisaje del Devónico temprano carecía de vegetación que fuera más alta que la cintura. Una mayor altura proporcionaba una ventaja competitiva en la captación de luz solar para la fotosíntesis, la sombra de los competidores y la distribución de las esporas, ya que las esporas (y más tarde, las semillas) podían ser transportadas por el viento a mayores distancias si comenzaban a mayor altura. Se requería un sistema vascular eficaz para alcanzar mayores alturas. Para lograr la arborescencia, las plantas tenían que desarrollar tejido leñoso que les proporcionara tanto soporte como transporte de agua, y por lo tanto necesitaban desarrollar la capacidad de crecimiento secundario. La estela de las plantas que experimentan un crecimiento secundario está rodeada por un cambium vascular, un anillo de células meristemáticas que produce más xilema en el interior y floema en el exterior. Dado que las células del xilema están compuestas de tejido muerto y lignificado, los anillos posteriores de xilema se agregan a los ya presentes, formando madera. Los fósiles de plantas del Devónico temprano muestran que una forma simple de madera apareció por primera vez hace al menos 400 millones de años, en una época en la que todas las plantas terrestres eran pequeñas y herbáceas. Dado que la madera evolucionó mucho antes que los arbustos y los árboles, es probable que su propósito original fuera el transporte de agua y que, más tarde, solo se utilizara como soporte mecánico.
Las primeras plantas que desarrollaron un crecimiento secundario y un porte leñoso fueron aparentemente los helechos, y ya en el Devónico medio una especie, Wattieza, había alcanzado alturas de 8 m y un porte arbóreo.

Otros clados no tardaron mucho en desarrollar una estatura similar a la de un árbol. El Archaeopteris del Devónico tardío, un precursor de las gimnospermas que evolucionaron a partir de las trimerófitas, alcanzó los 30 m de altura. Las progimnospermas fueron las primeras plantas en desarrollar madera verdadera, que creció a partir de un cambium bifacial. La primera aparición de una de ellas, Rellimia, fue en el Devónico medio. Se cree que la madera verdadera solo evolucionó una vez, lo que dio lugar al concepto de un clado de "lignofitas".
Los bosques de Archaeopteris pronto se complementaron con licopodios arborescentes, en forma de Lepidodendrales, que superaban los 50 m de altura y los 2 m de ancho en la base. Estos licopodios arborescentes se extendieron hasta dominar los bosques del Devónico tardío y del Carbonífero, que dieron origen a los depósitos de carbón. Los Lepidodendrales se diferencian de los árboles modernos en que exhiben un crecimiento determinado: después de acumular una reserva de nutrientes a una altura inferior, las plantas se "espigaban" como un solo tronco hasta una altura determinada genéticamente, se ramificaban a ese nivel, esparcían sus esporas y morían. Estaban compuestos de madera "barata" para permitir su rápido crecimiento, con al menos la mitad de sus tallos comprendiendo una cavidad llena de médula. Su madera también se generaba mediante un cambium vascular unifacial: no producía floema nuevo, lo que significa que los troncos no podían crecer más anchos con el tiempo.La cola de caballo Calamites apareció en el Carbonífero. A diferencia de la cola de caballo moderna Equisetum, Calamites tenía un cambium vascular unifacial, lo que le permitía desarrollar madera y crecer hasta alturas superiores a los 10 m y ramificarse repetidamente.
Si bien la forma de los árboles primitivos era similar a la de los actuales, las espermatofitas o plantas con semillas, el grupo que contiene todos los árboles modernos, aún no había evolucionado. Los grupos de árboles dominantes en la actualidad son todas las plantas con semillas, las gimnospermas, que incluyen los árboles coníferos, y las angiospermas, que contienen todos los árboles que dan fruto y flores. No existen árboles con esporas libres como Archaeopteris en la flora actual. Durante mucho tiempo se creyó que las angiospermas surgieron de dentro de las gimnospermas, pero la evidencia molecular reciente sugiere que sus representantes actuales forman dos grupos distintos. Los datos moleculares aún deben conciliarse por completo con los datos morfológicos, pero se está aceptando que el apoyo morfológico para la parafilia no es especialmente fuerte. Esto llevaría a la conclusión de que ambos grupos surgieron de dentro de las pteridospermas, probablemente ya en el Pérmico.
Las angiospermas y sus ancestros desempeñaron un papel muy pequeño hasta que se diversificaron durante el Cretácico. Comenzaron como organismos pequeños, amantes de la humedad, en el sotobosque y se han ido diversificando desde el Cretácico hasta convertirse en el miembro dominante de los bosques no boreales actuales.
Semillas


Las primeras plantas terrestres se reproducían a la manera de los helechos: las esporas germinaban en pequeños gametofitos, que producían óvulos y/o espermatozoides. Estos espermatozoides nadaban a través de suelos húmedos para encontrar los órganos femeninos (arquegonios) en el mismo gametofito o en otro, donde se fusionaban con un óvulo para producir un embrión, que germinaba en un esporofito.
Las plantas heterospóricas, como su nombre indica, tienen esporas de dos tamaños: microsporas y megasporas. Estas germinarían para formar microgametofitos y megagametofitos, respectivamente. Este sistema allanó el camino para los óvulos y las semillas: llevado al extremo, los megasporangios podían tener solo una tétrada de megasporas y para completar la transición a óvulos verdaderos, tres de las megasporas en la tétrada original podían ser abortadas, dejando una megaspora por megasporangio.
La transición a óvulos continuó con esta megaspora que estaba "encajonada" en su esporangio mientras germinaba. Luego, el megagametofito quedó contenido dentro de un tegumento impermeable, que envolvía la semilla. El grano de polen, que contenía un microgametofito germinado a partir de una microspora, se utilizó para la dispersión del gameto masculino, liberando su espermatozoide flagelado propenso a la desecación solo cuando alcanzó un megagametofito receptivo.
Los licopodios y los esfenopsidos han recorrido un largo camino hasta llegar al hábito de la semilla sin cruzar nunca el umbral. Se conocen megasporas fósiles de licopodios que alcanzan 1 cm de diámetro y están rodeadas de tejido vegetativo (Lepidocarpon, Achlamydocarpon); – éstas incluso germinaron en un megagametofito in situ. Sin embargo, no llegaron a ser óvulos, ya que la nucela, una capa interna que cubre las esporas, no encierra completamente la espora. Queda una hendidura muy pequeña (micrópilo), lo que significa que el megasporangio todavía está expuesto a la atmósfera. Esto tiene dos consecuencias: en primer lugar, significa que no es totalmente resistente a la desecación, y en segundo lugar, los espermatozoides no tienen que "excavar" para acceder a la arquegonia de la megaspora.
Se ha identificado un precursor del Devónico medio de las plantas con semillas de Bélgica que es anterior a las primeras plantas con semillas en unos 20 millones de años. Runcaria, pequeña y radialmente simétrica, es un megasporangio tegumentado rodeado por una cúpula. El megasporangio tiene una extensión distal sin abrir que sobresale por encima del tegumento multilobulado. Se sospecha que la extensión estaba involucrada en la polinización anemófila. Runcaria arroja nueva luz sobre la secuencia de adquisición de caracteres que conduce a la semilla. Runcaria tiene todas las cualidades de las plantas con semillas excepto una cubierta sólida de la semilla y un sistema para guiar el polen hasta el óvulo.
Las primeras espermatofitas (literalmente: "plantas con semillas") –es decir, las primeras plantas que dieron semillas verdaderas– se denominan pteridospermas: literalmente, "helechos con semillas", llamadas así porque su follaje consistía en frondas parecidas a las de los helechos, aunque no estaban estrechamente relacionadas con ellos. La evidencia fósil más antigua de plantas con semillas es del Devónico tardío, y parecen haber evolucionado a partir de un grupo anterior conocido como las progimnospermas. Estas primeras plantas con semillas iban desde árboles hasta arbustos pequeños y rastreros; como la mayoría de las primeras progimnospermas, eran plantas leñosas con follaje parecido al de los helechos. Todas tenían óvulos, pero no conos, frutos ni nada similar. Si bien es difícil rastrear la evolución temprana de las semillas, el linaje de los helechos con semillas se puede rastrear desde las trimerófitas simples hasta las aneurófitas homosporosas. Las plantas con semillas experimentaron su primera radiación evolutiva importante en la era Fameniana.
Este modelo de semilla es compartido por prácticamente todas las gimnospermas (literalmente: "semillas desnudas"), la mayoría de las cuales encierran sus semillas en un cono leñoso o un arilo carnoso (el tejo, por ejemplo), pero ninguna de ellas encierra completamente sus semillas. Las angiospermas (semillas vasculares) son el único grupo que encierra completamente la semilla, en un carpelo.
Las semillas completamente cerradas abrieron un nuevo camino para las plantas: el de la latencia de las semillas. El embrión, completamente aislado de la atmósfera externa y, por lo tanto, protegido de la desecación, podía sobrevivir algunos años de sequía antes de germinar. Se ha descubierto que las semillas de gimnospermas del Carbonífero Tardío contienen embriones, lo que sugiere un largo intervalo entre la fertilización y la germinación. Este período está asociado con la entrada en un período de invernadero terrestre, con un aumento asociado de la aridez. Esto sugiere que la latencia surgió como respuesta a las condiciones climáticas más secas, en las que se volvió ventajoso esperar un período húmedo antes de germinar. Este avance evolutivo parece haber abierto una compuerta: ahora se podían tolerar áreas previamente inhóspitas, como las laderas secas de las montañas, y pronto quedaron cubiertas por árboles.
Las semillas ofrecían más ventajas a sus portadores: aumentaban la tasa de éxito de los gametofitos fertilizados y, como se podía "empaquetar" un depósito de nutrientes junto con el embrión, las semillas podían germinar rápidamente en entornos inhóspitos y alcanzar un tamaño que les permitiera valerse por sí mismas con mayor rapidez. Por ejemplo, sin un endospermo, las plántulas que crecían en entornos áridos no tendrían las reservas necesarias para desarrollar raíces lo suficientemente profundas como para alcanzar el nivel freático antes de morir por deshidratación. Del mismo modo, las semillas que germinaban en un sotobosque sombrío necesitaban una reserva adicional de energía para crecer rápidamente lo suficientemente alto como para captar suficiente luz para su autoabastecimiento. Una combinación de estas ventajas dio a las plantas con semillas una ventaja ecológica sobre el género Archaeopteris, que antes era dominante, aumentando así la biodiversidad de los bosques primitivos.
A pesar de estas ventajas, es común que los óvulos fertilizados no maduren como semillas. Además, durante la latencia de las semillas (a menudo asociada con condiciones impredecibles y estresantes), el daño del ADN se acumula. Por lo tanto, el daño del ADN parece ser un problema básico para la supervivencia de las plantas con semillas, así como el daño del ADN es un problema importante para la vida en general.
Flores

Las flores son hojas modificadas que solo poseen las angiospermas, que aparecen relativamente tarde en el registro fósil. El grupo se originó y se diversificó durante el Cretácico Inferior y adquirió importancia ecológica a partir de entonces. Las estructuras similares a flores aparecen por primera vez en los registros fósiles hace unos 130 millones de años, en el Cretácico. Sin embargo, en 2018, los científicos informaron del hallazgo de una flor fósil de hace unos 180 millones de años, 50 millones de años antes de lo que se creía anteriormente. Sin embargo, la interpretación ha sido muy discutida.
Estructuras coloridas y/o picantes rodean los conos de plantas como las cícadas y las gnetales, lo que hace difícil definir con precisión el término "flor".
La función principal de una flor es la reproducción, que, antes de la evolución de la flor y las angiospermas, era tarea de las microsporofilas y megasporofilas. Una flor puede considerarse una poderosa innovación evolutiva, porque su presencia permitió al mundo vegetal acceder a nuevos medios y mecanismos para la reproducción.
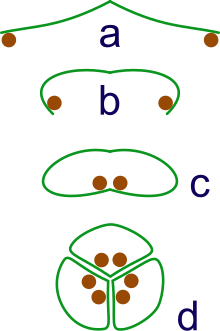
a: esporangia borne at tips of leaf
b: La hoja se acurruca para proteger la esporangia
c) Rizos de hoja para formar rollos cerrados
d: agrupación de tres rollos en un sincarp
Durante mucho tiempo se ha asumido que las plantas con flores evolucionaron a partir de las gimnospermas; según la visión morfológica tradicional, están estrechamente relacionadas con las Gnetales. Sin embargo, como se señaló anteriormente, la evidencia molecular reciente contradice esta hipótesis y sugiere además que las Gnetales están más estrechamente relacionadas con algunos grupos de gimnospermas que las angiospermas, y que las gimnospermas actuales forman un clado distinto de las angiospermas, y que los dos clados divergieron hace unos 300 millones de años.
La relación de los grupos de tallos con las angiospermas es importante para determinar la evolución de las flores. Los grupos de tallos proporcionan una idea del estado de las "bifurcaciones" anteriores en el camino hacia el estado actual. La convergencia aumenta el riesgo de identificar erróneamente los grupos de tallos. Dado que la protección del megagametofito es deseable desde el punto de vista evolutivo, probablemente muchos grupos separados desarrollaron envolturas protectoras de forma independiente. En las flores, esta protección toma la forma de un carpelo, que evolucionó a partir de una hoja y se reclutó para desempeñar una función protectora, protegiendo a los óvulos. Estos óvulos están protegidos además por un tegumento de doble pared.
Para atravesar estas capas protectoras se necesita algo más que un microgametofito que flote libremente. Las angiospermas tienen granos de polen compuestos por sólo tres células. Una de ellas es la encargada de perforar los tegumentos y crear un conducto por el que fluyan hacia abajo los dos espermatozoides. El megagametofito tiene sólo siete células; de ellas, una se fusiona con un espermatozoide, formando el núcleo del propio óvulo, y otra se une al otro espermatozoide y se dedica a formar un endospermo rico en nutrientes. Las demás células desempeñan funciones auxiliares. Este proceso de "doble fecundación" es único y común a todas las angiospermas.

En el registro fósil, hay tres grupos intrigantes que tenían estructuras similares a las flores. El primero es la pteridosperma pérmica Glossopteris, que ya tenía hojas curvadas que se parecían a los carpelos. La Caytonia mesozoica es aún más parecida a una flor, con óvulos cerrados, pero un solo tegumento. Además, los detalles de su polen y estambres las distinguen de las verdaderas plantas con flores.
Las Bennettitales tenían órganos muy parecidos a las flores, protegidos por verticilos de brácteas que pueden haber desempeñado un papel similar al de los pétalos y sépalos de las flores verdaderas; sin embargo, estas estructuras parecidas a flores evolucionaron de forma independiente, ya que las Bennettitales están más relacionadas con las cícadas y los ginkgos que con las angiospermas.
Sin embargo, no se encuentran flores verdaderas en ningún grupo, salvo en los que existen hoy en día. La mayoría de los análisis morfológicos y moleculares ubican a Amborella, las ninfeales y las Austrobaileyaceae en un clado basal llamado "ANA". Este clado parece haber divergido en el Cretácico temprano, hace alrededor de 130 millones de años, aproximadamente al mismo tiempo que las primeras angiospermas fósiles, y justo después del primer polen similar a las angiospermas, hace 136 millones de años. Los magnólidos divergieron poco después, y una rápida radiación había producido eudicotiledóneas y monocotiledóneas hace 125 millones de años. A finales del Cretácico, hace 66 millones de años, más del 50% de los órdenes de angiospermas actuales habían evolucionado y el clado representaba el 70% de las especies globales. Fue en esa época cuando los árboles con flores se volvieron dominantes sobre las coníferas.
Las características de los grupos basales "ANA" sugieren que las angiospermas se originaron en áreas oscuras, húmedas y frecuentemente perturbadas. Parece que las angiospermas permanecieron confinadas a dichos hábitats durante todo el Cretácico, ocupando el nicho de las pequeñas hierbas al principio de la serie sucesional. Esto puede haber restringido su importancia inicial, pero les dio la flexibilidad que explicó la rapidez de sus diversificaciones posteriores en otros hábitats.
| Vista tradicional | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Vista moderna | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Algunos proponen que las angiospermas surgieron de un helecho con semillas desconocido, el pteridofito, y consideran a las cícadas como helechos con semillas vivos con hojas estériles y portadoras de semillas (Cycas revoluta).
En agosto de 2017, los científicos presentaron una descripción detallada y una reconstrucción en 3D de lo que posiblemente sea la primera flor que existió hace unos 140 millones de años.
Origen de la flor
La familia Amborellaceae se considera el clado hermano de todas las demás plantas con flores actuales. En diciembre de 2013 se publicó un borrador del genoma de Amborella trichopoda. Al comparar su genoma con los de todas las demás plantas con flores actuales, será posible determinar las características más probables del ancestro de A. trichopoda y de todas las demás plantas con flores, es decir, la planta con flores ancestral.
Parece que, a nivel de órgano, la hoja puede ser el ancestro de la flor, o al menos de algunos órganos florales. Cuando algunos genes cruciales involucrados en el desarrollo de la flor son mutados, grupos de estructuras similares a hojas surgen en lugar de flores. Por lo tanto, en algún momento de la historia, el programa de desarrollo que conduce a la formación de una hoja debe haber sido alterado para generar una flor. Probablemente también existe un marco general sólido dentro del cual se ha generado la diversidad floral. Un ejemplo de ello es un gen llamado LEAFY (LFY), que está involucrado en el desarrollo de la flor en Arabidopsis thaliana. Los homólogos de este gen se encuentran en angiospermas tan diversas como el tomate, la boca de dragón, el guisante, el maíz e incluso las gimnospermas. La expresión de LFY de Arabidopsis thaliana en plantas distantes como el álamo y los cítricos también da como resultado la producción de flores en estas plantas. El gen LFY regula la expresión de algunos genes pertenecientes a la familia MADS-box. Estos genes, a su vez, actúan como controladores directos del desarrollo de las flores.
Función adaptativa de las flores
Es probable que las flores hayan surgido durante la evolución de las plantas como una adaptación para facilitar la fecundación cruzada (exogamia), un proceso que conduce al enmascaramiento de mutaciones recesivas deletéreas en los genomas de la progenie. Este efecto de enmascaramiento de la expresión de mutaciones deletéreas se conoce como complementación genética. Este efecto de enmascaramiento beneficioso de la fecundación cruzada también se considera la base del vigor híbrido o heterosis en la progenie. Una vez que las flores se han establecido en un linaje en función de su función adaptativa de promover la fecundación cruzada, el cambio posterior a la endogamia suele resultar desventajoso, principalmente porque permite la expresión de las mutaciones recesivas deletéreas previamente enmascaradas, es decir, la depresión endogámica. Además, la meiosis, el proceso por el cual se produce la progenie de semillas en las plantas con flores, proporciona un mecanismo directo para reparar el ADN a través de la recombinación genética. Así, en las plantas con flores, los dos procesos fundamentales de la reproducción sexual son la fecundación cruzada y la meiosis, y estos dos procesos parecen mantenerse respectivamente gracias a las ventajas de la complementación genética y la reparación recombinatoria del ADN.
Evolución de la familia MADS-box
Los miembros de la familia de factores de transcripción MADS-box desempeñan un papel muy importante y evolutivamente conservado en el desarrollo de las flores. Según el modelo ABC del desarrollo de las flores, se generan tres zonas —A, B y C— dentro del primordio de la flor en desarrollo, por la acción de algunos factores de transcripción, que son miembros de la familia MADS-box. Entre ellos, las funciones de los genes de los dominios B y C han sido evolutivamente más conservadas que las del gen del dominio A. Muchos de estos genes han surgido a través de duplicaciones genéticas de miembros ancestrales de esta familia. Un buen número de ellos muestran funciones redundantes.
La evolución de la familia MADS-box ha sido ampliamente estudiada. Estos genes están presentes incluso en las pteridofitas, pero su extensión y diversidad es mucho mayor en las angiospermas. Parece haber un patrón bastante amplio en la evolución de esta familia. Consideremos la evolución del gen de la región C AGAMOUS (AG). Se expresa en las flores actuales en los estambres y el carpelo, que son los órganos reproductores. Su antecesor en las gimnospermas también tiene el mismo patrón de expresión. Aquí, se expresa en los estróbilos, un órgano que produce polen u óvulos. De manera similar, los antecesores de los genes B (AP3 y PI) se expresan solo en los órganos masculinos de las gimnospermas. Sus descendientes en las angiospermas modernas también se expresan solo en los estambres, el órgano reproductor masculino. Por lo tanto, los mismos componentes existentes en ese momento fueron utilizados por las plantas de una manera novedosa para generar la primera flor. Este es un patrón recurrente en la evolución.
Factores que influyen en la diversidad floral
Existe una enorme variación en la estructura floral de las plantas, generalmente debido a cambios en los genes MADS-box y su patrón de expresión. Por ejemplo, las gramíneas poseen estructuras florales únicas. Los carpelos y estambres están rodeados por lodículas con forma de escamas y dos brácteas, la lema y la pálea, pero la evidencia genética y la morfología sugieren que las lodículas son homólogas a los pétalos de las eudicotiledóneas. La pálea y la lema pueden ser homólogas a los sépalos de otros grupos, o pueden ser estructuras únicas de las gramíneas. Otro ejemplo es el de Linaria vulgaris, que tiene dos tipos de simetrías florales: radial y bilateral. Estas simetrías se deben a cambios epigenéticos en un solo gen llamado CYCLOIDEA.

Arabidopsis thaliana tiene un gen llamado AGAMOUS que juega un papel importante en la definición de cuántos pétalos, sépalos y otros órganos se generan. Las mutaciones en este gen dan lugar a que el meristemo floral obtenga un destino indeterminado y a la proliferación de órganos florales en formas de flores dobles de rosas, claveles y campanillas. Estos fenotipos han sido seleccionados por los horticultores por su mayor número de pétalos. Varios estudios sobre diversas plantas como la petunia, el tomate, la impatiens, el maíz, etc. han sugerido que la enorme diversidad de flores es resultado de pequeños cambios en los genes que controlan su desarrollo.
El Proyecto Genoma Floral confirmó que el modelo ABC de desarrollo floral no se conserva en todas las angiospermas. A veces, los dominios de expresión cambian, como en el caso de muchas monocotiledóneas, y también en algunas angiospermas basales como Amborella. Diferentes modelos de desarrollo floral, como el modelo de límites desvanecidos o el modelo de límites superpuestos, que proponen dominios de expresión no rígidos, pueden explicar estas arquitecturas. Existe la posibilidad de que, desde las angiospermas basales hasta las modernas, los dominios de la arquitectura floral se hayan vuelto cada vez más fijos a través de la evolución.
Tiempo de floración
Otra característica floral que ha sido objeto de selección natural es el tiempo de floración. Algunas plantas florecen temprano en su ciclo de vida, otras requieren un período de vernalización antes de florecer. Este resultado se basa en factores como la temperatura, la intensidad de la luz, la presencia de polinizadores y otras señales ambientales: genes como CONSTANS (CO), Flowering Locus C (FLC) y FRIGIDA regulan la integración de señales ambientales en la vía de desarrollo de la flor. Las variaciones en estos loci se han asociado con variaciones en el tiempo de floración entre plantas. Por ejemplo, los ecotipos de Arabidopsis thaliana que crecen en las regiones frías y templadas requieren una vernalización prolongada antes de florecer, mientras que las variedades tropicales y las cepas de laboratorio más comunes no. Esta variación se debe a mutaciones en los genes FLC y FRIGIDA, lo que los vuelve no funcionales.
Muchos de los genes implicados en este proceso se conservan en todas las plantas estudiadas. Sin embargo, a veces, a pesar de la conservación genética, el mecanismo de acción resulta ser diferente. Por ejemplo, el arroz es una planta de día corto, mientras que Arabidopsis thaliana es una planta de día largo. Ambas plantas tienen las proteínas CO y FLOWERING LOCUS T (FT) pero, en Arabidopsis thaliana, CO mejora la producción de FT, mientras que en el arroz, el homólogo CO reprime la producción de FT, lo que da lugar a efectos completamente opuestos.
Teorías de la evolución de las flores
La teoría de las antofitas se basa en la observación de que el grupo de las gimnospermas Gnetales tiene un óvulo parecido a una flor. Tiene vasos parcialmente desarrollados como los que se encuentran en las angiospermas, y el megasporangio está cubierto por tres envolturas, como la estructura del ovario de las flores de las angiospermas. Sin embargo, muchas otras líneas de evidencia muestran que Gnetales no está relacionado con las angiospermas.
La teoría de la mayoría de los machos tiene una base más genética. Los defensores de esta teoría señalan que las gimnospermas tienen dos copias muy similares del gen LFY, mientras que las angiospermas sólo tienen una. El análisis del reloj molecular ha demostrado que el otro parálogo LFY se perdió en las angiospermas aproximadamente al mismo tiempo que los fósiles de flores se volvieron abundantes, lo que sugiere que este evento podría haber llevado a la evolución floral. Según esta teoría, la pérdida de uno de los parálogos LFY llevó a flores que eran más masculinas, con óvulos expresados ectópicamente. Estos óvulos inicialmente realizaban la función de atraer polinizadores, pero algún tiempo después, pueden haber sido integrados en la flor central.
Mecanismos y jugadores en evolución de la morfología vegetal

Si bien los factores ambientales son responsables en gran medida del cambio evolutivo, actúan simplemente como agentes de la selección natural. El cambio se produce inherentemente a través de fenómenos a nivel genético: mutaciones, reordenamientos cromosómicos y cambios epigenéticos. Si bien los tipos generales de mutaciones son válidos en todo el mundo viviente, en las plantas se han implicado otros mecanismos que son sumamente importantes.
La duplicación del genoma es un fenómeno relativamente frecuente en la evolución de las plantas y da lugar a poliploidía, que es, por tanto, una característica común en las plantas. Se estima que al menos la mitad (y probablemente todas) de las plantas han experimentado una duplicación del genoma a lo largo de su historia. La duplicación del genoma implica la duplicación de genes, lo que genera redundancia funcional en la mayoría de los genes. Los genes duplicados pueden alcanzar una nueva función, ya sea por cambios en el patrón de expresión o por cambios en la actividad. Se cree que la poliploidía y la duplicación de genes se encuentran entre las fuerzas más poderosas en la evolución de la forma de las plantas; aunque no se sabe por qué la duplicación del genoma es un proceso tan frecuente en las plantas. Una razón probable es la producción de grandes cantidades de metabolitos secundarios en las células vegetales. Algunos de ellos podrían interferir en el proceso normal de segregación cromosómica, causando la duplicación del genoma.

En los últimos tiempos, se ha demostrado que las plantas poseen familias significativas de microARN, que se conservan en muchos linajes de plantas. En comparación con los animales, si bien el número de familias de microARN de plantas es menor que en los animales, el tamaño de cada familia es mucho mayor. Los genes de microARN también están mucho más dispersos en el genoma que en los animales, donde están más agrupados. Se ha propuesto que estas familias de microARN se han expandido por duplicaciones de regiones cromosómicas. Se ha descubierto que muchos genes de microARN involucrados en la regulación del desarrollo de las plantas están bastante conservados entre las plantas estudiadas.
La domesticación de plantas como el maíz, el arroz, la cebada, el trigo, etc., también ha sido una fuerza impulsora importante en su evolución. Las investigaciones sobre el origen del maíz han descubierto que es un derivado domesticado de una planta silvestre de México llamada teosinte. El teosinte pertenece al género Zea, al igual que el maíz, pero tiene una inflorescencia muy pequeña, de 5 a 10 mazorcas duras y un tallo muy ramificado y extendido.

Los cruces entre una variedad particular de teosinte y maíz producen descendencia fértil que tiene un fenotipo intermedio entre el maíz y el teosinte. El análisis de QTL también ha revelado algunos loci que, cuando se mutan en el maíz, producen un tallo o mazorcas similares al teosinte. El análisis del reloj molecular de estos genes estima que sus orígenes se remontan a unos 9.000 años atrás, lo que coincide con otros registros de domesticación del maíz. Se cree que un pequeño grupo de agricultores debe haber seleccionado algún mutante natural del teosinte similar al maíz hace unos 9.000 años en México y lo sometió a una selección continua para producir la planta de maíz familiar de la actualidad.
La coliflor comestible es una versión domesticada de la planta silvestre Brassica oleracea, que no posee la inflorescencia densa e indiferenciada, llamada cuajada, que posee la coliflor. La coliflor posee una única mutación en un gen llamado CAL, que controla la diferenciación del meristemo en inflorescencia. Esto hace que las células del meristemo floral adquieran una identidad indiferenciada y, en lugar de convertirse en una flor, se conviertan en una masa densa de células del meristemo de la inflorescencia en desarrollo detenido. Esta mutación ha sido seleccionada a través de la domesticación al menos desde la época del imperio griego.
Evolución de caminos fotosintéticos

La vía metabólica C4 es una valiosa innovación evolutiva reciente en las plantas, que implica un conjunto complejo de cambios adaptativos en la fisiología y los patrones de expresión genética.
La fotosíntesis es una vía química compleja facilitada por una serie de enzimas y coenzimas. La enzima RuBisCO es responsable de "fijar" el CO2, es decir, lo une a una molécula de carbono para formar un azúcar que la planta puede utilizar, liberando así una molécula de oxígeno. Sin embargo, la enzima es notoriamente ineficiente y, a medida que aumenta la temperatura ambiente, fija cada vez más oxígeno en lugar de CO2 en un proceso llamado fotorrespiración. Esto es costoso en términos energéticos, ya que la planta tiene que utilizar energía para convertir los productos de la fotorrespiración en una forma que pueda reaccionar con el CO2.
Carbono concentrado
En términos generales, las dos formas principales de concentrar dióxido de carbono en las plantas son 1) mecanismos de concentración de CO2 bioquímicos (CCM) y 2) mecanismos de concentración de CO2 biofísicos. Los CCM bioquímicos como la fotosíntesis C4 y CAM concentran CO2 mediante el uso de una enzima, la fosfoenolpiruvato carboxilasa, para unir el carbono inorgánico a un azúcar intermedio de cuatro carbonos, que luego puede convertirse nuevamente en RuBP y CO2 para su posterior fijación por Rubisco. Los CCM biofísicos como los carboxisomas y los pirenoides concentran CO2 en un lugar determinado a través de la coordinación de las anhidrasas carbónicas y los canales aniónicos.
Las plantas C4 desarrollaron mecanismos de concentración de carbono que funcionan aumentando la concentración de CO2 alrededor de la RuBisCO y excluyendo el oxígeno, aumentando así la eficiencia de la fotosíntesis al disminuir la fotorrespiración. El proceso de concentración de CO2 alrededor de la RuBisCO requiere más energía que permitir que los gases se difundan, pero en ciertas condiciones (es decir, temperaturas cálidas (>25 °C), bajas concentraciones de CO2 o altas concentraciones de oxígeno) resulta rentable en términos de una menor pérdida de azúcares a través de la fotorrespiración.
Un tipo de metabolismo del C4 emplea una anatomía denominada de Kranz. Esta transporta CO2 a través de una capa de mesófilo externa, mediante una serie de moléculas orgánicas, hasta las células de la vaina del haz central, donde se libera el CO2. De esta manera, el CO2 se concentra cerca del sitio de operación de RuBisCO. Debido a que RuBisCO opera en un entorno con mucho más CO2 del que tendría en otras condiciones, funciona de manera más eficiente.
Un segundo mecanismo, la fotosíntesis CAM, separa temporalmente la fotosíntesis de la acción de RuBisCO. RuBisCO solo funciona durante el día, cuando los estomas están sellados y el CO2 se obtiene mediante la descomposición del químico malato. Luego, se extrae más CO2 de la atmósfera cuando los estomas se abren, durante las noches frescas y húmedas, lo que reduce la pérdida de agua.
El tercer mecanismo presente en las plantas, los CCM basados en pirenoides, se encuentra únicamente en el linaje de la antocerotida. En este mecanismo, la RuBisCO se concentra en el pirenoide, un compartimento sin membrana, mediante la importación de carbono inorgánico en forma de bicarbonato. Se cree que esta importación depende de la coordinación de las anhidrasas carbónicas y los canales aniónicos, y aprovecha las diferencias de pH nativas entre el citosol, el estroma del cloroplasto y el lumen del tilacoide.
Registro evolutivo
Estas dos vías, con el mismo efecto sobre RuBisCO, evolucionaron varias veces de forma independiente; de hecho, C4 solo surgió 62 veces en 18 familias de plantas diferentes. Una serie de "preadaptaciones" parecen haber allanado el camino para C4, lo que llevó a su agrupación en ciertos clados: se ha innovado con mayor frecuencia en plantas que ya tenían características tales como un tejido extenso de vaina de haces vasculares. Muchas vías evolutivas potenciales que resultan en el fenotipo C4 son posibles y se han caracterizado mediante inferencia bayesiana, lo que confirma que las adaptaciones no fotosintéticas a menudo proporcionan peldaños evolutivos para la evolución posterior de C4.
La construcción C4 es utilizada por un subconjunto de gramíneas, mientras que CAM es empleada por muchas suculentas y cactus. El rasgo C4 parece haber surgido durante el Oligoceno, alrededor de hace 25 a 32 millones de años; sin embargo, no se volvieron ecológicamente significativos hasta el Mioceno, hace 6 a 7 millones de años. Sorprendentemente, algunos fósiles carbonizados preservan tejido organizado en la anatomía de Kranz, con células de la vaina del haz intactas, lo que permite identificar la presencia del metabolismo C4. Se utilizan marcadores isotópicos para deducir su distribución y significado. Las plantas C3 utilizan preferentemente el más ligero de los dos isótopos del carbono presentes en la atmósfera, el 12C, que participa más fácilmente en las vías químicas implicadas en su fijación. Como el metabolismo del C4 implica un paso químico adicional, este efecto se acentúa. Se puede analizar el material vegetal para deducir la relación entre el más pesado 13C y el 12C. Esta relación se denomina δ13 C. Las plantas C3 son, en promedio, alrededor de 14‰ (partes por mil) más ligeras que la relación atmosférica, mientras que las plantas C4 son alrededor de 28‰ más ligeras. El δ13 C de las plantas CAM depende del porcentaje de carbono fijado por la noche en relación con lo que se fija durante el día, siendo más cercano a las plantas C3 si fijan la mayor parte del carbono durante el día y más cercano a las plantas C4 si fijan todo su carbono durante la noche.
El material fósil original en cantidad suficiente para analizar la hierba en sí es escaso, pero los caballos proporcionan un buen indicador. Estaban globalmente extendidos en el período de interés y se alimentaban casi exclusivamente de hierbas. Hay una vieja frase en paleontología isotópica: "Eres lo que comes (más un poco)". Esto se refiere al hecho de que los organismos reflejan la composición isotópica de lo que comen, más un pequeño factor de ajuste. Hay un buen registro de dientes de caballo en todo el mundo, y su registro de δ13 C muestra una marcada inflexión negativa alrededor de hace 6 a 7 millones de años, durante el Messiniense, que se interpreta como resultado del surgimiento de plantas C4 a escala global.
Ventajas de C4
Si bien el C4 mejora la eficiencia de RuBisCO, la concentración de carbono requiere un alto consumo de energía. Esto significa que las plantas C4 solo tienen ventaja sobre los organismos C3 en ciertas condiciones: a saber, altas temperaturas y escasas precipitaciones. Las plantas C4 también necesitan altos niveles de luz solar para prosperar. Los modelos sugieren que, sin los incendios forestales que eliminan los árboles y arbustos que dan sombra, no habría espacio para las plantas C4. Pero los incendios forestales han ocurrido durante 400 millones de años. El Carbonífero (hace unos 300 millones de años) tenía niveles de oxígeno notoriamente altos –casi suficientes para permitir la combustión espontánea– y niveles muy bajos de CO2, pero no se ha encontrado ninguna señal isotópica de C4. Tampoco parece haber un desencadenante repentino del ascenso del Mioceno.
Durante el Mioceno, la atmósfera y el clima eran relativamente estables. En todo caso, el CO2 aumentó gradualmente entre hace 14 y 9 millones de años, antes de estabilizarse en concentraciones similares a las del Holoceno. Esto sugiere que no tuvo un papel clave en la evolución del C4. Las propias gramíneas (el grupo que daría lugar a la mayor cantidad de apariciones de C4) probablemente habían existido durante 60 millones de años o más, por lo que habían tenido mucho tiempo para desarrollar C4, que, en cualquier caso, está presente en una amplia gama de grupos y, por lo tanto, evolucionó de forma independiente. Hay una fuerte señal de cambio climático en el sur de Asia: la creciente aridez (y, por lo tanto, el aumento de la frecuencia e intensidad de los incendios) puede haber llevado a un aumento de la importancia de los pastizales. Sin embargo, esto es difícil de conciliar con el registro norteamericano. Es posible que la señal sea completamente biológica, forzada por la aceleración de la evolución de la hierba impulsada por el fuego, que, tanto al aumentar la erosión como al incorporar más carbono a los sedimentos, redujo los niveles de CO2 atmosférico. Finalmente, hay evidencia de que la aparición de C4 hace entre 9 y 7 millones de años es una señal sesgada, que solo es válida para Norteamérica, de donde se originan la mayoría de las muestras; la evidencia emergente sugiere que los pastizales evolucionaron a un estado dominante al menos 15 millones de años antes en Sudamérica.
Evolución de la regulación transcripcional
Los factores de transcripción y las redes reguladoras de la transcripción desempeñan un papel fundamental en el desarrollo de las plantas y en sus respuestas al estrés, así como en su evolución. Durante el aterrizaje de las plantas, surgieron muchas familias de factores de transcripción nuevos que se conectan preferentemente a las redes de desarrollo multicelular, reproducción y desarrollo de órganos, lo que contribuye a una morfogénesis más compleja de las plantas terrestres.
Evolución del metabolismo secundario
Los metabolitos secundarios son esencialmente compuestos de bajo peso molecular, a veces con estructuras complejas, que no son esenciales para los procesos normales de crecimiento, desarrollo o reproducción. Funcionan en procesos tan diversos como la inmunidad, la lucha contra la herbívora, la atracción de polinizadores, la comunicación entre plantas, el mantenimiento de asociaciones simbióticas con la flora del suelo o la mejora de la tasa de fertilización, y por lo tanto son importantes desde la perspectiva evo-devo. Los metabolitos secundarios son estructural y funcionalmente diversos, y se estima que cientos de miles de enzimas podrían estar involucradas en el proceso de producción de los mismos, con alrededor del 15-25% del genoma codificando para estas enzimas, y cada especie tiene su arsenal único de metabolitos secundarios. Muchos de estos metabolitos, como el ácido salicílico, son de importancia médica para los humanos.
No está claro el propósito de producir tantos metabolitos secundarios, con una proporción significativa del metaboloma dedicada a esta actividad. Se postula que la mayoría de estos compuestos químicos ayudan a generar inmunidad y, en consecuencia, la diversidad de estos metabolitos es el resultado de una constante carrera armamentista entre las plantas y sus parásitos. Algunas evidencias respaldan este argumento. Una cuestión central es el costo reproductivo de mantener un inventario tan grande de genes dedicados a producir metabolitos secundarios. Se han sugerido varios modelos que investigan este aspecto de la cuestión, pero aún no se ha establecido un consenso sobre la magnitud del costo, ya que todavía es difícil predecir si una planta con más metabolitos secundarios aumenta su supervivencia o éxito reproductivo en comparación con otras plantas de su entorno.
La producción de metabolitos secundarios parece haber surgido bastante temprano durante la evolución. En las plantas, parece haberse extendido utilizando mecanismos que incluyen duplicaciones de genes o la evolución de genes nuevos. Además, la investigación ha demostrado que la diversidad en algunos de estos compuestos puede ser seleccionada positivamente. Aunque el papel de la evolución de genes nuevos en la evolución del metabolismo secundario es claro, hay varios ejemplos en los que se han formado nuevos metabolitos mediante pequeños cambios en la reacción. Por ejemplo, se ha propuesto que los glicósidos de cianógeno han evolucionado varias veces en diferentes linajes de plantas. Hay varios ejemplos de evolución convergente. Por ejemplo, las enzimas para la síntesis de limoneno (un terpeno) son más similares entre las angiospermas y las gimnospermas que entre sus propias enzimas de síntesis de terpenos. Esto sugiere una evolución independiente de la vía biosintética del limoneno en estos dos linajes.
Evolución de interacciones entre plantas y microbios
El origen de los microbios en la Tierra, que se remonta al comienzo de la vida hace más de 3.500 millones de años, indica que las interacciones entre microbios han evolucionado y se han diversificado continuamente con el tiempo, mucho antes de que las plantas comenzaran a colonizar la tierra hace 450 millones de años. Por lo tanto, es probable que las interacciones intermicrobianas tanto dentro como entre reinos representen fuertes impulsores del establecimiento de consorcios microbianos asociados a las plantas en la interfaz suelo-raíz. No obstante, sigue sin estar claro en qué medida estas interacciones en la rizosfera/filosfera y en los compartimentos endofíticos de las plantas (es decir, dentro del huésped) dan forma a los ensamblajes microbianos en la naturaleza y si la adaptación microbiana a los hábitats de las plantas impulsa estrategias de interacción entre microbios específicas del hábitat que afectan la aptitud de las plantas. Además, la contribución de las interacciones competitivas y cooperativas entre microbios a la estructura general de la comunidad sigue siendo difícil de evaluar en la naturaleza debido al fuerte ruido ambiental.
Véase también
- Evolución del herbívoro
- Historia evolutiva de la vida
- Paleobotany
- Biología del desarrollo vegetal
- Timeline of plant evolution
Referencias
- ^ a b c d e f g h i j k l m Stewart, W.N.; Rothwell, G.W. (1993). Paleobotany and the evolution of plants (2 ed.). Cambridge University Press. ISBN 978-0-521-23315-6.
- ^ a b Strother, Paul K.; Battison, Leila; Brasier, Martin D.; Wellman, Charles H. (2011). "Earth's earliest non-marine eukaryotes". Nature. 473 (7348): 505–509. Bibcode:2011Natur.473..505S. doi:10.1038/nature09943. PMID 21490597. S2CID 4418860.
- ^ a b c Knauth, L. Paul; Kennedy, Martin J. (2009). "The late Precambrian greening of the Earth". Nature. 460 (7256): 728–732. Bibcode:2009Natur.460..728K. doi:10.1038/nature08213. PMID 19587681. S2CID 4398942.
- ^ Rothwell, G. W.; Scheckler, S. E.; Gillespie, W. H. (1989). "Elkinsia gen. nov., a Late Devonian gymnosperm with cupulate ovules". Botanical Gazette. 150 (2): 170–189. doi:10.1086/337763. S2CID 84303226.
- ^ Kenrick, P.; Crane, P.R. (1997). The origin and early diversification of land plants. A cladistic study. Washington: Smithsonian Institution Press. ISBN 978-1-56098-729-1.
- ^ a b c d e f g h i j k l m n Raven, J.A.; Edwards, D. (2001). "Roots: evolutionary origins and biogeochemical significance". Journal of Experimental Botany. 52 (90001): 381–401. doi:10.1093/jexbot/52.suppl_1.381. PMID 11326045.
- ^ Del-Bem, L. E. (2018). "Xyloglucan evolution and the terrestrialization of green plants". New Phytologist. 219 (4): 1150–1153. doi:10.1111/nph.15191. hdl:1843/36860. PMID 29851097.
- ^ Heckman, D. S.; Geiser, D. M.; Eidell, B. R.; Stauffer, R. L.; Kardos, N. L.; Hedges, S. B. (August 2001). "Molecular evidence for the early colonization of land by fungi and plants". Science. 293 (5532): 1129–1133. doi:10.1126/science.1061457. PMID 11498589. S2CID 10127810.
- ^ Battison, Leila; Brasier, Martin D. (August 2009). "Exceptional Preservation of Early Terrestrial Communities in Lacustrine Phosphate One Billion Years Ago" (PDF). In Smith, Martin R.; O'Brien, Lorna J.; Caron, Jean-Bernard (eds.). Abstract Volume. International Conference on the Cambrian Explosion (Walcott 2009). Toronto, Ontario, Canada: The Burgess Shale Consortium (published 31 July 2009). ISBN 978-0-9812885-1-2.
- ^ Battistuzzi, F. U.; Feijao, A.; Hedges, S. B. (2004). "A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land". BMC Evolutionary Biology. 4: 44. doi:10.1186/1471-2148-4-44. PMC 533871. PMID 15535883.
- ^ Nelsen, Matthew P.; Lucking, Robert; Boyce, C. Kevin; Lumbsch, H. Thorsten; Ree, Richard H. (2019). "No support for the emergence of lichens prior to the evolution of vascular plants". Geobiology. 18 (1): 3–13. doi:10.1111/gbi.12369. PMID 31729136.
- ^ Kump, L. R.; Pavlov, A.; Arthur, M. A. (2005). "Massive release of hydrogen sulfide to the surface ocean and atmosphere during intervals of oceanic anoxia". Geology. 33 (5): 397. Bibcode:2005Geo....33..397K. doi:10.1130/G21295.1.
- ^ Butterfield, N. J. (2009). "Oxygen, animals and oceanic ventilation: An alternative view". Geobiology. 7 (1): 1–7. Bibcode:2009Gbio....7....1B. doi:10.1111/j.1472-4669.2009.00188.x. PMID 19200141. S2CID 31074331.
- ^ Dahl, Tais W.; Arens, Suzanne K.M. (2020). "The impacts of land plant evolution on Earth's climate and oxygenation state – An interdisciplinary review". Chemical Geology. 547. Bibcode:2020ChGeo.54719665D. doi:10.1016/j.chemgeo.2020.119665.
- ^ Strother, P.K.; Al-Hajri, S.; Traverse, A. (1996). "New evidence for land plants from the lower Middle Ordovician of Saudi Arabia". Geology. 24 (1): 55–59. Bibcode:1996Geo....24...55S. doi:10.1130/0091-7613(1996)024<0055:NEFLPF>2.3.CO;2.
- ^ Rubinstein, C. V.; Gerrienne, P.; de la Puente, G. S.; Astini, R. A.; Steemans, P. (2010). "Early Middle Ordovician evidence for land plants in Argentina (eastern Gondwana)". New Phytologist. 188 (2): 365–369. doi:10.1111/j.1469-8137.2010.03433.x. hdl:11336/55341. PMID 20731783.
- ^ Wellman, Charles H.; Osterloff, Peter L.; Mohiuddin, Uzma (2003). "Fragments of the earliest land plants" (PDF). Nature. 425 (6955): 282–285. Bibcode:2003Natur.425..282W. doi:10.1038/nature01884. PMID 13679913. S2CID 4383813.
- ^ Steemans, P.; Lepota K.; Marshallb, C.P.; Le Hérisséc, A.; Javauxa, E.J. (2010). "FTIR characterisation of the chemical composition of Silurian miospores (cryptospores and trilete spores) from Gotland, Sweden". Review of Palaeobotany and Palynology. 162 (4): 577–590. Bibcode:2010RPaPa.162..577S. doi:10.1016/j.revpalbo.2010.07.006. S2CID 128900940.
- ^ Steemans, P.; Herisse, L.; Melvin, J.; Miller, A.; Paris, F.; Verniers, J.; Wellman, H. (Apr 2009). "Origin and Radiation of the Earliest Vascular Land Plants". Science. 324 (5925): 353. Bibcode:2009Sci...324..353S. doi:10.1126/science.1169659. hdl:1854/LU-697223. ISSN 0036-8075. PMID 19372423. S2CID 206518080.
- ^ Rubinstein, Claudia; Vajda, Vivi (2019). "Baltica cradle of early land plants? Oldest record of trilete spores and diverse cryptospore assemblages; evidence from Ordovician successions of Sweden". GFF (Journal of the Geological Society of Sweden). 141 (3): 181–190. Bibcode:2019GFF...141..181R. doi:10.1080/11035897.2019.1636860. hdl:11336/124409.
- ^ a b c Gray, J.; Chaloner, W. G.; Westoll, T. S. (1985). "The Microfossil Record of Early Land Plants: Advances in Understanding of Early Terrestrialization, 1970–1984". Philosophical Transactions of the Royal Society B. 309 (1138): 167–195. Bibcode:1985RSPTB.309..167G. doi:10.1098/rstb.1985.0077. JSTOR 2396358.
- ^ Tomescu, A. M. F. (2006). "Wetlands before tracheophytes: Thalloid terrestrial communities of the Early Silurian Passage Creek biota (Virginia)" (PDF). doi:10.1130/2006.2399(02). ISBN 9780813723990. Retrieved 2014-05-28.
{{cite book}}:|journal=ignored (help); Missing or empty|title=(help) - ^ Tomescu, A. M. F.; Honegger, R.; Rothwell, G. W. (2008). "Earliest fossil record of bacterial–cyanobacterial mat consortia: the early Silurian Passage Creek biota (440 Ma, Virginia, USA)". Geobiology. 6 (2): 120–124. Bibcode:2008Gbio....6..120T. doi:10.1111/j.1472-4669.2007.00143.x. PMID 18380874. S2CID 10555223.
- ^ "First Land Plants and Fungi Changed Earth's Climate, Paving the Way for Explosive Evolution of Land Animals, New Gene Study Suggest". science.psu.edu. Archived from the original on 15 December 2019. Retrieved 9 April 2018.
- ^ Žárský, J.; Žárský, V.; Hanáček, M.; Žárský, V. (2022-01-27). "Cryogenian Glacial Habitats as a Plant Terrestrialisation Cradle – The Origin of the Anydrophytes and Zygnematophyceae Split". Frontiers in Plant Science. 12. Frontiers: 735020. doi:10.3389/fpls.2021.735020. ISSN 1664-462X. PMC 8829067. PMID 35154170.
- ^ Kump, Leo R. (2008-01-16). "The rise of atmospheric oxygen". Nature. 451 (7176): 277–278. Bibcode:2008Natur.451..277K. doi:10.1038/nature06587. PMID 18202642. S2CID 5505876.
- ^ Glasspool, I.J.; Edwards, D.; Axe, L. (2004). "Charcoal in the Silurian as evidence for the earliest wildfire". Geology. 32 (5): 381–383. Bibcode:2004Geo....32..381G. doi:10.1130/G20363.1.
- ^ McMahon, William J.; Davies, Neil S. (2018-03-02). "Evolution of alluvial mudrock forced by early land plants". Science. 359 (6379): 1022–1024. doi:10.1126/science.aan4660. ISSN 0036-8075.
- ^ Bernstein, H.; Byers, G.S.; Michod, R.E. (1981). "Evolution of sexual reproduction: Importance of DNA repair, complementation, and variation". The American Naturalist. 117 (4): 537–549. doi:10.1086/283734. S2CID 84568130.
- ^ Michod, R.E.; Gayley, T.W. (1992). "Masking of mutations and the evolution of sex". The American Naturalist. 139 (4): 706–734. doi:10.1086/285354. S2CID 85407883.
- ^ Szövényi, Péter; Ricca, Mariana; Hock, Zsófia; Shaw, Jonathan A.; Shimizu, Kentaro K.; Wagner, Andreas (2013). "Selection is no more efficient in haploid than in diploid life stages of an angiosperm and a moss". Molecular Biology and Evolution. 30 (8): 1929–39. doi:10.1093/molbev/mst095. PMID 23686659.
- ^ a b c d Boyce, C. K. (2008). "How green was Cooksonia? The importance of size in understanding the early evolution of physiology in the vascular plant lineage". Paleobiology. 34 (2): 179–194. doi:10.1666/0094-8373(2008)034[0179:HGWCTI]2.0.CO;2. S2CID 36688488.
- ^ Kerp, H.; Trewin, N.H.; Hass, H. (2004). "New gametophytes from the Early Devonian Rhynie chert". Transactions of the Royal Society of Edinburgh. 94 (4): 411–428. doi:10.1017/s026359330000078x. S2CID 128629425.
- ^ Taylor, T.N.; Kerp, H.; Hass, H. (2005). "Life history biology of early land plants: deciphering the gametophyte phase". Proceedings of the National Academy of Sciences of the United States of America. 102 (16): 5892–5897. Bibcode:2005PNAS..102.5892T. doi:10.1073/pnas.0501985102. PMC 556298. PMID 15809414.
- ^ Holloway, John E. (1939). "The gametophyte, embryo, and young rhizome of Psilotum triquetrum (Swartz)". Annals of Botany. 3 (2): 313–336. doi:10.1093/oxfordjournals.aob.a085063.
- ^ Kidston, R. & Lang, W.H. (1920), "On Old Red Sandstone plants showing structure, from the Rhynie Chert Bed, Aberdeenshire. Part II. Additional notes on Rhynia gwynne-vaughani, Kidston and Lang; with descriptions of Rhynia major, n.sp. and Hornea lignieri, n.g., n.sp", Transactions of the Royal Society of Edinburgh, 52 (3): 603–627, doi:10.1017/s0080456800004488, S2CID 130329822
- ^ Remy, W.; Taylor, T.N.; Hass, H.; Kerp, H. (1994). "4 hundred million year old vesicular-arbuscular mycorrhizae". Proceedings of the National Academy of Sciences of the United States of America. 91 (25): 11841–11843. Bibcode:1994PNAS...9111841R. doi:10.1073/pnas.91.25.11841. PMC 45331. PMID 11607500.
- ^ Bonfante, Paola; Genre, Andrea (September 2008). "Plants and arbuscular mycorrhizal fungi: an evolutionary-developmental perspective". Trends in Plant Science. 13 (9): 492–498. Bibcode:2008TPS....13..492B. doi:10.1016/j.tplants.2008.07.001. ISSN 1360-1385. PMID 18701339.
- ^ Schüßler, A.; et al. (2001). "A new fungal phylum, the Glomeromycota: phylogeny and evolution". Mycol. Res. 105 (12): 1416. doi:10.1017/S0953756201005196.
- ^ a b Smith, Sally E.; Read, David J. (2008). Mycorrhizal symbiosis (3 ed.). Academic Press. ISBN 9780123705266.
- ^ Simon, L.; Bousquet, J.; Lévesque, R.C.; Lalonde, M. (1993). "Origin and diversification of endomycorrhizal fungi and coincidence with vascular land plants". Nature. 363 (6424): 67–69. Bibcode:1993Natur.363...67S. doi:10.1038/363067a0. S2CID 4319766.
- ^ Simon, L.; Bousquet, J.; Lévesque, R. C.; Lalonde, M. (1993). "Origin and diversification of endomycorrhizal fungi and coincidence with vascular land plants". Nature. 363 (6424): 67–69. Bibcode:1993Natur.363...67S. doi:10.1038/363067a0. S2CID 4319766.
- ^ Humphreys, C. P.; Franks, P. J.; Rees, M.; Bidartondo, M. I.; Leake, J. R.; Beerling, D. J. (2010). "Mutualistic mycorrhiza-like symbiosis in the most ancient group of land plants". Nature Communications. 1 (8): 103. Bibcode:2010NatCo...1..103H. doi:10.1038/ncomms1105. PMID 21045821.
- ^ Brundrett, M. C. (2002). "Coevolution of roots and mycorrhizas of land plants". New Phytologist. 154 (2): 275–304. doi:10.1046/j.1469-8137.2002.00397.x. PMID 33873429.
- ^ a b c d e f g h i j k l m n o p q r Sperry, J. S. (2003). "Evolution of Water Transport and Xylem Structure". International Journal of Plant Sciences. 164 (3): S115 – S127. doi:10.1086/368398. JSTOR 3691719. S2CID 15314720.
- ^ a b c d Raven, John (1977). "The evolution of vascular land plants in relation to supracellular transport processes". Advances in Botanical Research. 1977: 153–219. doi:10.1016/S0065-2296(08)60361-4. ISBN 9780120059058.
- ^ Qiu, Y.L.; Li, L.; Wang, B.; Chen, Z.; Knoop, V.; Groth-malonek, M.; Dombrovska, O.; Lee, J.; Kent, L.; Rest, J.; et al. (2006). "The deepest divergences in land plants inferred from phylogenomic evidence". Proceedings of the National Academy of Sciences. 103 (42): 15511–6. Bibcode:2006PNAS..10315511Q. doi:10.1073/pnas.0603335103. PMC 1622854. PMID 17030812.
- ^ Edwards, D.; Davies, K.L.; Axe, L. (1992). "A vascular conducting strand in the early land plant Cooksonia". Nature. 357 (6380): 683–685. Bibcode:1992Natur.357..683E. doi:10.1038/357683a0. S2CID 4264332.
- ^ Niklas, K. J.; Smocovitis, V. (1983). "Evidence for a Conducting Strand in Early Silurian (Llandoverian) Plants: Implications for the Evolution of the Land Plants". Paleobiology. 9 (2): 126–137. Bibcode:1983Pbio....9..126N. doi:10.1017/S009483730000751X. JSTOR 2400461. S2CID 35550235.
- ^ a b c d e Niklas, K. J. (1985). "The Evolution of Tracheid Diameter in Early Vascular Plants and Its Implications on the Hydraulic Conductance of the Primary Xylem Strand". Evolution. 39 (5): 1110–1122. doi:10.2307/2408738. JSTOR 2408738. PMID 28561493.
- ^ Niklas, K.; Pratt, L. (1980). "Evidence for lignin-like constituents in Early Silurian (Llandoverian) plant fossils". Science. 209 (4454): 396–397. Bibcode:1980Sci...209..396N. doi:10.1126/science.209.4454.396. PMID 17747811. S2CID 46073056.
- ^ Pittermann J.; Sperry J.S.; Hacke U.G.; Wheeler J.K.; Sikkema E.H. (December 2005). "Torus-Margo Pits Help Conifers Compete with Angiosperms". Science Magazine. 310 (5756): 1924. doi:10.1126/science.1120479. PMID 16373568. S2CID 28339481.
- ^ Why Christmas trees are not extinct
- ^ a b Kenrick, Paul (2001). "Turning over a new leaf". Nature. 410 (6826): 309–310. Bibcode:2001Natur.410..309K. doi:10.1038/35066649. PMID 11268183. S2CID 4335355.
- ^ a b c Beerling D.; Osborne, C. P.; Chaloner, W. G. (2001). "Evolution of leaf-form in land plants linked to atmospheric CO2 decline in the Late Palaeozoic era" (PDF). Nature. 410 (6826): 352–354. Bibcode:2001Natur.410..352B. doi:10.1038/35066546. PMID 11268207. S2CID 4386118.
- ^ Crane, P.R.; Kenrick, P. (1997). "Diverted development of reproductive organs: A source of morphological innovation in land plants". Plant Systematics and Evolution. 206 (1): 161–174. Bibcode:1997PSyEv.206..161C. doi:10.1007/BF00987946. S2CID 23626358.
- ^ Zimmermann, W. (1959). Die Phylogenie der Pflanzen (2 ed.). Stuttgart: Gustav Fischer Verlag.
- ^ Piazza, P.; et al. (2005). "Evolution of leaf developmental mechanisms". New Phytologist. 167 (3): 693–710. doi:10.1111/j.1469-8137.2005.01466.x. PMID 16101907.
- ^ Hagemann, W. 1976. Sind Farne Kormophyten? Eine Alternative zur Telomtheorie. Plant Systematics and Evolution 124: 251–277.
- ^ Hagemann, W. (1999). "Towards an organismic concept of land plants: the marginal blastozone and the development of the vegetation body of selected frondose gametophytes of liverworts and ferns". Plant Systematics and Evolution. 216 (1–2): 81–133. Bibcode:1999PSyEv.216...81H. doi:10.1007/bf00985102. S2CID 21483458.
- ^ Sattler, R. (1992). "Process morphology: structural dynamics in development and evolution". Canadian Journal of Botany. 70 (4): 708–714. doi:10.1139/b92-091.
- ^ Sattler, R. 1998. On the origin of symmetry, branching and phyllotaxis in land plants. In: R.V. Jean and D. Barabé (eds) Symmetry in Plants. World Scientific, Singapore, pp. 775-793.
- ^ James, P.J. (2009). "'Tree and Leaf': A different angle". The Linnean. 25: 17.
- ^ "A perspective on the CO2 theory of early leaf evolution". Archived from the original on 2011-06-29. Retrieved 2011-03-08.
- ^ Kotyk, M.E.; Basinger, J.F.; Gensel, P.G.; de Freitas, T.A. (2002). "Morphologically complex plant macrofossils from the late Silurian of arctic Canada". American Journal of Botany. 89 (6): 1004–1013. doi:10.3732/ajb.89.6.1004. PMID 21665700.
- ^ Rickards, R.B. (2000). "The age of the earliest club mosses: the Silurian Baragwanathia flora in Victoria, Australia" (abstract). Geological Magazine. 137 (2): 207–209. Bibcode:2000GeoM..137..207R. doi:10.1017/S0016756800003800. S2CID 131287538. Retrieved 2007-10-25.
- ^ a b c d e Kaplan, D.R. (2001). "The Science of Plant Morphology: Definition, History, and Role in Modern Biology". American Journal of Botany. 88 (10): 1711–1741. doi:10.2307/3558347. JSTOR 3558347. PMID 21669604.
- ^ Taylor, T.N.; Hass, H.; Kerp, H.; Krings, M.; Hanlin, R.T. (2005). "Perithecial ascomycetes from the 400 million year old Rhynie chert: an example of ancestral polymorphism". Mycologia. 97 (1): 269–285. doi:10.3852/mycologia.97.1.269. hdl:1808/16786. PMID 16389979.
- ^ a b c Boyce, C.K.; Knoll, A.H. (2002). "Evolution of developmental potential and the multiple independent origins of leaves in Paleozoic vascular plants". Paleobiology. 28 (1): 70–100. Bibcode:2002Pbio...28...70B. doi:10.1666/0094-8373(2002)028<0070:EODPAT>2.0.CO;2. S2CID 1650492.
- ^ Hao, S.; Beck, C.B.; Deming, W. (2003). "Structure of the Earliest Leaves: Adaptations to High Concentrations of Atmospheric CO2". International Journal of Plant Sciences. 164 (1): 71–75. doi:10.1086/344557. S2CID 84741832.
- ^ Berner, R.A.; Kothavala, Z. (2001). "Geocarb III: A Revised Model of Atmospheric CO2 over Phanerozoic Time". American Journal of Science. 301 (2): 182–204. Bibcode:2001AmJS..301..182B. CiteSeerX 10.1.1.393.582. doi:10.2475/ajs.301.2.182. Archived from the original (abstract) on 2009-01-29. Retrieved 2008-04-07.
- ^ Shellito, C.J.; Sloan, L.C. (2006). "Reconstructing a lost Eocene paradise: Part I. Simulating the change in global floral distribution at the initial Eocene thermal maximum". Global and Planetary Change. 50 (1–2): 1–17. Bibcode:2006GPC....50....1S. doi:10.1016/j.gloplacha.2005.08.001.
- ^ Aerts, R. (1995). "The advantages of being evergreen". Trends in Ecology & Evolution. 10 (10): 402–407. Bibcode:1995TEcoE..10..402A. doi:10.1016/S0169-5347(00)89156-9. PMID 21237084.
- ^ Labandeira, C.C.; Dilcher, D.L.; Davis, D.R.; Wagner, D.L. (1994). "Ninety-seven million years of angiosperm-insect association: paleobiological insights into the meaning of coevolution". PNAS. 91 (25): 12278–12282. Bibcode:1994PNAS...9112278L. doi:10.1073/pnas.91.25.12278. PMC 45420. PMID 11607501.
- ^ de Souza, Rocheli; Ambrosini, Adriana; Passaglia, Luciane M.P. (December 2015). "Plant growth-promoting bacteria as inoculants in agricultural soils". Genetics and Molecular Biology. 38 (4): 401–19. doi:10.1590/S1415-475738420150053. PMC 4763327. PMID 26537605.
- ^ Mora, C.I.; Driese, S.G.; Colarusso, L.A. (1996). "Middle to Late Paleozoic Atmospheric CO2 Levels from Soil Carbonate and Organic Matter". Science. 271 (5252): 1105–1107. Bibcode:1996Sci...271.1105M. doi:10.1126/science.271.5252.1105. S2CID 128479221.
- ^ Berner, R.A. (1994). "GEOCARB II: A revised model of atmospheric CO2 over Phanerozoic time". Am. J. Sci. 294 (1): 56–91. Bibcode:1994AmJS..294...56B. doi:10.2475/ajs.294.1.56.
- ^ a b Algeo, T.J.; Berner, R.A.; Maynard, J.B.; Scheckler, S.E.; GSA Today Archives (1995). "Late Devonian Oceanic Anoxic Events and Biotic Crises: "Rooted" in the Evolution of Vascular Land Plants?". GSA Today. 5 (3). Archived from the original on 2015-05-01. Retrieved 2019-08-29.
- ^ Retallack, G. J. (1986). Wright, V. P. (ed.). Paleosols: their Recognition and Interpretation. Oxford: Blackwell.
- ^ "Tracheophyta - 2". Paleos - Life Through Deep Time.
- ^ Richard M. Bateman, Peter R. Crane, William A. DiMichele, Paul R. Kenrick, Nick P. Rowe, Thomas Speck, and William E. Stein (1998). "EARLY EVOLUTION OF LAND PLANTS: Phylogeny, Physiology, and Ecology of the Primary Terrestrial Radiation". Annual Review of Ecology and Systematics. 29: 263–292. doi:10.1146/annurev.ecolsys.29.1.263. S2CID 44508826.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Hetherington, Alexander J; Dolan, Liam (2017). "Bilaterally symmetric axes with rhizoids composed the rooting structure of the common ancestor of vascular plants". Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1739): 20170042. doi:10.1098/rstb.2017.0042. PMC 5745339. PMID 29254968.
- ^ a b c d e f g h i Algeo, T.J.; Scheckler, S.E. (1998). "Terrestrial-marine teleconnections in the Devonian: links between the evolution of land plants, weathering processes, and marine anoxic events". Philosophical Transactions of the Royal Society B. 353 (1365): 113–130. doi:10.1098/rstb.1998.0195. PMC 1692181.
- ^ Hetherington, Alexander J.; Dolan, Liam (2018). "Stepwise and independent origins of roots among land plants". Nature. 561 (7722): 235–238. Bibcode:2018Natur.561..235H. doi:10.1038/s41586-018-0445-z. PMC 6175059. PMID 30135586.
- ^ Coudert, Yoan; Anne Dievart; Gaetan Droc; Pascal Gantet (2012). "ASL/LBD Phylogeny Suggests that Genetic Mechanisms of Root Initiation Downstream of Auxin Are Distinct in Lycophytes and Euphyllophytes". Molecular Biology and Evolution. 30 (3): 569–72. doi:10.1093/molbev/mss250. ISSN 0737-4038. PMID 23112232.
- ^ a b Kenrick, P.; Crane, P.R. (1997). "The origin and early evolution of plants on land". Nature. 389 (6646): 33–39. Bibcode:1997Natur.389...33K. doi:10.1038/37918. S2CID 3866183.
- ^ Gerrienne, Philippe; Gensel, Patricia G.; Strullu-Derrien, Christine; Lardeux, Hubert; Steemans, Philippe; Prestianni, Cyrille (2011). "A simple type of wood in two early Devonian plants". Science. 333 (6044): 837. Bibcode:2011Sci...333..837G. doi:10.1126/science.1208882. hdl:2268/97121. PMID 21836008. S2CID 23513139.
- ^ Kinver, Mark (16 August 2011). "'Early wood' samples reshape plant history". BBC News.
- ^ Stein, W.E.; Mannolini, F.; Hernick, L.V.; Landing, E.; Berry, C.M. (2007). "Giant cladoxylopsid trees resolve the enigma of the Earth's earliest forest stumps at Gilboa". Nature. 446 (7138): 904–907. Bibcode:2007Natur.446..904S. doi:10.1038/nature05705. PMID 17443185. S2CID 2575688.
- ^ Retallack, G.J.; Catt, J.A.; Chaloner, W.G. (1985). "Fossil Soils as Grounds for Interpreting the Advent of Large Plants and Animals on Land [and Discussion]". Philosophical Transactions of the Royal Society B. 309 (1138): 105–142. Bibcode:1985RSPTB.309..105R. doi:10.1098/rstb.1985.0074. JSTOR 2396355.
- ^ Dannenhoffer, J.M.; Bonamo, P.M. (1989). "Rellimia thomsonii from the Givetian of New York: Secondary Growth in Three Orders of Branching". American Journal of Botany. 76 (9): 1312–1325. doi:10.2307/2444557. JSTOR 2444557.
- ^ Davis, P; Kenrick, P. (2004). Fossil Plants. Smithsonian Books, Washington D.C. ISBN 978-1-58834-156-3.
- ^ Donoghue, M.J. (2005). "Key innovations, convergence, and success: macroevolutionary lessons from plant phylogeny". Paleobiology. 31 (2): 77–93. doi:10.1666/0094-8373(2005)031[0077:KICASM]2.0.CO;2. S2CID 36988476.
- ^ a b c Bowe, L.M.; Coat, G.; Depamphilis, C.W. (2000). "Phylogeny of seed plants based on all three genomic compartments: Extant gymnosperms are monophyletic and Gnetales' closest relatives are conifers". Proceedings of the National Academy of Sciences. 97 (8): 4092–4097. Bibcode:2000PNAS...97.4092B. doi:10.1073/pnas.97.8.4092. PMC 18159. PMID 10760278.
- ^ a b c Chaw, S.M.; Parkinson, C.L.; Cheng, Y.; Vincent, T.M.; Palmer, J.D. (2000). "Seed plant phylogeny inferred from all three plant genomes: Monophyly of extant gymnosperms and origin of Gnetales from conifers". Proceedings of the National Academy of Sciences. 97 (8): 4086–91. Bibcode:2000PNAS...97.4086C. doi:10.1073/pnas.97.8.4086. PMC 18157. PMID 10760277.
- ^ a b c Soltis, D.E.; Soltis, P.S.; Zanis, M.J. (2002). "Phylogeny of seed plants based on evidence from eight genes". American Journal of Botany. 89 (10): 1670–81. doi:10.3732/ajb.89.10.1670. PMID 21665594.
- ^ Friis, E.M.; Pedersen, K.R.; Crane, P.R. (2006). "Cretaceous angiosperm flowers: Innovation and evolution in plant reproduction". Palaeogeography, Palaeoclimatology, Palaeoecology. 232 (2–4): 251–293. Bibcode:2006PPP...232..251F. doi:10.1016/j.palaeo.2005.07.006.
- ^ a b Hilton, J.; Bateman, R.M. (2006). "Pteridosperms are the backbone of seed-plant phylogeny". The Journal of the Torrey Botanical Society. 133 (1): 119–168. doi:10.3159/1095-5674(2006)133[119:PATBOS]2.0.CO;2. S2CID 86395036.
- ^ a b Bateman, R.M.; Hilton, J.; Rudall, P.J. (2006). "Morphological and molecular phylogenetic context of the angiosperms: contrasting the 'top-down' and 'bottom-up' approaches used to infer the likely characteristics of the first flowers". Journal of Experimental Botany. 57 (13): 3471–503. doi:10.1093/jxb/erl128. PMID 17056677.
- ^ a b c d Frohlich, M.W.; Chase, M.W. (2007). "After a dozen years of progress the origin of angiosperms is still a great mystery". Nature. 450 (7173): 1184–1189. Bibcode:2007Natur.450.1184F. doi:10.1038/nature06393. PMID 18097399. S2CID 4373983.
- ^ Magallón, Susana; Castillo, Amanda (2009-01-01). "Angiosperm diversification through time". American Journal of Botany. 96 (1): 349–365. doi:10.3732/ajb.0800060. PMID 21628193. Retrieved 2021-04-27.
- ^ Gerrienne, P.; Meyer-Berthaud, B.; Fairon-Demaret, M.; Streel, M.; Steemans, P. (2011). "Science Magazine". Runcaria, A Middle Devonian Seed Plant Precursor. 306 (5697). American Association for the Advancement of Science: 856–858. doi:10.1126/science.1102491. PMID 15514154. S2CID 34269432.
- ^ Wang, Deming; Liu, Le; Guo, Yun; Xue, Jinzhuang; Meng, Meicen (2015). "A Late Devonian Fertile Organ with Seed Plant Affinities from China". Scientific Reports. 5: 10736. Bibcode:2015NatSR...510736W. doi:10.1038/srep10736. PMC 4448223. PMID 26022973.
- ^ a b c Mapes, G.; Rothwell, G.W.; Haworth, M.T. (1989). "Evolution of seed dormancy". Nature. 337 (6208): 645–646. Bibcode:1989Natur.337..645M. doi:10.1038/337645a0. S2CID 4358761.
- ^ Bawa, K.S.; Webb, C.J. (1984). "Flower, fruit and seed abortion in tropical forest trees. Implications for the evolution of paternal and maternal reproductive patterns". American Journal of Botany. 71 (5): 736–751. doi:10.2307/2443371. JSTOR 2443371.
- ^ Cheah, K.S.; Osborne, D.J. (April 1978). "DNA lesions occur with loss of viability in embryos of ageing rye seed". Nature. 272 (5654): 593–599. Bibcode:1978Natur.272..593C. doi:10.1038/272593a0. PMID 19213149. S2CID 4208828.
- ^ Koppen, G.; Verschaeve, L. (2001). "The alkaline single-cell gel electrophoresis/comet assay: a way to study DNA repair in radicle cells of germinating Vicia faba". Folia Biol. (Praha). 47 (2): 50–54. PMID 11321247.
- ^ Bray, C.M.; West, C.E. (December 2005). "DNA repair mechanisms in plants: crucial sensors and effectors for the maintenance of genome integrity". New Phytologist. 168 (3): 511–28. doi:10.1111/j.1469-8137.2005.01548.x. PMID 16313635.
- ^ Bernstein C, Bernstein H. (1991) Aging, Sex, and DNA Repair. Academic Press, San Diego. ISBN 0120928604 ISBN 978-0120928606
- ^ Feild, T. S.; Brodribb, T. J.; Iglesias, A.; Chatelet, D. S.; Baresch, A.; Upchurch, G. R.; Gomez, B.; Mohr, B. A. R.; Coiffard, C.; Kvacek, J.; Jaramillo, C. (2011). "Fossil evidence for Cretaceous escalation in angiosperm leaf vein evolution". Proceedings of the National Academy of Sciences. 108 (20): 8363–8366. Bibcode:2011PNAS..108.8363F. doi:10.1073/pnas.1014456108. PMC 3100944. PMID 21536892.
- ^ a b Lawton-Rauh, A.; Alvarez-Buylla, E.R.; Purugganan, M.D. (2000). "Molecular evolution of flower development". Trends in Ecology and Evolution. 15 (4): 144–149. doi:10.1016/S0169-5347(99)01816-9. PMID 10717683.
- ^ Chinese Academy of Sciences (18 December 2018). "Flowers originated 50 million years earlier than previously thought". EurekAlert!. Retrieved 18 December 2018.
- ^ Coiro, Mario; Doyle, James A.; Hilton, Jason (2019-01-25). "How deep is the conflict between molecular and fossil evidence on the age of angiosperms?". New Phytologist. 223 (1): 83–99. doi:10.1111/nph.15708. PMID 30681148.
- ^ Nam, J.; Depamphilis, CW; Ma, H; Nei, M (2003). "Antiquity and Evolution of the MADS-Box Gene Family Controlling Flower Development in Plants". Mol. Biol. Evol. 20 (9): 1435–1447. doi:10.1093/molbev/msg152. PMID 12777513.
- ^ a b Cite error: The named reference
Crepet-2000was invoked but never defined (see the help page). - ^ Sun, G.; Ji, Q.; Dilcher, D.L.; Zheng, S.; Nixon, K.C.; Wang, X. (2002). "Archaefructaceae, a New Basal Angiosperm Family". Science. 296 (5569): 899–904. Bibcode:2002Sci...296..899S. doi:10.1126/science.1069439. PMID 11988572. S2CID 1910388.
- ^ In fact, Archaefructus probably didn't bear true flowers: see Friis, E.M.; Doyle, J.A.; Endress, P.K.; Leng, Q. (2003). "Archaefructus—angiosperm precursor or specialized early angiosperm?". Trends in Plant Science. 8 (8): 369–373. doi:10.1016/S1360-1385(03)00161-4. PMID 12927969.
- ^ a b Wing, S.L.; Boucher, L.D. (1998). "Ecological Aspects Of The Cretaceous Flowering Plant Radiation". Annual Review of Earth and Planetary Sciences. 26 (1): 379–421. Bibcode:1998AREPS..26..379W. doi:10.1146/annurev.earth.26.1.379.
- ^ a b Feild, T.S.; Arens, N.C.; Doyle, J.A.; Dawson, T.E.; Donoghue, M.J. (2004). "Dark and disturbed: a new image of early angiosperm ecology". Paleobiology. 30 (1): 82–107. Bibcode:2004Pbio...30...82F. doi:10.1666/0094-8373(2004)030<0082:DADANI>2.0.CO;2. S2CID 42855952.
- ^ Crepet, W. L. (2000). "Progress in understanding angiosperm history, success, and relationships: Darwin's abominably "perplexing phenomenon"". Proceedings of the National Academy of Sciences. 97 (24): 12939–41. Bibcode:2000PNAS...9712939C. doi:10.1073/pnas.97.24.12939. PMC 34068. PMID 11087846.
- ^ Gabbott, Prof Sarah (1 August 2017). "Did the first flower look like this?". BBC News. Retrieved 1 August 2017.
- ^ Sauquet, Hervé; et al. (1 August 2017). "The ancestral flower of angiosperms and its early diversification". Nature Communications. 8: 16047. Bibcode:2017NatCo...816047S. doi:10.1038/ncomms16047. PMC 5543309. PMID 28763051.
- ^ Amborella Genome Project (20 Dec 2013). "The Amborella Genome and the Evolution of Flowering Plants". Science. 342 (6165): 1241089. doi:10.1126/science.1241089. PMID 24357323. S2CID 202600898. Retrieved 1 February 2020.
- ^ Zuccolo, A.; Bowers, John E; Estill, James C; et al. (2011). "A physical map for the Amborella trichopoda genome sheds light on the evolution of angiosperm genome structure". Genome Biology. 12 (5): R48. doi:10.1186/gb-2011-12-5-r48. PMC 3219971. PMID 21619600.
- ^ a b Bernstein H, Byerly HC, Hopf FA, Michod RE. Genetic damage, mutation, and the evolution of sex. Science. 1985 Sep 20;229(4719):1277–81. doi: 10.1126/science.3898363. PMID 3898363
- ^ Hörandl E. Apomixis and the paradox of sex in plants. Ann Bot. 2024 Mar 18:mcae044. doi: 10.1093/aob/mcae044. Epub ahead of print. PMID 38497809
- ^ Medarg, N. G.; Yanofsky, M. (March 2001). "Function and evolution of the plant MADS-box gene family". Nature Reviews Genetics. 2 (3): 186–195. doi:10.1038/35056041. PMID 11256070. S2CID 7399106.
- ^ Jager, Muriel; Hassanin, Alexandre; Manuel, Michael; et al. (2003). "MADS-Box Genes in Ginkgo biloba and the Evolution of the AGAMOUS Family". Molecular Biology and Evolution. 20 (5): 842–854. doi:10.1093/molbev/msg089. PMID 12679535.
- ^ Translational Biology: From Arabidopsis Flowers to Grass Inflorescence Architecture. Beth E. Thompson* and Sarah Hake, 2009, Plant Physiology 149:38–45.
- ^ Kitahara, K.; Matsumoto, S. (2000). "Rose MADS-box genes 'MASAKO C1 and D1' homologous to class C floral identity genes". Plant Science. 151 (2): 121–134. Bibcode:2000PlnSc.151..121K. doi:10.1016/S0168-9452(99)00206-X. PMID 10808068.
- ^ Kater, M.; et al. (1998). "Multiple AGAMOUS Homologs from Cucumber and Petunia Differ in Their Ability to Induce Reproductive Organ Fate". Plant Cell. 10 (2): 171–182. doi:10.1105/tpc.10.2.171. PMC 143982. PMID 9490741.
- ^ Soltis, D.; et al. (2007). "The floral genome: an evolutionary history of gene duplication and shifting patterns of gene expression". Trends Plant Sci. 12 (8): 358–367. Bibcode:2007TPS....12..358S. doi:10.1016/j.tplants.2007.06.012. PMID 17658290.
- ^ Putterhill, Jo; Laurie, Rebecca; MacKnight, Richard (2004). "It's time to flower: the genetic control of flowering time". BioEssays. 26 (4): 353–363. doi:10.1002/bies.20021. PMID 15057934. S2CID 43335309. Archived from the original on 2012-12-16.
- ^ Blazquez; et al. (2001). "Flowering on time: genes that regulate the floral transition". EMBO Reports. 2 (12): 1078–1082. doi:10.1093/embo-reports/kve254. PMC 1084172. PMID 11743019.
- ^ Frohlich, Michael W.; Parker, David S. (2000). "The Mostly Male Theory of Flower Evolutionary Origins: from Genes to Fossils". Syst. Bot. 25 (2): 155–170. doi:10.2307/2666635. JSTOR 2666635. S2CID 85612923.
- ^ Li A, Mao L (2007). "Evolution of plant microRNA gene families". Cell Research. 17 (3): 212–218. doi:10.1038/sj.cr.7310113. PMID 17130846.
- ^ Doebley J.F. (2004). "The genetics of maize evolution". Annu. Rev. Genet. 38 (1): 37–59. doi:10.1146/annurev.genet.38.072902.092425. PMID 15568971.
- ^ Purugannan; et al. (2000). "Variation and Selection at the CAULIFLOWER Floral Homeotic Gene Accompanying the Evolution of Domesticated Brassica olerace". Genetics. 155 (2): 855–862. doi:10.1093/genetics/155.2.855. PMC 1461124. PMID 10835404.
- ^ a b Williams, Ben P.; Johnston, Iain G.; Covshoff, Sarah; Hibberd, Julian M. (2013-09-28). "Phenotypic landscape inference reveals multiple evolutionary paths to C4 photosynthesis". eLife. 2. eLife Sciences Publications: e00961. doi:10.7554/elife.00961. PMC 3786385. PMID 24082995. S2CID 6552541.
- ^ Robison, T. A., Oh, Z. G., Lafferty, D., Xu, X., Villarreal, J. C. A., Gunn, L. H., Li, F.-W. (3 January 2025). "Hornworts reveal a spatial model for pyrenoid-based CO2-concentrating mechanisms in land plants". Nature Plants. Nature Publishing Group: 1–11. doi:10.1038/s41477-024-01871-0. ISSN 2055-0278.
- ^ Christin, P.-A.; Osborne, C. P.; Chatelet, D. S.; Columbus, J. T.; Besnard, G.; Hodkinson, T. R.; Garrison, L. M.; Vorontsova, M. S.; Edwards, E. J. (2012). "Anatomical enablers and the evolution of C4 photosynthesis in grasses". Proceedings of the National Academy of Sciences. 110 (4): 1381–1386. Bibcode:2013PNAS..110.1381C. doi:10.1073/pnas.1216777110. PMC 3557070. PMID 23267116.
- ^ a b c d Osborne, C.P.; Beerling, D.J. (2006). "Review. Nature's green revolution: the remarkable evolutionary rise of C4 plants". Philosophical Transactions of the Royal Society B. 361 (1465): 173–194. doi:10.1098/rstb.2005.1737. PMC 1626541. PMID 16553316.
- ^ a b Retallack, G. J. (1 August 1997). "Neogene Expansion of the North American Prairie". PALAIOS. 12 (4): 380–390. Bibcode:1997Palai..12..380R. doi:10.2307/3515337. JSTOR 3515337.
- ^ Thomasson, J.R.; Nelson, M.E.; Zakrzewski, R.J. (1986). "A Fossil Grass (Gramineae: Chloridoideae) from the Miocene with Kranz Anatomy". Science. 233 (4766): 876–878. Bibcode:1986Sci...233..876T. doi:10.1126/science.233.4766.876. PMID 17752216. S2CID 41457488.
- ^ O'Leary, Marion (May 1988). "Carbon Isotopes in Photosynthesis". BioScience. 38 (5): 328–336. doi:10.2307/1310735. JSTOR 1310735.
- ^ Osborne, P.; Freckleton, P. (Feb 2009). "Ecological selection pressures for C4 photosynthesis in the grasses". Proceedings: Biological Sciences. 276 (1663): 1753–1760. doi:10.1098/rspb.2008.1762. PMC 2674487. PMID 19324795.
- ^ Bond, W.J.; Woodward, F.I.; Midgley, G.F. (2005). "The global distribution of ecosystems in a world without fire". New Phytologist. 165 (2): 525–538. doi:10.1111/j.1469-8137.2004.01252.x. PMID 15720663. S2CID 4954178.
- ^ Above 35% atmospheric oxygen, the spread of fire is unstoppable. Many models have predicted higher values and had to be revised, because there was not a total extinction of plant life.
- ^ Pagani, M.; Zachos, J.C.; Freeman, K.H.; Tipple, B.; Bohaty, S. (2005). "Marked Decline in Atmospheric Carbon Dioxide Concentrations During the Paleogene". Science. 309 (5734): 600–603. Bibcode:2005Sci...309..600P. doi:10.1126/science.1110063. PMID 15961630. S2CID 20277445.
- ^ Piperno, D.R.; Sues, H.D. (2005). "Dinosaurs Dined on Grass". Science. 310 (5751): 1126–1128. doi:10.1126/science.1121020. PMID 16293745. S2CID 83493897.
- ^ Prasad, V.; Stroemberg, C.A.E.; Alimohammadian, H.; Sahni, A. (2005). "Dinosaur Coprolites and the Early Evolution of Grasses and Grazers". Science. 310 (5751): 1177–1180. Bibcode:2005Sci...310.1177P. doi:10.1126/science.1118806. PMID 16293759. S2CID 1816461.
- ^ Keeley, J.E.; Rundel, P.W. (2005). "Fire and the Miocene expansion of C4 grasslands". Ecology Letters. 8 (7): 683–690. Bibcode:2005EcolL...8..683K. doi:10.1111/j.1461-0248.2005.00767.x.
- ^ a b Retallack, G.J. (2001). "Cenozoic Expansion of Grasslands and Climatic Cooling". The Journal of Geology. 109 (4): 407–426. Bibcode:2001JG....109..407R. doi:10.1086/320791. S2CID 15560105.
- ^ Jin, JP; He, K; Tang, X; Li, Z; Lv, L; Zhao, Y; Luo, J; Gao, G (July 2015). "An Arabidopsis transcriptional regulatory map reveals distinct functional and evolutionary features of novel transcription factors". Molecular Biology and Evolution. 32 (7): 1767–1773. doi:10.1093/molbev/msv058. PMC 4476157. PMID 25750178.
- ^ Pichersky E.; Gang D. (2000). "Genetics and biochemistry of secondary metabolites in plants: an evolutionary perspective". Trends Plant Sci. 5 (10): 439–445. Bibcode:2000TPS.....5..439P. doi:10.1016/S1360-1385(00)01741-6. PMID 11044721.
- ^ Nina Theis; Manuel Lerdau (2003). "The evolution of function in plant secondary metabolites". Int. J. Plant Sci. 164 (S3): S93 – S102. doi:10.1086/374190. S2CID 85705162.
- ^ Bohlmann J.; et al. (1998). "Plant terpenoid synthases: molecular and phylogenetic analysis". Proc. Natl. Acad. Sci. U.S.A. 95 (8): 4126–4133. Bibcode:1998PNAS...95.4126B. doi:10.1073/pnas.95.8.4126. PMC 22453. PMID 9539701.
- ^ Hassani, M.A., Durán, P. and Hacquard, S. (2018) "Microbial interactions within the plant holobiont". Microbiome, 6(1): 58. doi:10.1186/s40168-018-0445-0.
 Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Material was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Enlaces externos
- Evolución y Paleobotany en Britannica

