Historia de la mecánica cuántica
La historia de la mecánica cuántica es una parte fundamental de la historia de la física moderna. La historia de la mecánica cuántica, al entrelazarse con la historia de la química cuántica, comenzó esencialmente con una serie de descubrimientos científicos diferentes: el descubrimiento de los rayos catódicos en 1838 por Michael Faraday; la declaración de invierno de 1859-1860 sobre el problema de la radiación del cuerpo negro de Gustav Kirchhoff; la sugerencia de 1877 de Ludwig Boltzmann de que los estados de energía de un sistema físico podrían ser discretos; el descubrimiento del efecto fotoeléctrico por Heinrich Hertz en 1887; y la hipótesis cuántica de 1900 de Max Planck de que cualquier sistema atómico que irradia energía puede dividirse teóricamente en una serie de "elementos de energía" discretos ε(letra griega épsilon) tal que cada uno de estos elementos energéticos es proporcional a la frecuencia ν con la que cada uno de ellos individualmente irradia energía, definida por la siguiente fórmula:
donde h es un valor numérico llamado constante de Planck.
Luego, Albert Einstein en 1905, con el fin de explicar el efecto fotoeléctrico informado previamente por Heinrich Hertz en 1887, postuló de manera consistente con la hipótesis cuántica de Max Planck de que la luz en sí misma está hecha de partículas cuánticas individuales, que en 1926 llegó a ser llamado fotones por Gilbert N.. Luis. El efecto fotoeléctrico se observó al brillar luz de longitudes de onda particulares en ciertos materiales, como los metales, lo que provocó que los electrones fueran expulsados de esos materiales solo si la energía cuántica de luz era mayor que la función de trabajo de la superficie del metal.
La frase "mecánica cuántica" fue acuñada (en alemán, Quantenmechanik) por un grupo de físicos que incluía a Max Born, Werner Heisenberg y Wolfgang Pauli, en la Universidad de Göttingen a principios de la década de 1920, y se utilizó por primera vez en el artículo de Born de 1924 "Zur Quantenmechanik". En los años siguientes, esta base teórica comenzó a aplicarse lentamente a la estructura química, la reactividad y los enlaces.
Predecesores y la "vieja teoría cuántica"
A principios del siglo XIX, la investigación química de John Dalton y Amedeo Avogadro dio peso a la teoría atómica de la materia, una idea que James Clerk Maxwell, Ludwig Boltzmann y otros desarrollaron para establecer la teoría cinética de los gases. Los éxitos de la teoría cinética dieron mayor credibilidad a la idea de que la materia está compuesta de átomos, pero la teoría también tenía deficiencias que solo se resolverían con el desarrollo de la mecánica cuántica. La existencia de los átomos no fue universalmente aceptada entre físicos o químicos; Ernst Mach, por ejemplo, era un antiatomista acérrimo.
Ludwig Boltzmann sugirió en 1877 que los niveles de energía de un sistema físico, como una molécula, podrían ser discretos (en lugar de continuos). La justificación de Boltzmann para la presencia de niveles discretos de energía en moléculas como las del gas yodo tuvo su origen en sus teorías de termodinámica estadística y mecánica estadística y fue respaldada por argumentos matemáticos, como también sería el caso veinte años después con la primera teoría cuántica. propuesto por Max Planck.
En 1900, el físico alemán Max Planck, que nunca había creído en los átomos discretos, introdujo a regañadientes la idea de que la energía se cuantiza para derivar una fórmula para la dependencia de frecuencia observada de la energía emitida por un cuerpo negro, llamada ley de Planck, que incluía una distribución de Boltzmann (aplicable en el límite clásico). La ley de Planck se puede expresar de la siguiente manera:
dondeI (ν, T) es la energía por unidad de tiempo (o la potencia) radiada por unidad de área de superficie emisora en la dirección normal por unidad de ángulo sólido por unidad de frecuencia por un cuerpo negro a temperatura T;h es la constante de Planck;c es la velocidad de la luz en el vacío;k es la constante de Boltzmann;ν (nu) es la frecuencia de la radiación electromagnética;T es la temperatura del cuerpo en kelvins.
La primera aproximación de Wien se puede derivar de la ley de Planck suponiendo 
En 1905, Albert Einstein utilizó la teoría cinética para explicar el movimiento browniano. El físico francés Jean Baptiste Perrin usó el modelo del artículo de Einstein para determinar experimentalmente la masa y las dimensiones de los átomos, dando así una verificación empírica directa de la teoría atómica. También en 1905, Einstein explicó el efecto fotoeléctrico al postular que la luz, o más generalmente toda la radiación electromagnética, se puede dividir en un número finito de "cuantos de energía" que son puntos localizados en el espacio. De la sección de introducción de su artículo cuántico de marzo de 1905 "Sobre un punto de vista heurístico sobre la emisión y transformación de la luz", Einstein afirma:
De acuerdo con la suposición que se contempla aquí, cuando un rayo de luz se propaga desde un punto, la energía no se distribuye continuamente en espacios cada vez mayores, sino que consiste en un número finito de "cuantos de energía" que se localizan en puntos en el espacio, moverse sin dividirse, y sólo puede ser absorbido o generado como un todo.
Esta declaración ha sido llamada la frase más revolucionaria escrita por un físico del siglo XX. Más tarde, estos cuantos de energía se denominaron "fotones", un término introducido por Gilbert N. Lewis en 1926. La idea de que cada fotón tenía que consistir en energía en términos de cuantos fue un logro notable; resolvió efectivamente el problema de la radiación de cuerpo negro que alcanzaba energía infinita, lo que ocurría en teoría si la luz se explicara solo en términos de ondas.
Se dio un paso importante en la evolución de la teoría cuántica en el primer Congreso Solvay de 1911. Allí se reunieron los mejores físicos de la comunidad científica para discutir el problema de “La radiación y los cuantos”. Para entonces, se había publicado el modelo del átomo de Ernest Rutherford, pero gran parte de la discusión sobre la estructura atómica giraba en torno al modelo cuántico de Arthur Haas en 1910. Además, en el Congreso Solvay de 1911, Hendrik Lorentz sugirió después de la charla de Einstein sobre la estructura cuántica que la energía de un rotador sea igual a nhv. A este le siguieron otros modelos cuánticos, como el modelo de John William Nicholson de 1912, que era un momento angular nuclear y cuantizado.Nicholson había introducido los espectros en su modelo atómico utilizando las oscilaciones de electrones en un átomo nuclear perpendicular al plano orbital, manteniendo así la estabilidad. Los espectros atómicos de Nicholson identificaron muchas líneas no atribuidas en los espectros solares y nebulares.
En 1913, Bohr explicó las líneas espectrales del átomo de hidrógeno, nuevamente utilizando la cuantización, en su artículo de julio de 1913 Sobre la constitución de átomos y moléculas en el que discutió y citó el modelo de Nicholson. En el modelo de Bohr, el átomo de hidrógeno se representa como un núcleo pesado con carga positiva orbitado por un electrón ligero con carga negativa. El electrón solo puede existir en ciertas órbitas discretamente separadas, etiquetadas por su momento angular, que está restringido a ser un múltiplo entero de la constante de Planck reducida. El éxito clave del modelo radica en explicar la fórmula de Rydberg para las líneas de emisión espectral del hidrógeno atómico utilizando las transiciones de electrones entre órbitas.Si bien la fórmula de Rydberg se conocía experimentalmente, no obtuvo una base teórica hasta que se introdujo el modelo de Bohr. El modelo de Bohr no solo explicó las razones de la estructura de la fórmula de Rydberg, sino que también proporcionó una justificación para las constantes físicas fundamentales que componen los resultados empíricos de la fórmula.
Además, la aplicación de la teoría cuántica de Planck al electrón permitió a Ștefan Procopiu en 1911-1913, y posteriormente a Niels Bohr en 1913, calcular el momento magnético del electrón, que más tarde se denominó "magnetón"; Posteriormente se hicieron posibles cálculos cuánticos similares, pero con valores numéricamente bastante diferentes, tanto para los momentos magnéticos del protón como para los del neutrón, que son tres órdenes de magnitud más pequeños que los del electrón.
Estas teorías, aunque exitosas, eran estrictamente fenomenológicas: durante este tiempo, no había una justificación rigurosa para la cuantización, aparte, quizás, de la discusión de Henri Poincaré sobre la teoría de Planck en su artículo de 1912 Sur la théorie des quanta. Se conocen colectivamente como la vieja teoría cuántica.
La frase "física cuántica" se utilizó por primera vez en el Universo de Planck a la luz de la física moderna de Johnston (1931).
En 1923, el físico francés Louis de Broglie presentó su teoría de las ondas de materia al afirmar que las partículas pueden exhibir características ondulatorias y viceversa. Esta teoría era para una sola partícula y se derivó de la teoría de la relatividad especial. Sobre la base del enfoque de De Broglie, la mecánica cuántica moderna nació en 1925, cuando los físicos alemanes Werner Heisenberg, Max Born y Pascual Jordan desarrollaron la mecánica matricial y el físico austriaco Erwin Schrödinger inventó la mecánica ondulatoria y la ecuación no relativista de Schrödinger como una aproximación de el caso generalizado de la teoría de de Broglie.Schrödinger demostró posteriormente que los dos enfoques eran equivalentes. Las primeras aplicaciones de la mecánica cuántica a los sistemas físicos fueron la determinación algebraica del espectro del hidrógeno por Wolfgang Pauli y el tratamiento de las moléculas diatómicas por Lucy Mensing.
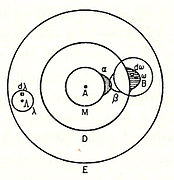 Diagrama de Ludwig Boltzmann de la molécula I 2 propuesta en 1898 que muestra la "región sensible" atómica (α, β) de superposición.
Diagrama de Ludwig Boltzmann de la molécula I 2 propuesta en 1898 que muestra la "región sensible" atómica (α, β) de superposición. Con la disminución de la temperatura, el pico de la curva de radiación del cuerpo negro se desplaza hacia longitudes de onda más largas y también tiene intensidades más bajas. Las curvas de radiación de cuerpo negro (1862) a la izquierda también se comparan con el modelo límite clásico temprano de Rayleigh y Jeans (1900) que se muestra a la derecha. El lado de longitud de onda corta de las curvas ya fue aproximado en 1896 por la ley de distribución de Wien.
Con la disminución de la temperatura, el pico de la curva de radiación del cuerpo negro se desplaza hacia longitudes de onda más largas y también tiene intensidades más bajas. Las curvas de radiación de cuerpo negro (1862) a la izquierda también se comparan con el modelo límite clásico temprano de Rayleigh y Jeans (1900) que se muestra a la derecha. El lado de longitud de onda corta de las curvas ya fue aproximado en 1896 por la ley de distribución de Wien.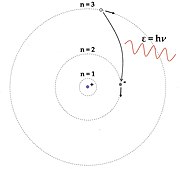 Modelo cuántico del átomo de hidrógeno de Niels Bohr de 1913.
Modelo cuántico del átomo de hidrógeno de Niels Bohr de 1913.
Mecánica cuántica moderna
Heisenberg formuló una versión temprana del principio de incertidumbre en 1927, analizando un experimento mental en el que uno intenta medir la posición y el momento de un electrón simultáneamente. Sin embargo, Heisenberg no dio definiciones matemáticas precisas de lo que significaba la "incertidumbre" en estas medidas, paso que darían poco después Earle Hesse Kennard, Wolfgang Pauli y Hermann Weyl.Alrededor de 1927, Paul Dirac inició el proceso de unificación de la mecánica cuántica con la relatividad especial al proponer la ecuación de Dirac para el electrón. La ecuación de Dirac logra la descripción relativista de la función de onda de un electrón que Schrödinger no pudo obtener. Predice el espín del electrón y llevó a Dirac a predecir la existencia del positrón. También fue pionero en el uso de la teoría de operadores, incluida la influyente notación bra-ket, como se describe en su famoso libro de texto de 1930. Durante el mismo período, el erudito húngaro John von Neumann formuló la base matemática rigurosa de la mecánica cuántica como la teoría de los operadores lineales en los espacios de Hilbert, como se describe en su igualmente famoso libro de texto de 1932. Estas, como muchas otras obras del período fundacional, siguen en pie y siguen siendo ampliamente utilizadas.
El campo de la química cuántica fue iniciado por los físicos Walter Heitler y Fritz London, quienes publicaron un estudio del enlace covalente de la molécula de hidrógeno en 1927. La química cuántica fue desarrollada posteriormente por un gran número de trabajadores, incluido el químico teórico estadounidense Linus Pauling en Caltech y John C. Slater en varias teorías, como la teoría del orbital molecular o la teoría de la valencia.
Teoría cuántica de campos
A partir de 1927, los investigadores intentaron aplicar la mecánica cuántica a campos en lugar de partículas individuales, lo que resultó en teorías cuánticas de campos. Los primeros trabajadores en esta área incluyen a PAM Dirac, W. Pauli, V. Weisskopf y P. Jordan. Esta área de investigación culminó con la formulación de la electrodinámica cuántica por parte de RP Feynman, F. Dyson, J. Schwinger y S. Tomonaga durante la década de 1940. La electrodinámica cuántica describe una teoría cuántica de electrones, positrones y el campo electromagnético, y sirvió como modelo para teorías cuánticas de campos posteriores.
La teoría de la cromodinámica cuántica se formuló a principios de la década de 1960. La teoría tal como la conocemos hoy en día fue formulada por Politzer, Gross y Wilczek en 1975.
Sobre la base del trabajo pionero de Schwinger, Higgs y Goldstone, los físicos Glashow, Weinberg y Salam demostraron de forma independiente cómo la fuerza nuclear débil y la electrodinámica cuántica podrían fusionarse en una sola fuerza electrodébil, por lo que recibieron el Premio Nobel de Física de 1979.
Información cuántica
La ciencia de la información cuántica se desarrolló en las últimas décadas del siglo XX, comenzando con resultados teóricos como el teorema de Holevo, el concepto de medidas generalizadas o POVM, la propuesta de distribución de claves cuánticas de Bennett y Brassard y el algoritmo de Shor.
Experimentos fundadores
- Experimento de doble rendija de Thomas Young que demuestra la naturaleza ondulatoria de la luz. (hacia 1801)
- Henri Becquerel descubre la radiactividad. (1896)
- Experimentos del tubo de rayos catódicos de JJ Thomson (descubre el electrón y su carga negativa). (1897)
- El estudio de la radiación del cuerpo negro entre 1850 y 1900, que no podía explicarse sin conceptos cuánticos.
- El efecto fotoeléctrico: Einstein lo explicó en 1905 (y más tarde recibió un premio Nobel por ello) utilizando el concepto de fotones, partículas de luz con energía cuantizada.
- El experimento de la gota de aceite de Robert Millikan, que mostró que la carga eléctrica se presenta como cuantos (unidades enteras). (1909)
- El experimento de la hoja de oro de Ernest Rutherford refutó el modelo de budín de ciruelas del átomo que sugería que la masa y la carga positiva del átomo están distribuidas casi uniformemente. Esto condujo al modelo planetario del átomo (1911).
- El experimento de colisión de electrones de James Franck y Gustav Hertz muestra que la absorción de energía por parte de los átomos de mercurio está cuantificada. (1914)
- Otto Stern y Walther Gerlach realizan el experimento Stern-Gerlach, que demuestra la naturaleza cuantificada del giro de las partículas. (1920)
- Arthur Compton con el experimento de dispersión de Compton (1923)
- Clinton Davisson y Lester Germer demuestran la naturaleza ondulatoria del electrón en el experimento de difracción de electrones. (1927)
- Carl David Anderson con el descubrimiento del positrón (1932), validó la predicción teórica de Paul Dirac sobre esta partícula (1928)
- El experimento de Lamb-Retherford descubrió el cambio de Lamb (1947), que condujo al desarrollo de la electrodinámica cuántica.
- Clyde L. Cowan y Frederick Reines confirman la existencia del neutrino en el experimento del neutrino. (1955)
- Experimento de doble rendija de Clauss Jönsson con electrones. (1961)
- El efecto Hall cuántico, descubierto en 1980 por Klaus von Klitzing. La versión cuantizada del efecto Hall ha permitido la definición de un nuevo estándar práctico para la resistencia eléctrica y una determinación independiente extremadamente precisa de la constante de estructura fina.
- La verificación experimental del entrelazamiento cuántico por John Clauser y Stuart Freedman. (1972)
- El experimento del interferómetro Mach-Zehnder realizado por Paul Kwiat, Harold Wienfurter, Thomas Herzog, Anton Zeilinger y Mark Kasevich, que proporciona una verificación experimental del probador de bombas Elitzur-Vaidman, lo que demuestra que es posible una medición sin interacción. (1994)
Contenido relacionado
Hadrón
Barión
Función del trabajo

