Hiperconjugación
En química orgánica, la hiperconjugación (conjugación σ o resonancia sin enlace) se refiere a la deslocalización de electrones con la participación de enlaces de carácter principalmente σ. Por lo general, la hiperconjugación implica la interacción de los electrones en un orbital sigma (σ) (p. ej., C–H o C–C) con un orbital p no enlazante o antienlazante adyacente σ* o π* para dar un par de orbitales moleculares extendidos.. Sin embargo, a veces, los orbitales σ* de antienlace bajos también pueden interactuar con orbitales llenos de carácter de par solitario (n) en lo que se denomina hiperconjugación negativa. El aumento de la deslocalización de electrones asociado con la hiperconjugación aumenta la estabilidad del sistema. En particular, el nuevo orbital con carácter de enlace se estabiliza, dando como resultado una estabilización general de la molécula. Solo los electrones en enlaces que están en la posición β pueden tener este tipo de efecto estabilizador directo: donar desde un enlace sigma en un átomo a un orbital en otro átomo directamente unido a él. Sin embargo, las versiones extendidas de la hiperconjugación (como la doble hiperconjugación) también pueden ser importantes. El efecto Baker-Nathan, a veces utilizado como sinónimo de hiperconjugación, es una aplicación específica del mismo a ciertas reacciones químicas o tipos de estructuras.
Aplicaciones
La hiperconjugación se puede utilizar para racionalizar una variedad de fenómenos químicos, incluido el efecto anomérico, el efecto gauche, la barrera rotacional del etano, el efecto beta-silicio, la frecuencia vibratoria de los grupos carbonilo exocíclicos y la estabilidad relativa de carbocationes sustituidos y sustituidos. radicales centrados en carbono y la regla termodinámica de Zaitsev para la estabilidad de alquenos. De manera más controvertida, el modelado mecánico cuántico propone la hiperconjugación como una mejor explicación de la preferencia de la conformación escalonada en lugar de la antigua noción de libro de texto de impedimento estérico.
Efecto sobre las propiedades químicas
La hiperconjugación afecta a varias propiedades.
- Longitud del enlace: la hiperconjugación se sugiere como un factor clave en el acortamiento de los enlaces sigma (enlaces σ). Por ejemplo, los enlaces simples C-C en el 1,3-butadieno y el propino tienen una longitud de aproximadamente 1,46 angstrom, mucho menos que el valor de alrededor de 1,54 Å que se encuentra en los hidrocarburos saturados. Para el butadieno, esto puede explicarse como una conjugación normal de las dos partes de alquenilo. Pero para Propyne, hiperconjugación entre las partes alquilo y alquinilo.
- Momentos dipolares: el gran aumento en el momento dipolar del 1,1,1-tricloroetano en comparación con el cloroformo puede atribuirse a estructuras hiperconjugadas.
- Los calores de formación de moléculas con hiperconjugación son mayores que la suma de sus energías de enlace y los calores de hidrogenación por doble enlace son menores que el calor de hidrogenación del etileno.
- Estabilidad de los carbocationes:(CH 3) 3 C > (CH 3) 2 CH > (CH 3)CH 2 > CH 3Los tres enlaces C–H σ del(los) grupo(s) metilo unidos al carbocatión pueden sufrir la interacción de estabilización, pero solo uno de ellos puede alinearse perfectamente con el orbital p vacío, dependiendo de la conformación del enlace carbono-carbono. La donación de los dos enlaces C-H desalineados es más débil. Cuantos más grupos metilo adyacentes haya, mayor será la estabilización de la hiperconjugación debido al mayor número de enlaces C-H adyacentes.
Hiperconjugación en compuestos insaturados
Se sugirió la hiperconjugación como la razón del aumento de la estabilidad de los dobles enlaces carbono-carbono a medida que aumenta el grado de sustitución. Los primeros estudios en hiperconjugación fueron realizados por el grupo de investigación de George Kistiakowsky. Su trabajo, publicado por primera vez en 1937, pretendía ser un informe de progreso preliminar de los estudios termoquímicos de los cambios de energía durante las reacciones de adición de varios compuestos cíclicos e insaturados. La importancia de la hiperconjugación para explicar este efecto ha recibido apoyo de los cálculos químicos cuánticos. Se cree que la interacción clave es la donación de densidad electrónica del enlace σ C–H vecino al orbital antienlazante π* del alqueno (σ C–H→π*). El efecto es casi un orden de magnitud más débil que el caso de la sustitución de alquilo en los carbocationes (σ C–H →p C), ya que un orbital p vacío tiene menos energía y, por lo tanto, se adapta mejor energéticamente a un enlace σ. Cuando este efecto se manifiesta en la formación del producto más sustituido en reacciones E1 controladas termodinámicamente, se conoce como regla de Zaitsev, aunque en muchos casos el producto cinético también sigue esta regla. (Consulte la regla de Hofmann para los casos en que el producto cinético es el menos sustituido).
Un conjunto de experimentos de Kistiakowsky involucró datos de calores de hidrogenación recopilados durante reacciones en fase gaseosa de una variedad de compuestos que contenían una unidad de alqueno. Al comparar una variedad de alquenos sustituidos con monoalquilo, encontraron que cualquier grupo alquilo aumentaba notablemente la estabilidad, pero que la elección de diferentes grupos alquilo específicos tenía poco o ningún efecto.
Una parte del trabajo de Kistiakowsky involucró una comparación de otros compuestos insaturados en forma de CH 2 =CH(CH 2)n-CH=CH 2(n=0,1,2). Estos experimentos revelaron un resultado importante; cuando n=0, hay un efecto de conjugación a la molécula donde el valor de ΔH se reduce en 3,5 kcal. Esto se asemeja a la adición de dos grupos alquilo al etileno. Kistiakowsky también investigó los sistemas de cadena abierta, en los que se encontró que el mayor valor de calor liberado se producía durante la adición a una molécula en la posición 1,4. Las moléculas cíclicas resultaron ser las más problemáticas, ya que se descubrió que habría que tener en cuenta la tensión de la molécula. La tensión de los anillos de cinco miembros aumentó con una disminución del grado de instauración. Este fue un resultado sorprendente que se investigó más a fondo en trabajos posteriores con anhídridos de ácidos cíclicos y lactonas. También se estudiaron moléculas cíclicas como el benceno y sus derivados,
A pesar de la minuciosidad del trabajo de Kistiakowsky, no estaba completo y necesitaba más pruebas para respaldar sus hallazgos. Su trabajo fue un primer paso crucial para los inicios de las ideas de hiperconjugación y efectos de conjugación.
Estabilización de 1,3-butadiino y 1,3-butadieno
La conjugación de 1,3-butadieno fue evaluada por primera vez por Kistiakowsky, se encontró una contribución conjugativa de 3,5 kcal/mol basada en la comparación energética de hidrogenación entre especies conjugadas y análogos no conjugados. Rogers, que utilizó el método aplicado por primera vez por Kistiakowsky, informó que la estabilización de la conjugación de 1,3-butadiino era cero, ya que la diferencia de Δ hyd H entre la primera y la segunda hidrogenación era cero. Los calores de hidrogenación (Δ hyd H) se obtuvieron mediante el método de química cuántica computacional G3 (MP2).

Otro grupo dirigido por Houk sugirió que los métodos empleados por Rogers y Kistiakowsky eran inapropiados, porque las comparaciones de calores de hidrogenación evalúan no solo los efectos de conjugación sino también otras diferencias estructurales y electrónicas. Obtuvieron -70,6 kcal/mol y -70,4 kcal/mol para la primera y la segunda hidrogenación respectivamente mediante cálculo ab initio, lo que confirmó los datos de Rogers. Sin embargo, interpretaron los datos de manera diferente al tener en cuenta la estabilización de la hiperconjugación. Para cuantificar el efecto de hiperconjugación, diseñaron las siguientes reacciones isodésmicas en 1-butino y 1-buteno.

La eliminación de las interacciones hiperconjugativas da estados virtuales que tienen energías que son 4,9 y 2,4 kcal/mol más altas que las del 1-butino y el 1-buteno, respectivamente. El empleo de estos estados virtuales da como resultado una estabilización conjugativa de 9,6 kcal/mol para 1,3-butadiino y 8,5 kcal/mol para 1,3-butadieno.

Tendencias en hiperconjugación
Un trabajo relativamente reciente (2006) de Fernández y Frenking (2006) resumió las tendencias de hiperconjugación entre varios grupos de moléculas acíclicas, usando análisis de descomposición de energía o EDA. Fernández y Frenking definen este tipo de análisis como "...un método que utiliza únicamente los orbitales pi de los fragmentos que interactúan en la geometría de la molécula para estimar las interacciones pi ". Para este tipo de análisis, la formación de enlaces entre varios fracciones es una combinación de tres términos componentes. ΔE elstat representa lo que Fernández y Frenking denominan “atracciones electrostáticas cuasiclásicas” de una molécula. El segundo término, ΔE Pauli, representa la repulsión de Pauli de la molécula. orbe ΔE, el tercer término, representa interacciones estabilizadoras entre orbitales y se define como la suma de ΔE pi y ΔE sigma. La energía total de interacción, ΔE int, es el resultado de la suma de los 3 términos.
Un grupo cuyos valores de ΔE pi se analizaron muy a fondo fue un grupo de enonas que variaban en el sustituyente.
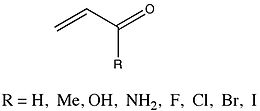
Fernández y Frenking informaron que los sustituyentes metilo, hidroxilo y amino dieron como resultado una disminución en ΔE pi del 2-propenal original. Por el contrario, los sustituyentes de haluro de masa atómica creciente dieron como resultado un aumento de ΔE pi. Debido a que tanto el estudio de enone como el análisis de Hammett estudian los efectos de los sustituyentes (aunque en diferentes especies), Fernández y Frenking sintieron que comparar los dos para investigar posibles tendencias podría brindar una comprensión significativa de sus propios resultados. Observaron una relación lineal entre los valores de ΔE pi para las enonas sustituidas y las constantes de Hammett correspondientes. Se encontró que la pendiente del gráfico era -51,67, con un coeficiente de correlación de -0,97 y una desviación estándar de 0,54.Fernández y Frenking concluyen a partir de estos datos que... "los efectos electrónicos de los sustituyentes R en la conjugación de pi en sistemas homo y heteroconjugados son similares y, por lo tanto, parecen ser bastante independientes de la naturaleza del sistema de conjugación".
Barrera rotacional de etano
Un ejemplo en el que la hiperconjugación puede pasarse por alto como posible explicación química es la racionalización de la barrera rotacional del etano (C 2 H 6). Ya en la década de 1930 se había aceptado que las conformaciones escalonadas del etano eran más estables que la conformación eclipsada. Wilson había demostrado que la barrera de energía entre cualquier par de conformaciones eclipsadas y escalonadas es de aproximadamente 3 kcal/mol, y la razón generalmente aceptada para esto era las interacciones estéricas desfavorables entre los átomos de hidrógeno.
 Proyecciones de Newman: escalonadas (izquierda) y eclipsadas (derecha)
Proyecciones de Newman: escalonadas (izquierda) y eclipsadas (derecha)
Sin embargo, en su artículo de 2001, Pophristic y Goodman revelaron que esta explicación puede ser demasiado simplista.Goodman se centró en tres factores físicos principales: interacciones hiperconjugativas, repulsión de intercambio definida por el principio de exclusión de Pauli e interacciones electrostáticas (interacciones de Coulomb). Al comparar una molécula de etano tradicional y una molécula de etano hipotética con todas las repulsiones de intercambio eliminadas, se prepararon curvas de potencial trazando el ángulo de torsión versus la energía para cada molécula. El análisis de las curvas determinó que la conformación escalonada no tenía conexión con la cantidad de repulsiones electrostáticas dentro de la molécula. Estos resultados demuestran que las fuerzas de Coulombic no explican las conformaciones escalonadas favorecidas, a pesar de que el estiramiento del enlace central disminuye las interacciones electrostáticas.
Goodman también realizó estudios para determinar la contribución de las interacciones vecinales (entre dos grupos metilo) frente a geminales (entre los átomos en un solo grupo metilo) a la hiperconjugación. En experimentos separados, se eliminaron las interacciones geminales y vecinales, y se dedujo el confórmero más estable para cada interacción.
| Interacción eliminada | Ángulo de torsión | confórmero correspondiente |
|---|---|---|
| Ninguna | 60° | escalonado |
| Toda la hiperconjugación | 0° | eclipsado |
| Hiperconjugación vecinal | 0° | eclipsado |
| Hiperconjugación geminal | 60° | escalonado |
A partir de estos experimentos, se puede concluir que los efectos hiperconjugativos deslocalizan la carga y estabilizan la molécula. Además, son los efectos hiperconjugativos vecinales los que mantienen a la molécula en la conformación escalonada. Gracias a este trabajo, el siguiente modelo de estabilización de la conformación escalonada del etano es ahora más aceptado:

La hiperconjugación también puede explicar varios otros fenómenos cuyas explicaciones pueden no ser tan intuitivas como la de la barrera rotacional del etano.
El asunto de la barrera rotacional del etano no está resuelto dentro de la comunidad científica. Un análisis dentro de la teoría cuantitativa de orbitales moleculares muestra que las repulsiones (estéricas) de 2 orbitales y 4 electrones son dominantes sobre la hiperconjugación. Un estudio de la teoría del enlace de valencia también enfatiza la importancia de los efectos estéricos.
Contenido relacionado
Electrón deslocalizado
Alquilo
Naftalina