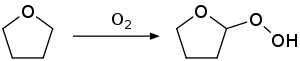Hidroperóxido

Los Hidroperóxidos o peroxoles son compuestos de la forma ROOH, donde R representa cualquier grupo, típicamente orgánico, que contiene el grupo funcional hidroperoxi (−OOH). Hidroperóxido también se refiere al anión hidroperóxido (−OOH) y sus sales. , y el radical hidroperoxilo neutro (•OOH) consiste en un grupo hidroperoxi no unido. Cuando R es orgánico, los compuestos se denominan hidroperóxidos orgánicos. Estos compuestos son un subconjunto de peróxidos orgánicos, que tienen la fórmula ROOR. Los hidroperóxidos orgánicos pueden iniciar intencionalmente o no una polimerización explosiva en materiales con enlaces químicos insaturados.
Propiedades
La longitud del enlace O−O en peróxidos es de aproximadamente 1,45 Å, y los ángulos R−O−O (R = H, C) son aproximadamente 110° (parecidos al agua). Característicamente, los ángulos diédricos C−O−O−H son de aproximadamente 120°. El enlace O−O es relativamente débil, con una energía de disociación del enlace de 45 a 50 kcal/mol (190 a 210 kJ/mol), menos de la mitad de la fuerza de < span class="chemf nowrap">C-C, C-H y C-O cautiverio.
Los hidroperóxidos suelen ser más volátiles que los alcoholes correspondientes:
- (pág. 36) °C) vs tert-BuOH (b.p. 82-83 °C)
- CH3OOH (b.p. 46 °C) vs CH3OH (b.p. 65 °C)
- cumene hydroperoxide (b.p. 153 °C) vs cumyl alcohol (b.p. 202 °C)
Reacciones diversas
Las hidroperoxidas son ligeramente ácidos. El rango se indica en 11.5 para CH3OOH a 13.1 para Ph3COOH.
Los hidroperóxidos se pueden reducir a alcoholes con hidruro de litio y aluminio, como se describe en esta ecuación idealizada:
- 4 ROOH + LiAlH4 → LiAlO2 + 2 H2O + 4 ROH
Esta reacción es la base de los métodos de análisis de peróxidos orgánicos. Otra forma de evaluar el contenido de perácidos y peróxidos es la valoración volumétrica con alcóxidos como el etóxido de sodio. Los ésteres de fosfito y las fosfinas terciarias también efectúan la reducción:
- ROOH + PR3 → OPR3 + ROH
Usos
Precursoras de los epóxidos
(feminine)"La aplicación sintética más importante de los hidroperóxidos de alquilo es sin duda la epoxidación de alquenos catalizada por metales." En el proceso Halcon se emplea hidroperóxido de terc-butilo (TBHP) para la producción de óxido de propileno.
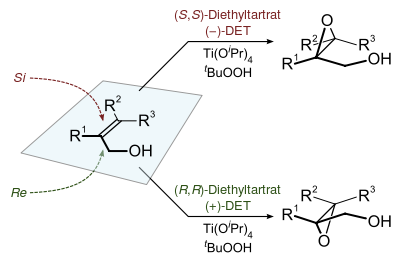
De interés especializado, los epóxidos quirales se preparan utilizando hidroperóxidos como reactivos en la epoxidación Sharpless.
Producción de ciclohexanona y caprolactona
Los hidroperoxidos son intermediarios en la producción de muchos compuestos orgánicos en la industria. Por ejemplo, la oxidación catalizada del cobalto del ciclohexano al ciclohexanona:
- C6H12 + O2 →2)5C=O + H2O
Los aceites secantes, como los que se encuentran en muchas pinturas y barnices, funcionan mediante la formación de hidroperóxidos.
Procesos de corvejón

Los compuestos con enlaces C-H alílicos y bencílicos son especialmente susceptibles a la oxigenación. Esta reactividad se explota industrialmente a gran escala para la producción de fenol mediante el proceso de cumeno o el proceso de Hock para sus intermedios de cumeno e hidroperóxido de cumeno. Estas reacciones se basan en iniciadores radicales que reaccionan con el oxígeno para formar un intermedio que extrae un átomo de hidrógeno de un enlace C-H débil. El radical resultante se une a O2, para dar hidroperoxilo (ROO•), que luego continúa el ciclo de Abstracción del átomo de H.

Formación
Por autoxidación
Los peróxidos más importantes (en un sentido comercial) se producen por autooxidación, la reacción directa de O2< /span> con un hidrocarburo. La autooxidación es una reacción radicalaria que comienza con la abstracción de un átomo de H de un enlace C-H relativamente débil. Los compuestos importantes elaborados de esta manera incluyen hidroperóxido de terc-butilo, hidroperóxido de cumeno e hidroperóxido de etilbenceno:
- RH - + O2 → R−OH
La reacción de autooxidación también se observa con éteres comunes, como éter dietílico, éter diisopropílico, tetrahidrofurano y 1,4-dioxano. Un producto ilustrativo es el peróxido de éter dietílico. Estos compuestos pueden provocar una grave explosión cuando se destilan. Para minimizar este problema, las muestras comerciales de THF suelen inhibirse con hidroxitolueno butilado (BHT). Se evita la destilación de THF hasta sequedad porque los peróxidos explosivos se concentran en el residuo.
Aunque el hidroperóxido de éter a menudo se forma de forma accidental (es decir, por autooxidación), se pueden preparar con alto rendimiento mediante la adición catalizada por ácido de peróxido de hidrógeno a éteres vinílicos:
- C2H5OCH=CH2 + H2O2 → C2H5OCH(OOH)CH3
De peróxido de hidrógeno
Muchos peróxidos industriales se producen utilizando peróxido de hidrógeno. Las reacciones con aldehídos y cetonas producen una serie de compuestos según las condiciones. Las reacciones específicas incluyen la adición de peróxido de hidrógeno a través del doble enlace C=O:
- R2C=O + H2O2 → R2C(OH)OH
En algunos casos, estos hidroperóxidos se convierten para dar diperóxidos cíclicos:
- [R]2C(O)2H)]2O2 [R]2C]2(O2)2 + 2 H2O
Adición de este aducto inicial a un segundo equivalente del carbonilo:
- R2C=O + R2C(OH)OOH → [R2C(OH)]2O2
Reemplazo adicional de grupos de alcohol:
- [R]2C(OH)]2O2 + 2 H2O2 [R]2C(O)2H)]2O2 + 2 H2O
Triphenylmethanol reacciona con peróxido de hidrógeno da el hidroperoxido inusualmente estable, Ph3COOH.
Hidroperoxidas naturales
Muchos hidroperóxidos se derivan de ácidos grasos, esteroides y terpenos. La biosíntesis de estas especies se ve ampliamente afectada por las enzimas.