Hidrogenación
La hidrogenación es una reacción química entre el hidrógeno molecular (H 2) y otro compuesto o elemento, normalmente en presencia de un catalizador como el níquel, el paladio o el platino. El proceso se emplea comúnmente para reducir o saturar compuestos orgánicos. La hidrogenación típicamente constituye la adición de pares de átomos de hidrógeno a una molécula, a menudo un alqueno. Se requieren catalizadores para que la reacción sea utilizable; la hidrogenación no catalítica tiene lugar solo a temperaturas muy altas. La hidrogenación reduce los enlaces dobles y triples en los hidrocarburos.
Proceso
La hidrogenación tiene tres componentes, el sustrato insaturado, el hidrógeno (o fuente de hidrógeno) e, invariablemente, un catalizador. La reacción de reducción se lleva a cabo a diferentes temperaturas y presiones dependiendo del sustrato y la actividad del catalizador.
Reacciones relacionadas o en competencia
Los mismos catalizadores y condiciones que se usan para las reacciones de hidrogenación también pueden conducir a la isomerización de los alquenos de cis a trans. Este proceso es de gran interés porque la tecnología de hidrogenación genera la mayor parte de las grasas trans en los alimentos (ver § Industria alimentaria a continuación). Una reacción en la que se rompen los enlaces mientras se agrega hidrógeno se llama hidrogenólisis, una reacción que puede ocurrir en los enlaces carbono-carbono y carbono-heteroátomo (oxígeno, nitrógeno o halógeno). Algunas hidrogenaciones de enlaces polares van acompañadas de hidrogenólisis.
Fuentes de hidrógeno
Para la hidrogenación, la fuente obvia de hidrógeno es el propio gas H2 , que normalmente está disponible comercialmente dentro del medio de almacenamiento de un cilindro presurizado. El proceso de hidrogenación a menudo utiliza más de 1 atmósfera de H 2, normalmente transportado desde los cilindros y, a veces, aumentado por "bombas de refuerzo". El hidrógeno gaseoso se produce industrialmente a partir de hidrocarburos mediante el proceso conocido como reformado con vapor. Para muchas aplicaciones, el hidrógeno se transfiere de moléculas donantes como el ácido fórmico, el isopropanol y el dihidroantraceno. Estos donantes de hidrógeno se someten a deshidrogenación a, respectivamente, dióxido de carbono, acetona y antraceno. Estos procesos se denominan hidrogenaciones de transferencia.
Sustratos
Una característica importante de las hidrogenaciones de alquenos y alquinos, tanto las versiones catalizadas de forma homogénea como heterogénea, es que la adición de hidrógeno se produce con la "adición sin", con el hidrógeno entrando por el lado con menos obstáculos. Esta reacción se puede realizar en una variedad de diferentes grupos funcionales.
| Sustrato | Producto | Comentarios | Calor de hidrogenación(kJ/mol) |
|---|---|---|---|
| R 2 C=CR' 2(alqueno) | R 2 CHCHR' 2(alcano) | gran aplicación es la producción de margarina | −90 a −130 |
| RC≡CR'(alquino) | RCH 2 CH 2 R'(alcano) | la semihidrogenación da cis -RHC=CHR' | −300(para hidrogenación completa) |
| RCHO(aldehído) | RCH 2 OH(alcohol primario) | a menudo emplea hidrogenación de transferencia | −60 a −65 |
| R 2 CO(cetona) | R 2 CHOH(alcohol secundario) | a menudo emplea hidrogenación de transferencia | −60 a −65 |
| RCO 2 R'(éster) | RCH 2 OH + R'OH(dos alcoholes) | a menudo se aplica a la producción de alcoholes grasos | −25 a −105 |
| RCO 2 H(ácido carboxílico) | RCH 2 OH(alcohol primario) | aplicable a los alcoholes grasos | −25 a −75 |
| RNO2 (nitro) | RNH 2(amina) | aplicación principal es la anilina | −550 |
Catalizadores
Con raras excepciones, el H 2 no reacciona con los compuestos orgánicos en ausencia de catalizadores metálicos. El sustrato no saturado se quimisorbe sobre el catalizador, con la mayoría de los sitios cubiertos por el sustrato. En los catalizadores heterogéneos, el hidrógeno forma hidruros superficiales (MH) desde los cuales los hidrógenos pueden transferirse al sustrato quimisorbido. El platino, el paladio, el rodio y el rutenio forman catalizadores altamente activos, que operan a temperaturas más bajas y presiones más bajas de H 2. Los catalizadores de metales no preciosos, especialmente los basados en níquel (como el níquel Raney y el níquel Urushibara) también se han desarrollado como alternativas económicas, pero a menudo son más lentos o requieren temperaturas más altas. La compensación es la actividad (velocidad de reacción) frente al costo del catalizador y el costo del aparato requerido para el uso de altas presiones. Tenga en cuenta que las hidrogenaciones catalizadas con níquel Raney requieren altas presiones:
Los catalizadores generalmente se clasifican en dos grandes clases: catalizadores homogéneos y catalizadores heterogéneos. Los catalizadores homogéneos se disuelven en el solvente que contiene el sustrato insaturado. Los catalizadores heterogéneos son sólidos que se suspenden en el mismo solvente con el sustrato o se tratan con sustrato gaseoso.
Catalizadores homogéneos
A continuación se indican algunos catalizadores homogéneos bien conocidos. Estos son complejos de coordinación que activan tanto el sustrato insaturado como el H 2. Lo más típico es que estos complejos contengan metales del grupo del platino, especialmente Rh e Ir.
- Catalizadores homogéneos de hidrogenación y sus precursores.
 El diclorotris(trifenilfosfina)rutenio(II) es un precatalizador a base de rutenio.
El diclorotris(trifenilfosfina)rutenio(II) es un precatalizador a base de rutenio. El catalizador de Crabtree es un catalizador altamente activo con iridio.
El catalizador de Crabtree es un catalizador altamente activo con iridio. Rh 2 Cl 2 (cod) 2 es un precursor de muchos catalizadores homogéneos.
Rh 2 Cl 2 (cod) 2 es un precursor de muchos catalizadores homogéneos. (S)-iPr-PHOX es un ligando de fosfina quelante típico utilizado en la hidrogenación asimétrica.
(S)-iPr-PHOX es un ligando de fosfina quelante típico utilizado en la hidrogenación asimétrica.
Los catalizadores homogéneos también se utilizan en la síntesis asimétrica por hidrogenación de sustratos proquirales. Una de las primeras demostraciones de este enfoque fue la hidrogenación de enamidas catalizada por Rh como precursores del fármaco L-DOPA. Para lograr la reducción asimétrica, estos catalizadores se vuelven quirales mediante el uso de ligandos de difosfina quirales. La hidrogenación catalizada por rodio también se ha utilizado en la producción de herbicidas de S-metolacloro, que utiliza un ligando de tipo Josiphos (llamado Xyliphos). En principio, la hidrogenación asimétrica puede ser catalizada por catalizadores heterogéneos quirales, pero este enfoque sigue siendo más una curiosidad que una tecnología útil.
Catalizadores heterogéneos
Los catalizadores heterogéneos para la hidrogenación son más comunes industrialmente. En la industria, los catalizadores de hidrogenación de metales preciosos se depositan a partir de la solución como un polvo fino sobre el soporte, que es un material barato, voluminoso, poroso y normalmente granular, como el carbón activado, la alúmina, el carbonato de calcio o el sulfato de bario. Por ejemplo, el platino sobre carbón se produce por reducción de ácido cloroplatínico in situ en carbón. Ejemplos de estos catalizadores son 5% de rutenio sobre carbón activado o 1% de platino sobre alúmina. Los catalizadores de metal base, como el níquel Raney, suelen ser mucho más baratos y no necesitan soporte. Además, en el laboratorio, todavía se utilizan catalizadores de metales preciosos (masivos) sin soporte, como el negro de platino, a pesar del costo.
Como en los catalizadores homogéneos, la actividad se ajusta a través de cambios en el entorno alrededor del metal, es decir, la esfera de coordinación. Las diferentes caras de un catalizador heterogéneo cristalino muestran actividades distintas, por ejemplo. Esto se puede modificar mezclando metales o usando diferentes técnicas de preparación. De manera similar, los catalizadores heterogéneos se ven afectados por sus soportes.
En muchos casos, las modificaciones altamente empíricas involucran "venenos" selectivos. Por lo tanto, se puede usar un catalizador cuidadosamente elegido para hidrogenar algunos grupos funcionales sin afectar a otros, como la hidrogenación de alquenos sin tocar los anillos aromáticos, o la hidrogenación selectiva de alquinos a alquenos usando el catalizador de Lindlar. Por ejemplo, cuando el catalizador paladio se coloca sobre sulfato de bario y luego se trata con quinolina, el catalizador resultante reduce los alquinos solo hasta los alquenos. El catalizador de Lindlar se ha aplicado a la conversión de fenilacetileno en estireno.
- hidrogenaciones ilustrativas
![Hidrogenación selectiva del grupo alqueno menos impedido en la carvona usando un catalizador homogéneo (catalizador de Wilkinson).[16]](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/CarvoneH2.png/162px-CarvoneH2.png) Hidrogenación selectiva del grupo alqueno menos impedido en la carvona usando un catalizador homogéneo (catalizador de Wilkinson).
Hidrogenación selectiva del grupo alqueno menos impedido en la carvona usando un catalizador homogéneo (catalizador de Wilkinson). Hidrogenación parcial de fenilacetileno utilizando el catalizador de Lindlar.
Hidrogenación parcial de fenilacetileno utilizando el catalizador de Lindlar.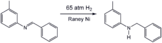 Hidrogenación de una imina usando un catalizador de níquel Raney, un catalizador heterogéneo popular.
Hidrogenación de una imina usando un catalizador de níquel Raney, un catalizador heterogéneo popular. Hidrogenación parcial de un derivado de resorcinol utilizando un catalizador Raney-Nickel.
Hidrogenación parcial de un derivado de resorcinol utilizando un catalizador Raney-Nickel.![Hidrogenación de ácido maleico a ácido succínico.[17]](https://upload.wikimedia.org/wikipedia/commons/thumb/c/ca/SuccPdH2.png/162px-SuccPdH2.png) Hidrogenación de ácido maleico a ácido succínico.
Hidrogenación de ácido maleico a ácido succínico.
Hidrogenación de transferencia
La hidrogenación por transferencia utiliza moléculas donantes de hidrógeno distintas del H 2 molecular. Estos donantes de hidrógeno "de sacrificio", que también pueden servir como disolventes para la reacción, incluyen hidracina, ácido fórmico y alcoholes como el isopropanol.
En síntesis orgánica, la hidrogenación por transferencia es útil para la hidrogenación asimétrica de sustratos polares insaturados, como cetonas, aldehídos e iminas, mediante el empleo de catalizadores quirales.
Hidrogenación electrolítica
Los sustratos polares, como los nitrilos, se pueden hidrogenar electroquímicamente, utilizando disolventes próticos y equivalentes reductores como fuente de hidrógeno.
Termodinámica y mecanismo.
La adición de hidrógeno a enlaces dobles o triples en hidrocarburos es un tipo de reacción redox que puede ser termodinámicamente favorable. Por ejemplo, la adición de hidrógeno al eteno tiene un cambio de energía libre de Gibbs de -101 kJ·mol, que es altamente exotérmico. En la hidrogenación de aceites vegetales y ácidos grasos, por ejemplo, el calor liberado, unas 25 kcal por mol (105 kJ/mol), es suficiente para elevar la temperatura del aceite entre 1,6 y 1,7 °C por descenso del índice de yodo.
Sin embargo, la velocidad de reacción para la mayoría de las reacciones de hidrogenación es insignificante en ausencia de catalizadores. El mecanismo de hidrogenación de alquenos y alquinos catalizada por metales ha sido ampliamente estudiado. En primer lugar, el etiquetado de isótopos con deuterio confirma la regioquímica de la adición:RCH=CH 2 + D 2 → RCHDCH 2 D
Catálisis heterogénea
En sólidos, el mecanismo aceptado es el mecanismo de Horiuti-Polanyi:
- Unión del enlace insaturado
- Disociación de H 2 en el catalizador
- Adición de un átomo de hidrógeno; este paso es reversible
- Adición del segundo átomo; efectivamente irreversible.
En el tercer paso, el grupo alquilo puede revertirse a alqueno, que puede separarse del catalizador. En consecuencia, el contacto con un catalizador de hidrogenación permite la isomerización cis-trans. El trans -alqueno puede reasociarse a la superficie y someterse a hidrogenación. Estos detalles se revelan en parte usando D2 (deuterio), porque los alquenos recuperados a menudo contienen deuterio.
Para sustratos aromáticos, la primera hidrogenación es la más lenta. El producto de este paso es un ciclohexadieno, que se hidrogena rápidamente y rara vez se detecta. De manera similar, el ciclohexeno normalmente se reduce a ciclohexano.
Catálisis homogénea
En muchos procesos de hidrogenación homogéneos, el metal se une a ambos componentes para dar un complejo intermedio alqueno-metal (H) 2. Se supone que la secuencia general de reacciones es la siguiente o una secuencia de pasos relacionada:
- unión del hidrógeno para dar un complejo de dihidruro a través de la adición oxidativa (antes de la adición oxidativa de H 2 está la formación de un complejo de dihidrógeno):
L n M + H 2 → L n MH 2
- unión de alqueno:
L n M (η H 2) + CH 2 =CHR → L n-1 MH 2 (CH 2 =CHR) + L
- transferencia de un átomo de hidrógeno del metal al carbono (inserción migratoria)
L n-1 MH 2 (CH 2 =CHR) → L n-1 M (H) (CH 2 -CH 2 R)
- transferencia del segundo átomo de hidrógeno del metal al grupo alquilo con disociación simultánea del alcano ("eliminación reductora")
L n-1 M(H)(CH 2 -CH 2 R) → L n-1 M + CH 3 -CH 2 R
Sustratos inorgánicos
La hidrogenación de nitrógeno para dar amoníaco se lleva a cabo a gran escala mediante el proceso Haber-Bosch, que consume aproximadamente el 1% del suministro de energía mundial.
El oxígeno se puede hidrogenar parcialmente para dar peróxido de hidrógeno, aunque este proceso no se ha comercializado. Una dificultad es evitar que los catalizadores desencadenen la descomposición del peróxido de hidrógeno para formar agua.
Aplicaciones industriales
La hidrogenación catalítica tiene diversos usos industriales. Con mayor frecuencia, la hidrogenación industrial se basa en catalizadores heterogéneos.
Industria de alimentos
La industria alimentaria hidrogena los aceites vegetales para convertirlos en grasas sólidas o semisólidas que se pueden utilizar en pastas para untar, dulces, productos horneados y otros productos como la margarina. Los aceites vegetales están hechos de ácidos grasos poliinsaturados (que tienen más de un doble enlace carbono-carbono). La hidrogenación elimina algunos de estos dobles enlaces.
Industria petroquímica
En los procesos petroquímicos, la hidrogenación se utiliza para convertir alquenos y compuestos aromáticos en alcanos saturados (parafinas) y cicloalcanos (naftenos), que son menos tóxicos y menos reactivos. Relevante para los combustibles líquidos que a veces se almacenan durante largos períodos en el aire, los hidrocarburos saturados exhiben propiedades de almacenamiento superiores. Por otro lado, los alquenos tienden a formar hidroperóxidos, los cuales pueden formar gomas que interfieren con el equipo de manejo de combustible. Por ejemplo, la trementina mineral suele estar hidrogenada. El hidrocraqueo de residuos pesados en diésel es otra aplicación. En los procesos de isomerización y reformado catalítico, se mantiene cierta presión de hidrógeno para hidrogenolizar el coque formado en el catalizador y evitar su acumulación.
Química Orgánica
La hidrogenación es un medio útil para convertir compuestos insaturados en derivados saturados. Los sustratos incluyen no solo alquenos y alquinos, sino también aldehídos, iminas y nitrilos.que se convierten en los correspondientes compuestos saturados, es decir, alcoholes y aminas. Por lo tanto, los aldehídos de alquilo, que se pueden sintetizar con el proceso oxo a partir de monóxido de carbono y un alqueno, se pueden convertir en alcoholes. Por ejemplo, el 1-propanol se produce a partir de propionaldehído, producido a partir de eteno y monóxido de carbono. El xilitol, un poliol, se produce por hidrogenación del azúcar xilosa, un aldehído. Las aminas primarias se pueden sintetizar por hidrogenación de nitrilos, mientras que los nitrilos se sintetizan fácilmente a partir de cianuro y un electrófilo adecuado. Por ejemplo, la isoforona diamina, un precursor del monómero de poliuretano isoforona diisocianato, se produce a partir de isoforona nitrilo mediante una hidrogenación de nitrilo en tándem/aminación reductora con amoníaco.
Hidrogenación del carbón
Historia
Hidrogenación catalítica heterogénea
La hidrogenación más antigua es la de la adición de hidrógeno al oxígeno catalizada por platino en la lámpara de Döbereiner, un dispositivo comercializado ya en 1823. El químico francés Paul Sabatier es considerado el padre del proceso de hidrogenación. En 1897, basándose en el trabajo anterior de James Boyce, un químico estadounidense que trabajaba en la fabricación de productos de jabón, descubrió que las trazas de níquel catalizaban la adición de hidrógeno a las moléculas de hidrocarburos gaseosos en lo que ahora se conoce como el proceso Sabatier. Por este trabajo, Sabatier compartió el Premio Nobel de Química de 1912. Wilhelm Normann obtuvo una patente en Alemania en 1902 y en Gran Bretaña en 1903 para la hidrogenación de aceites líquidos, que fue el comienzo de lo que ahora es una industria mundial. El proceso de Haber-Bosch comercialmente importante, descrito por primera vez en 1905, implica la hidrogenación del nitrógeno. En el proceso Fischer-Tropsch, informado en 1922, el monóxido de carbono, que se deriva fácilmente del carbón, se hidrogena a combustibles líquidos.
En 1922, Voorhees y Adams describieron un aparato para realizar la hidrogenación bajo presiones superiores a una atmósfera. El agitador Parr, el primer producto que permitió la hidrogenación utilizando presiones y temperaturas elevadas, se comercializó en 1926 según la investigación de Voorhees y Adams y sigue siendo de uso generalizado. En 1924, Murray Raney desarrolló una forma de níquel en polvo fino, que se usa ampliamente para catalizar reacciones de hidrogenación, como la conversión de nitrilos en aminas o la producción de margarina.
Hidrogenación catalítica homogénea
En la década de 1930, Calvin descubrió que los complejos de cobre (II) oxidaban H 2. La década de 1960 fue testigo del desarrollo de catalizadores homogéneos bien definidos utilizando complejos de metales de transición, por ejemplo, el catalizador de Wilkinson (RhCl(PPh 3) 3). Poco después se descubrió que el Rh y el Ir catiónicos catalizan la hidrogenación de alquenos y carbonilos. En la década de 1970, se demostró la hidrogenación asimétrica en la síntesis de L-DOPA, y la década de 1990 vio la invención de la hidrogenación asimétrica de Noyori. El desarrollo de la hidrogenación homogénea estuvo influenciado por el trabajo iniciado en las décadas de 1930 y 1940 sobre el proceso oxo y la polimerización Ziegler-Natta.
Hidrogenación sin metales
Para la mayoría de los propósitos prácticos, la hidrogenación requiere un catalizador metálico. Sin embargo, la hidrogenación puede proceder de algunos donantes de hidrógeno sin catalizadores, siendo los donantes de hidrógeno ilustrativos la diimida y el isopropóxido de aluminio, este último ilustrado por la reducción de Meerwein-Ponndorf-Verley. Algunos sistemas catalíticos libres de metales se han investigado en la investigación académica. Uno de tales sistemas para la reducción de cetonas consiste en terc -butanol y terc-butóxido de potasio y temperaturas muy altas. La reacción que se muestra a continuación describe la hidrogenación de la benzofenona:
Un estudio de cinética química encontró que esta reacción es de primer orden en los tres reactivos, lo que sugiere un estado de transición cíclico de 6 miembros.
Otro sistema para la hidrogenación libre de metales se basa en el compuesto 1 de fosfina-borano, que se ha denominado par de Lewis frustrado. Acepta de forma reversible dihidrógeno a temperaturas relativamente bajas para formar el borato de fosfonio 2 que puede reducir las iminas bloqueadas simples.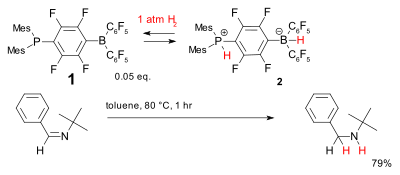
Se ha informado que la reducción de nitrobenceno a anilina está catalizada por el fullereno, su monoanión, el hidrógeno atmosférico y la luz ultravioleta.
Equipos utilizados para la hidrogenación
El químico de banco de hoy tiene tres opciones principales de equipos de hidrogenación:
- Hidrogenación discontinua en condiciones atmosféricas
- Hidrogenación por lotes a temperatura y/o presión elevadas
- Hidrogenación de flujo
Hidrogenación discontinua en condiciones atmosféricas
La forma de hidrogenación original y todavía practicada comúnmente en los laboratorios de enseñanza, este proceso generalmente se realiza agregando un catalizador sólido a un matraz de fondo redondo de reactivo disuelto que se ha evacuado usando nitrógeno o gas argón y sellando la mezcla con un sello de goma penetrable. Luego se suministra hidrógeno gaseoso desde un globo lleno de H2 . La mezcla trifásica resultante se agita para promover la mezcla. Se puede monitorear la absorción de hidrógeno, lo que puede ser útil para monitorear el progreso de una hidrogenación. Esto se logra utilizando un tubo graduado que contiene un líquido coloreado, generalmente sulfato de cobre acuoso, o con medidores para cada recipiente de reacción.
Hidrogenación por lotes a temperatura y/o presión elevadas
Dado que muchas reacciones de hidrogenación, como la hidrogenólisis de los grupos protectores y la reducción de los sistemas aromáticos, se desarrollan de manera extremadamente lenta a temperatura y presión atmosféricas, los sistemas presurizados son populares. En estos casos, el catalizador se agrega a una solución de reactivo bajo una atmósfera inerte en un recipiente a presión. El hidrógeno se agrega directamente desde un cilindro o una fuente de hidrógeno de laboratorio incorporada, y la suspensión presurizada se balancea mecánicamente para proporcionar agitación, o se usa una canasta giratoria. Los avances recientes en la tecnología de electrólisis han llevado al desarrollo de generadores de hidrógeno de alta presión, que generan hidrógeno hasta 100 bar (1400 PSI) a partir del agua. También se puede usar calor, ya que la presión compensa la reducción asociada en la solubilidad del gas.
Hidrogenación de flujo
La hidrogenación de flujo se ha convertido en una técnica popular en el banco y cada vez más a escala de proceso. Esta técnica implica el flujo continuo de una corriente diluida de reactivo disuelto sobre un catalizador de lecho fijo en presencia de hidrógeno. Usando tecnología HPLC establecida, esta técnica permite la aplicación de presiones desde la atmosférica hasta 1450 psi (100 bar). También se pueden usar temperaturas elevadas. A escala de banco, los sistemas utilizan una gama de catalizadores preenvasados que eliminan la necesidad de pesar y filtrar los catalizadores pirofóricos.
Reactores industriales
La hidrogenación catalítica se realiza en un reactor tubular de flujo pistón (PFR) lleno de un catalizador soportado. Las presiones y temperaturas suelen ser altas, aunque esto depende del catalizador. La carga de catalizador suele ser mucho menor que en la hidrogenación por lotes de laboratorio, y se agregan varios promotores al metal, o se usan metales mixtos, para mejorar la actividad, la selectividad y la estabilidad del catalizador. El uso del níquel es común a pesar de su baja actividad, debido a su bajo costo en comparación con los metales preciosos.
Los reactores de inducción de gas líquido (hidrogenador) también se utilizan para llevar a cabo la hidrogenación catalítica.
Contenido relacionado
Alcohol de azúcar
Enlace peptídico
Radio atómico
![{displaystyle {ce {{underset {nitrógeno}{N{equiv}N}}+{underset {hidrógeno atop (200atm)}{3H2}}->[{ce {Fecatalizador}} ][350-550^{circ }{ce {C}}]{underset {amoníaco}{2NH3}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dd5645111a3ad991987a7b9e10599029c287e98)