Hexano
El hexano es un compuesto orgánico, un alcano de cadena lineal con seis átomos de carbono y tiene la fórmula molecular C 6 H 14.
Es un líquido incoloro, inodoro cuando es puro y con puntos de ebullición de aproximadamente 69 °C (156 °F). Es ampliamente utilizado como un solvente no polar barato, relativamente seguro, en gran parte no reactivo y fácilmente evaporable, y las mezclas de gasolina modernas contienen aproximadamente un 3% de hexano.
El término hexanos se refiere a una mezcla compuesta en gran parte (>60 %) de hexano, con cantidades variables de los compuestos isoméricos 2-metilpentano y 3-metilpentano y, posiblemente, cantidades más pequeñas de compuestos no isoméricos C 5, C 6 y C 7 (ciclo)alcanos. Estos hexanos son más baratos que el hexano puro y se utilizan a menudo en operaciones a gran escala que no requieren un solo isómero (p. ej., como disolvente de limpieza o para cromatografía).
Isómeros
| Nombre común | nombre de la IUPAC | Fórmula de texto | fórmula esquelética |
|---|---|---|---|
| hexano normaln -hexano | hexano | CH 3 (CH 2) 4 CH 3 | |
| isohexano | 2-metilpentano | (CH 3) 2 CH (CH 2) 2 CH 3 | 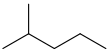 |
| 3-metilpentano | CH 3 CH 2 CH(CH 3)CH 2 CH 3 | 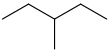 | |
| 2,3-dimetilbutano | (CH 3) 2 CH CH (CH 3) 2 | 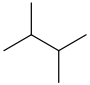 | |
| neohexano | 2,2-dimetilbutano | (CH 3) 3 CCH 2 CH 3 | 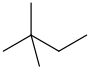 |
Usos
En la industria, los hexanos se utilizan en la formulación de colas para calzado, productos de cuero y techado. También se utilizan para extraer aceites de cocina (como el aceite de canola o el aceite de soja) de las semillas, para limpiar y desengrasar una variedad de artículos y en la fabricación de textiles. Se usan comúnmente en la extracción de aceite de soya a base de alimentos en los Estados Unidos y están potencialmente presentes como contaminantes en todos los productos alimenticios de soya en los que se usa la técnica; la falta de regulación por parte de la FDA de este contaminante es motivo de cierta controversia.
Un uso típico de laboratorio de los hexanos es extraer contaminantes de aceite y grasa del agua y el suelo para su análisis. Dado que el hexano no se puede desprotonar fácilmente, se usa en el laboratorio para reacciones que involucran bases muy fuertes, como la preparación de organolitios. Por ejemplo, los butillitios normalmente se suministran como una solución de hexano.
Los hexanos se utilizan comúnmente en cromatografía como disolvente no polar. Los alcanos superiores presentes como impurezas en los hexanos tienen tiempos de retención similares a los del solvente, lo que significa que las fracciones que contienen hexano también contendrán estas impurezas. En la cromatografía preparativa, la concentración de un gran volumen de hexanos puede dar como resultado una muestra que esté considerablemente contaminada con alcanos. Esto puede resultar en la obtención de un compuesto sólido en forma de aceite y los alcanos pueden interferir con el análisis.
Producción
Los hexanos se obtienen principalmente del refinado del petróleo crudo. La composición exacta de la fracción depende en gran medida de la fuente del aceite (crudo o reformado) y las limitaciones de la refinación. El producto industrial (generalmente alrededor del 50% en peso del isómero de cadena lineal) es la fracción que hierve a 65–70 °C (149–158 °F).
Propiedades físicas
Todos los alcanos son incoloros. Los puntos de ebullición de los diversos hexanos son algo similares y, como ocurre con otros alcanos, son generalmente más bajos para las formas más ramificadas. Los puntos de fusión son bastante diferentes y la tendencia no es aparente.
| isómero | PM (°C) | PM (°F) | PA (°C) | PA (°F) |
|---|---|---|---|---|
| n -hexano | −95,3 | −139,5 | 68.7 | 155.7 |
| 3-metilpentano | −118,0 | −180,4 | 63.3 | 145.9 |
| 2-metilpentano (isohexano) | −153,7 | −244,7 | 60.3 | 140.5 |
| 2,3-dimetilbutano | −128,6 | −199,5 | 58.0 | 136.4 |
| 2,2-dimetilbutano (neohexano) | −99,8 | −147,6 | 49.7 | 121.5 |
El hexano tiene una presión de vapor considerable a temperatura ambiente:
| Temperatura (°C) | Temperatura (°F) | Presión de vapor (mmHg) | Presión de vapor (kPa) |
|---|---|---|---|
| −40 | −40 | 3.36 | 0.448 |
| −30 | −22 | 7.12 | 0.949 |
| −20 | −4 | 14.01 | 1.868 |
| −10 | 14 | 25.91 | 3.454 |
| 0 | 32 | 45.37 | 6.049 |
| 10 | 50 | 75.74 | 10.098 |
| 20 | 68 | 121.26 | 16.167 |
| 25 | 77 | 151.28 | 20.169 |
| 30 | 86 | 187.11 | 24.946 |
| 40 | 104 | 279.42 | 37.253 |
| 50 | 122 | 405.31 | 54.037 |
| 60 | 140 | 572.76 | 76.362 |
Reactividad
Como la mayoría de los alcanos, el hexano exhibe característicamente una baja reactividad y es un solvente adecuado para los compuestos reactivos. Sin embargo, las muestras comerciales de n-hexano a menudo contienen metilciclopentano, que presenta enlaces CH terciarios, que son incompatibles con algunas reacciones radicales.
La seguridad
La inhalación de n -hexano a 5000 ppm durante 10 minutos produce un marcado vértigo; 2500-1000 ppm durante 12 horas produce somnolencia, fatiga, pérdida de apetito y parestesia en las extremidades distales; 2500–5000 ppm produce debilidad muscular, pulsación fría en las extremidades, visión borrosa, dolor de cabeza y anorexia. Se ha demostrado que la exposición ocupacional crónica a niveles elevados de n-hexano está asociada con neuropatía periférica en mecánicos automotrices en los EE. UU. y neurotoxicidad en trabajadores de imprentas y fábricas de muebles y calzado en Asia, Europa y América del Norte.
El Instituto Nacional de Seguridad y Salud Ocupacional de EE. UU. (NIOSH) ha establecido un límite de exposición recomendado (REL) para los isómeros de hexano (no n-hexano) de 100 ppm (350 mg/m (0,15 gr/pies cúbicos)) durante un período de 8- hora de la jornada laboral. Sin embargo, para el n-hexano, el NIOSH REL actual es de 50 ppm (180 mg/m (0,079 gr/pies cúbicos)) durante una jornada laboral de 8 horas. Este límite fue propuesto como límite de exposición permisible (PEL) por la Administración de Salud y Seguridad Ocupacional en 1989; sin embargo, este PEL fue anulado en los tribunales de EE. UU. en 1992. El PEL actual de n-hexano en EE. UU. es de 500 ppm (1800 mg/m3 (0,79 gr/pies cúbicos)).
El hexano y otros hidrocarburos volátiles (éter de petróleo) presentan riesgo de aspiración. El n -hexano se utiliza a veces como desnaturalizante del alcohol y como agente de limpieza en las industrias textil, del mueble y del cuero. Está siendo reemplazado lentamente por otros solventes.
Al igual que la gasolina, el hexano es altamente volátil y presenta riesgo de explosión. La ignición de vapores de hexano vertidos ilegalmente en las alcantarillas de Louisville (Kentucky) desde una planta procesadora de soja propiedad de Ralston-Purina provocó una serie de explosiones que destruyeron más de 21 km de alcantarillado y calles de esa ciudad.
Incidentes
El envenenamiento ocupacional con hexano ha ocurrido con trabajadores de sandalias japoneses, trabajadores de zapatos italianos, trabajadores de pruebas de prensa de Taiwán y otros. El análisis de los trabajadores taiwaneses ha mostrado exposición ocupacional a sustancias, incluido el n -hexano. En 2010-2011, se informó que los trabajadores chinos que fabricaban iPhones sufrieron intoxicación por hexano.
El hexano fue identificado como la causa de las explosiones de alcantarillado de Louisville el 13 de febrero de 1981, que destruyeron más de 13 millas (21 km) de líneas de alcantarillado y calles en el centro de Louisville en Kentucky, Estados Unidos.
Biotransformación
El n -hexano se biotransforma en 2-hexanol y luego en 2,5-hexanodiol en el cuerpo. La conversión es catalizada por la enzima citocromo P450 que utiliza oxígeno del aire. El 2,5-hexanodiol puede oxidarse aún más a 2,5-hexanodiona, que es neurotóxico y produce una polineuropatía. En vista de este comportamiento, se ha discutido la sustitución del n -hexano como disolvente. El n -heptano es una posible alternativa.
Contenido relacionado
Pentosa
Estricnina
Ciencia de la superficie