HER2
Receptor tirosina-proteína quinasa ERBB-2 es una proteína que normalmente reside en las membranas de las células y está codificada por el gen Erbb2 . ERBB se abrevia del oncogene B eritroblástico B, un gen originalmente aislado del genoma aviar. La proteína humana también se conoce con frecuencia como HER2 (receptor de factor de crecimiento epidérmico humano 2) o CD340 (grupo de diferenciación 340).
HER2 es miembro de la familia del receptor del factor de crecimiento epidérmico humano (HER/EGFR/ERBB). Pero al contrario de otros miembros de la familia Erbb, HER2 no une directamente el ligando. La activación de HER2 resulta de la heterodimerización con otro miembro de ERBB o por homodimerización cuando la concentración de HER2 es alta, por ejemplo, en cáncer. Se ha demostrado que la amplificación o sobreexpresión de este oncogén juegan un papel importante en el desarrollo y la progresión de ciertos tipos agresivos de cáncer de mama. En los últimos años, la proteína se ha convertido en un importante biomarcador y el objetivo de la terapia para aproximadamente el 30% de los pacientes con cáncer de mama.
nombre
HER2 se llama así porque tiene una estructura similar al receptor del factor de crecimiento epidérmico humano, o HER1. neu se llama así porque se derivó de una línea celular de glioblastoma de roedores, un tipo de tumor neural. Erbb-2 fue nombrado por su similitud con erbb (oncogén de eritroblastosis aviar b), el oncogén más tarde se encuentra en código para EGFR. La clonación molecular del gen mostró que HER2, Neu y Erbb-2 están codificados por los mismos ortólogos.
gen
Erbb2 , un proto-oncogén conocido, se encuentra en el brazo largo del cromosoma humano 17 (17q12).
function
La familia Erbb consta de cuatro receptor de membrana plasmática individual tirosina quinasas. Uno de los cuales es ERBB-2, y los otros miembros son ERBB-1, ERBB-3 (unión a neuregulina; carece de dominio de quinasa) y ERBB-4. Los cuatro contienen un dominio de unión al ligando extracelular, un dominio transmembrana y un dominio intracelular que puede interactuar con una multitud de moléculas de señalización y exhibir la actividad dependiente de ligando e independiente del ligando. En particular, aún no se han identificado ligandos para HER2. HER2 puede heterodimerizar con cualquiera de los otros tres receptores y se considera el compañero de dimerización preferido de los otros receptores ERBB.
Ladimerización da como resultado la autofosforilación de residuos de tirosina dentro del dominio citoplasmático de los receptores e inicia una variedad de vías de señalización.
Transducción de señal
Las vías de señalización activadas por HER2 incluyen:
- kinasa de proteína activada por mitogen (MAPK)
- fosfoinositida 3-kinasa (PI3K/Akt)
- fosfolipasa C γ
- protein kinase C (PKC)
- Transductor de señas y activador de transcripción (STAT)
En resumen, la señalización a través de la familia de receptores ErbB promueve la proliferación celular y se opone a la apoptosis y, por lo tanto, debe regularse estrechamente para evitar que se produzca un crecimiento celular descontrolado.
Significado clínico
Cancer
Laamplificación , también conocida como la sobreexpresión del gen erbb2 , ocurre en aproximadamente el 15-30% de los cánceres de seno. Los cánceres de seno positivos para HER2 están bien establecidos como asociados con una mayor recurrencia de la enfermedad y un mal pronóstico en comparación con otros cánceres de seno genéticamente distintos genéticamente con otros marcadores genéticos conocidos o falta de ellos que se cree que están asociados con otros cánceres de seno; Sin embargo, los agentes farmacológicos dirigidos a HER2 en el cáncer de mama han alterado significativamente y positivamente el mal pronóstico de las dificultades históricamente problemáticas asociadas con el cáncer de mama HER2 positivo. También se sabe que la sobreexpresión ocurre en el ovario, el estómago, el adenocarcinoma del pulmón y las formas agresivas de cáncer uterino, como el carcinoma endometrial seroso uterino, p. HER2 se sobreexpresa en aproximadamente el 7-34% de los pacientes con cáncer gástrico y en el 30% de los carcinomas de conductos salivales.
HER2 es colocalizado y la mayoría de las veces, coamplifica con el gen GRB7, que es un protooncogen asociado con tumores de células germinales, gástricas y esofágicas de mama, testicular.
Se ha demostrado que lasproteínas HER2 forman grupos en las membranas celulares que pueden desempeñar un papel en la tumorigénesis.
La evidencia también ha implicado la señalización de HER2 en la resistencia al cetuximab de cáncer dirigido por EGFR.
La alta expresión de HER2 se correlaciona con una mejor supervivencia en el adenocarcinoma esofágico.
La alta amplificación del número de copias de HER2 contribuye positivamente al tiempo de supervivencia de los pacientes con adenocarcinoma de cardias gástrico.
Mutaciones
Además, se han identificado diversas alteraciones estructurales que provocan la activación de este receptor de forma independiente del ligando, en ausencia de sobreexpresión del receptor. HER2 se encuentra en una variedad de tumores y algunos de estos tumores portan mutaciones puntuales en la secuencia que especifica el dominio transmembrana de HER2. La sustitución de una valina por un ácido glutámico o una glutamina en el dominio transmembrana puede dar como resultado la dimerización constitutiva de esta proteína en ausencia de un ligando.
Se han encontrado mutaciones en HER2 en cánceres de pulmón de células no pequeñas (NSCLC) y pueden dirigir el tratamiento.
Como objetivo farmacológico
HER2 es el objetivo del anticuerpo monoclonal trastuzumab (comercializado como Herceptin). Trastuzumab es eficaz sólo en cánceres en los que HER2 está sobreexpresado. Se recomienda un año de tratamiento con trastuzumab para todas las pacientes con cáncer de mama HER2 positivo que también reciben quimioterapia. Lo óptimo es doce meses de tratamiento con trastuzumab. Los ensayos aleatorios no han demostrado ningún beneficio adicional más allá de 12 meses, mientras que se ha demostrado que 6 meses son inferiores a 12. Trastuzumab se administra por vía intravenosa semanalmente o cada 3 semanas.
Un efecto posterior importante de la unión de trastuzumab a HER2 es un aumento de p27, una proteína que detiene la proliferación celular. Otro anticuerpo monoclonal, el pertuzumab, que inhibe la dimerización de los receptores HER2 y HER3, fue aprobado por la FDA para su uso en combinación con trastuzumab en junio de 2012.
A partir de noviembre de 2015, hay una serie de ensayos clínicos en curso y recientemente completados de nuevos agentes dirigidos para el cáncer de mama metastásico HER2+, p. margetuximab.
Además, NeuVax (Galena Biopharma) es una inmunoterapia basada en péptidos que dirige el efecto "asesino" Células T para atacar y destruir las células cancerosas que expresan HER2. Ha entrado en la fase 3 de ensayos clínicos.
Se ha descubierto que los pacientes con cáncer de mama ER+ (receptor de estrógeno positivo)/HER2+ en comparación con los cánceres de mama ER-/HER2+ pueden en realidad beneficiarse más de los medicamentos que inhiben la vía molecular PI3K/AKT.
La sobreexpresión de HER2 también puede suprimirse mediante la amplificación de otros genes. Actualmente se están realizando investigaciones para descubrir qué genes pueden tener este efecto deseado.
La expresión de HER2 está regulada mediante señales a través de receptores de estrógeno. Normalmente, el estradiol y el tamoxifeno, que actúan a través del receptor de estrógeno, regulan negativamente la expresión de HER2. Sin embargo, cuando la proporción del coactivador AIB-3 excede la del correpresor PAX2, la expresión de HER2 aumenta en presencia de tamoxifeno, lo que conduce a un cáncer de mama resistente al tamoxifeno.
Entre las terapias anti-HER2 aprobadas también se encuentran los inhibidores de la tirosina quinasa (Lapatinib, Neratinib y Tucatinib) y los conjugados anticuerpo-fármaco (ado-trastuzumab emtansina y trastuzumab deruxtecan).

Diagnóstico
La prueba de HER2 se realiza en la biopsia de mama de pacientes con cáncer de mama para evaluar el pronóstico y determinar la idoneidad del tratamiento con trastuzumab. Es importante que trastuzumab se limite a personas con HER2 positivo, ya que es costoso y se ha asociado con toxicidad cardíaca. Para los tumores HER2 positivos, los beneficios del trastuzumab superan claramente los riesgos.
Las pruebas generalmente se realizan en muestras de biopsia de mama obtenidas mediante aspiración con aguja fina, biopsia con aguja gruesa, biopsia de mama asistida por vacío o escisión quirúrgica.
inmunohistoquímica (IHC) generalmente se usa para medir la cantidad de proteína HER2 presente en la muestra, con la hibridación de fluorescencia in situ (pez) que se usa en muestras que son equívocas en IHC. Sin embargo, en varios lugares, el pescado se usa inicialmente, seguido de IHC en casos equívocos.
inmunohistoquímica
Mediante inmunohistoquímica, la muestra recibe una puntuación basada en el patrón de tinción de la membrana celular.
| Puntuación | Patrón | Situación |
|---|---|---|
| 0 | Cualquier cosa:
| HER2 negativo (no está presente) |
| 1+ | Tinificación de membrana incompleta que es débil o apenas perceptible y dentro de √10% de las células tumorales invasivas. | |
| 2+ | Mancha de membrana completa débil a moderada observada en >10% de las células tumorales. | Borderline/Equivocal |
| 3+ | La tinción de membrana Circumferential que es completa, intensa, y en √≥10% de las células tumorales. | HER2 positivo |
Micrografías que muestran cada partitura:
- 0
- 1+
- 2+
- 3+
Fluorescencia hibridación in situ
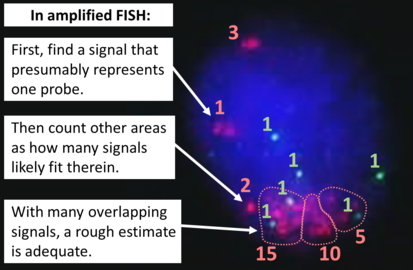
Los peces se pueden usar para medir el número de copias del gen que están presentes y se cree que es más confiable que la inmunohistoquímica. Por lo general, usa la sonda de enumeración cromosómica 17 (CEP17) para contar la cantidad de cromosomas. Por lo tanto, la relación HER2/CEP17 refleja cualquier amplificación de HER2 en comparación con el número de cromosomas. Las señales de 20 células generalmente se cuentan.
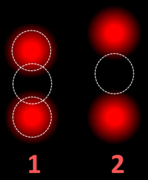
- Esta célula muestra 2 señales de HER2 (rojo) y 3 señales de CEP17 (verde)
- Dos señales que están más cerca uno del otro que el diámetro de la señal cuentan como uno.
- Una de estas señales es demasiado débil, y es presumiblemente escombros.
- Las células con sólo un tipo de señal están excluidas de la cuenta.
- Las células superpuestas también están excluidas de la cuenta.
- Una señal amarilla cuenta como una roja y una verde (que están superpuestas)
- Algoritmo para la evaluación de HER2 sobre la hibridación in situ de fluorescencia (FISH).
| ratio HER2/CEP17 | |||
|---|---|---|---|
| ≥2.0 | . | ||
| Número medio de copia HER2 por celda | ≥4.0 | HER2 positivo | Trabajo adicional necesario |
| ■4.0 | Trabajo adicional necesario | HER2 negativo | |
Si el resultado inicial de HER2 es negativo para una biopsia con aguja de un cáncer de mama primario, se puede realizar una nueva prueba de HER2 en la escisión de mama posterior.
Suero
El dominio extracelular de HER2 puede desprenderse de la superficie de las células tumorales y entrar en la circulación. La medición del HER2 sérico mediante ensayo inmunoabsorbente ligado a enzimas (ELISA) ofrece un método mucho menos invasivo para determinar el estado de HER2 que una biopsia y, en consecuencia, se ha investigado ampliamente. Los resultados hasta ahora han sugerido que los cambios en las concentraciones séricas de HER2 pueden ser útiles para predecir la respuesta al tratamiento con trastuzumab. Sin embargo, su capacidad para determinar la elegibilidad para el tratamiento con trastuzumab es menos clara.
Interacciones
Se ha demostrado que HER2/neu interactúa con:
- CTNNB1,
- DLG4,
- Erbin,
- GRB2,
- HSP90AA1,
- IL6ST,
- MUC1,
- PICK1 y
- PIK3R2,
- PLCG1, y
- SHC1.









![Algorithm for the evaluation of HER2 on fluorescence in situ hybridization (FISH).[46]](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d2/HER2_FISH_algorithm.svg/579px-HER2_FISH_algorithm.svg.png)