Hemo
Heme, o haem (pronunciado /hi:m/ HEEM), es un precursor de la hemoglobina, que es necesaria para unir el oxígeno en el torrente sanguíneo. El hemo se biosintetiza tanto en la médula ósea como en el hígado.
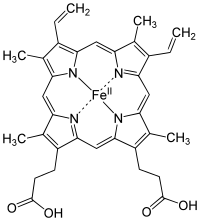
En términos bioquímicos, el hemo es un complejo de coordinación "que consta de un ion de hierro coordinado con una porfirina que actúa como ligando tetradentado y con uno o dos ligandos axiales". La definición es vaga y muchas representaciones omiten los ligandos axiales. Entre las metaloporfirinas desplegadas por las metaloproteínas como grupos protésicos, el hemo es uno de los más utilizados y define una familia de proteínas conocidas como hemoproteínas. Los hemo se reconocen más comúnmente como componentes de la hemoglobina, el pigmento rojo de la sangre, pero también se encuentran en otras hemoproteínas biológicamente importantes, como la mioglobina, los citocromos, las catalasas, la hemo peroxidasa y la óxido nítrico sintasa endotelial.
La palabra haem se deriva del griego αἷμα haima que significa "sangre".
Función
Las hemoproteínas tienen diversas funciones biológicas, incluido el transporte de gases diatómicos, la catálisis química, la detección de gases diatómicos y la transferencia de electrones. El hierro hemo sirve como fuente o sumidero de electrones durante la transferencia de electrones o la química redox. En las reacciones de peroxidasa, la molécula de porfirina también sirve como fuente de electrones, pudiendo deslocalizar electrones radicales en el anillo conjugado. En el transporte o detección de gases diatómicos, el gas se une al hierro hemo. Durante la detección de gases diatómicos, la unión del ligando gaseoso al hierro hemo induce cambios conformacionales en la proteína circundante. En general, los gases diatómicos solo se unen al hemo reducido, como Fe(II) ferroso, mientras que la mayoría de las peroxidasas circulan entre Fe(III) y Fe(IV) y las hemoproteínas involucradas en la oxidación-reducción mitocondrial, circulan entre Fe(II) y Fe(II). Fe(III).
Se ha especulado que la función evolutiva original de las hemoproteínas fue la transferencia de electrones en vías primitivas de fotosíntesis basadas en azufre en organismos ancestrales similares a las cianobacterias antes de la aparición del oxígeno molecular.
Las hemoproteínas logran su notable diversidad funcional modificando el entorno del macrociclo hemo dentro de la matriz proteica. Por ejemplo, la capacidad de la hemoglobina para llevar oxígeno a los tejidos de manera efectiva se debe a los residuos de aminoácidos específicos ubicados cerca de la molécula de hemo. La hemoglobina se une reversiblemente al oxígeno en los pulmones cuando el pH es alto y la concentración de dióxido de carbono es baja. Cuando la situación se invierte (pH bajo y concentraciones altas de dióxido de carbono), la hemoglobina liberará oxígeno en los tejidos. Este fenómeno, que establece que la afinidad de unión al oxígeno de la hemoglobina es inversamente proporcional tanto a la acidez como a la concentración de dióxido de carbono, se conoce como efecto Bohr. El mecanismo molecular detrás de este efecto es la organización estérica de la cadena de globina; un residuo de histidina, ubicado junto al grupo hemo, se carga positivamente en condiciones ácidas (causadas por el CO2 disuelto en los músculos activos, etc.), liberando oxígeno del grupo hemo.
Tipos
Hemos principales
Hay varios tipos de hemo biológicamente importantes:
El tipo más común es el hemo B; otros tipos importantes incluyen heme A y heme C. Los hem aislados se designan comúnmente con letras mayúsculas, mientras que los hem unidos a proteínas se designan con letras minúsculas. El citocromo a se refiere al hemo A en combinación específica con la proteína de membrana que forma una porción de la citocromo c oxidasa.
Otros hemos
- El siguiente sistema de numeración de carbono de porfirinas es un número mayor utilizado por los bioquímicos y no el sistema de numeración 1–24 recomendado por el IUPAC que se muestra en la tabla anterior.
- Heme l es el derivado de heme B que está covalentemente ligado a la proteína de lactoperoxidase, peróxido de eosinofílico y peróxido de tiroides. La adición de peróxido con el glutamyl-375 y aspartyl-225 de lactoperoxidase forma los vínculos ester entre estos residuos de aminoácidos y los grupos heme 1- y 5-metilo, respectivamente. Se cree que los vínculos ester similares con estos dos grupos de metil se forman en peróxidos eosinofílicos y tiroideos. Heme l es una característica importante de las peroxidasas animales; las peróxidos vegetales incorporan el heme B. Lactoperoxidase y la peróxido de eosinofílico son enzimas protectoras responsables de la destrucción de bacterias y virus invasores. La peroxidasis tiroidea es la enzima que cataliza la biosíntesis de las hormonas tiroideas importantes. Debido a que lactoperoxidasa destruye organismos invasores en los pulmones y el excremento, se cree que es una enzima protectora importante.
- Heme m es el derivado de heme B covalentemente ligado en el sitio activo de mieloperoxidase. Heme m contiene los dos bonos ester en los grupos heme 1- y 5-metil también presentes en heme l de otras peroxidasas mamíferas, como la lactoperoxidasa y la peróxido de eosinofílico. Además, se forma una unión única de iones de sulfonamida entre el azufre de un residuo de aminoácidos de metionilo y el grupo de hemo 2-vinilo, dando a esta enzima la capacidad única de oxidar fácilmente iones de cloruro y bromuro a hipoclorito e hipobromita. Mieloperoxidase está presente en neutrófilos mamíferos y es responsable de la destrucción de bacterias invasoras y agentes virales. Tal vez sintetiza hipobromita por "error". Tanto hipoclorito como hipobromita son especies muy reactivas responsables de la producción de núcleos halogenados, que son compuestos mutagénicos.
- Heme D es otro derivado de heme B, pero en el que la cadena de ácido propionico en el carbono de la posición 6, que también es hidroxilada, forma una γ-spirolactona. El anillo III también se hidroxila en la posición 5, en una conformación trans al nuevo grupo de lactona. Heme D es el sitio para la reducción de oxígeno al agua de muchos tipos de bacterias a baja tensión de oxígeno.
- Heme S está relacionado con el heme B por tener un grupo formal en la posición 2 en lugar del grupo 2-vinilo. Heme S se encuentra en la hemoglobina de algunas especies de gusanos marinos. Las estructuras correctas de heme B y heme S fueron esclarecidas por primera vez por el químico alemán Hans Fischer.
Los nombres de los citocromos normalmente (pero no siempre) reflejan los tipos de hemo que contienen: el citocromo a contiene el hemo A, el citocromo c contiene el hemo C, etc. Es posible que esta convención se haya introducido por primera vez con la publicación de la estructura del hemo A.
Uso de letras mayúsculas para designar el tipo de hemo
La práctica de designar a los hemo con letras mayúsculas se formalizó en una nota a pie de página en un artículo de Puustinen y Wikstrom que explica bajo qué condiciones se debe usar una letra mayúscula: "preferimos el uso de letras mayúsculas para describir el estructura hemo aislada. Las letras minúsculas se pueden usar libremente para citocromos y enzimas, así como para describir grupos hemo unidos a proteínas individuales (por ejemplo, complejos de citocromo bc y aa3, citocromo b5, hemo c 1 del complejo bc1, hemo a3 del complejo aa3, etc.)" En otras palabras, el compuesto químico se designaría con letra mayúscula, pero las instancias específicas en estructuras con minúscula. Así, la citocromo oxidasa, que tiene dos hem A (hem a y hem a3) en su estructura, contiene dos moles de hem A por mol de proteína. El citocromo bc1, con los hemos bH, bL y c1, contiene hemo B y hemo C en una proporción de 2:1. La práctica parece haberse originado en un artículo de Caughey y York en el que el producto de un nuevo procedimiento de aislamiento para el grupo hemo del citocromo aa3 se denominó hemo A para diferenciarlo de preparaciones anteriores: "Nuestro producto no es idéntico en todos los aspectos". respeta con el hemo a obtenido en solución por otros trabajadores por la reducción de la hemina a como se aisló anteriormente (2). Por esta razón, designaremos nuestro producto hemo A hasta que las diferencias aparentes puedan ser racionalizadas.". En un artículo posterior, el grupo de Caughey usa letras mayúsculas para los hemo B y C aislados, así como para A.
Síntesis
El proceso enzimático que produce el hemo se denomina propiamente síntesis de porfirinas, ya que todos los intermedios son tetrapirroles que se clasifican químicamente como porfirinas. El proceso está muy conservado en toda la biología. En humanos, esta vía sirve casi exclusivamente para formar hemo. En las bacterias también produce sustancias más complejas como el cofactor F430 y la cobalamina (vitamina B12).
La ruta se inicia con la síntesis de ácido δ-aminolevulínico (dALA o δALA) a partir del aminoácido glicina y succinil-CoA del ciclo del ácido cítrico (ciclo de Krebs). La enzima limitante de la velocidad responsable de esta reacción, ALA sintasa, está regulada negativamente por la concentración de glucosa y hemo. El mecanismo de inhibición de los ALA por el hemo o la hemina es la disminución de la estabilidad de la síntesis de ARNm y la disminución de la ingesta de ARNm en las mitocondrias. Este mecanismo tiene importancia terapéutica: la infusión de arginato de hemo o hematina y glucosa puede abortar ataques de porfiria aguda intermitente en pacientes con un error congénito del metabolismo de este proceso, al reducir transcripción de ALA sintasa.
Los órganos principalmente implicados en la síntesis de hemo son el hígado (en el que la tasa de síntesis es muy variable, dependiendo de la reserva sistémica de hemo) y la médula ósea (en la que la tasa de síntesis de hemo es relativamente constante y depende de la producción de cadena de globina), aunque cada célula requiere hemo para funcionar correctamente. Sin embargo, debido a sus propiedades tóxicas, proteínas como la Hemopexina (Hx) son necesarias para ayudar a mantener las reservas fisiológicas de hierro para poder utilizarlas en la síntesis. El hemo se considera una molécula intermedia en el catabolismo de la hemoglobina en el proceso del metabolismo de la bilirrubina. Los defectos en varias enzimas en la síntesis de hemo pueden conducir a un grupo de trastornos llamados porfirias, que incluyen porfiria aguda intermitente, porfiria eritropoyética congénita, porfiria cutánea tardía, coproporfiria hereditaria, porfiria variegata, protoporfiria eritropoyética.
Síntesis para alimentos
Impossible Foods, productores de sustitutos de la carne a base de plantas, utiliza un proceso acelerado de síntesis de hemo que involucra leghemoglobina de raíz de soja y levadura, agregando el hemo resultante a productos como las hamburguesas Impossible sin carne (veganas). El ADN para la producción de leghemoglobina se extrajo de los nódulos de la raíz de soja y se expresó en células de levadura para producir hemo en exceso para su uso en las hamburguesas sin carne. Este proceso pretende crear un sabor a carne en los productos resultantes.
Degradación
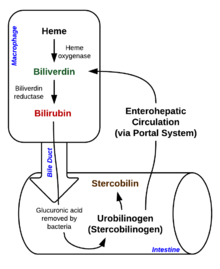
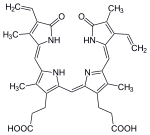
La degradación comienza dentro de los macrófagos del bazo, que eliminan los eritrocitos viejos y dañados de la circulación. En el primer paso, el hemo se convierte en biliverdina por la enzima hemo oxigenasa (HO). El NADPH se utiliza como agente reductor, el oxígeno molecular entra en la reacción, se produce monóxido de carbono (CO) y el hierro se libera de la molécula como ion ferroso (Fe2+). El CO actúa como mensajero celular y funciona en la vasodilatación.
Además, la degradación del hemo parece ser una respuesta conservada evolutivamente al estrés oxidativo. Brevemente, cuando las células se exponen a los radicales libres, se produce una rápida inducción de la expresión de la isoenzima hemooxigenasa-1 (HMOX1) que responde al estrés y que cataboliza el hemo (véase más adelante). La razón por la que las células deben aumentar exponencialmente su capacidad para degradar el hemo en respuesta al estrés oxidativo sigue sin estar clara, pero parece ser parte de una respuesta citoprotectora que evita los efectos nocivos del hemo libre. Cuando se acumulan grandes cantidades de hemo libre, los sistemas de desintoxicación/degradación del hemo se ven abrumados, lo que permite que el hemo ejerza sus efectos dañinos.
| heme | heme oxígenoase-1 | biliverdin + Fe2+ | |
 |  | ||
| H+ + NADPH + O2 | NADP+ + CO | ||
 | |||
En la segunda reacción, la biliverdina reductasa (BVR) convierte la biliverdina en bilirrubina:
| biliverdin | biliverdin reductase | bilirubin | |
 |  | ||
| H+ + NADPH | NADP+ | ||
 | |||
La bilirrubina se transporta al hígado mediante difusión facilitada unida a una proteína (albúmina sérica), donde se conjuga con ácido glucurónico para volverse más soluble en agua. La reacción es catalizada por la enzima UDP-glucuronosiltransferasa.
| bilirubin | UDP-glucuronosyltransferase | bilirubin diglucuronide | |
 |  | ||
| 2 UDP-glucuronide | 2 UMP + 2 Pi | ||
 | |||
Esta forma de bilirrubina se excreta del hígado en la bilis. La excreción de bilirrubina del hígado a los canalículos biliares es un proceso activo, dependiente de energía y limitante de la velocidad. Las bacterias intestinales desconjugan el diglucurónido de bilirrubina y la convierten en urobilinógenos. Parte del urobilinógeno es absorbido por las células intestinales y transportado a los riñones y excretado con la orina (urobilina, que es el producto de la oxidación del urobilinógeno y es responsable del color amarillo de la orina). El resto viaja por el tracto digestivo y se convierte en estercobilinógeno. Esta se oxida a estercobilina, que se excreta y es responsable del color marrón de las heces.
En salud y enfermedad
Bajo homeostasis, la reactividad del hemo está controlada por su inserción en los "bolsillos de hemo" de las hemoproteínas. Sin embargo, bajo estrés oxidativo, algunas hemoproteínas, p. hemoglobina, pueden liberar sus grupos prostéticos hemo. El hemo no unido a proteínas (libre) producido de esta manera se vuelve altamente citotóxico, muy probablemente debido al átomo de hierro contenido dentro de su anillo de protoporfirina IX, que puede actuar como un reactivo de Fenton para catalizar de manera ilimitada el producción de radicales libres. Cataliza la oxidación y agregación de proteínas, la formación de peróxido de lípidos citotóxicos a través de la peroxidación de lípidos y daña el ADN a través del estrés oxidativo. Debido a sus propiedades lipofílicas, altera las bicapas lipídicas en orgánulos como las mitocondrias y los núcleos. Estas propiedades del hemo libre pueden sensibilizar a una variedad de tipos de células para que sufran muerte celular programada en respuesta a los agonistas proinflamatorios, un efecto nocivo que juega un papel importante en la patogénesis de ciertas enfermedades inflamatorias como la malaria y la sepsis.
Cáncer
Existe una asociación entre el alto consumo de hierro hemo procedente de la carne y un mayor riesgo de cáncer de colon. El contenido de hemo de la carne roja es 10 veces mayor que el de la carne blanca como el pollo.
El Instituto Estadounidense para la Investigación del Cáncer (AICR) y el Fondo Internacional para la Investigación del Cáncer (WCRF) concluyeron en un informe de 2018 que existe evidencia limitada pero sugestiva de que los alimentos que contienen hierro hemo aumentan el riesgo de cáncer colorrectal. Una revisión de 2019 encontró que la ingesta de hierro hemo está asociada con un mayor riesgo de cáncer de mama.
Genes
Los siguientes genes son parte de la ruta química para producir hemo:
- ALAD: aminolevulinic acid, δ-, dehydratase (deficiencia causa ala-dehidratase deficiencia porphyria)
- ALAS1: aminolevulinato, δ-, sinthase 1
- ALAS2: aminolevulinato, δ-, sinthase 2 (deficiencia causa anemia sideroblástica/hipocromo)
- CPOX: coproporfirinogen oxidase (deficiencia causa coproporfiria hereditaria)
- FECH: ferrochelatase (deficiencia causa protoporfiria eritropoyética)
- HMBS: sintase hidroximetilbilano (deficiencia causa porfiria intermitente aguda)
- PPOX: protoporfirinogen oxidase (deficiencia causa variegate porphyria)
- UROD: uroporphyrinogen decarboxylase (deficiencia causa porphyria cutanea tarda)
- UROS: uroporphyrinogen III synthase (deficiency causes congenital erythropoietic porphyria)
Notas y referencias
- ^ Bloomer, Joseph R. (1998). "Pever metabolismo de las porfirinas y el haem". Journal of Gastroenterology and Hepatology. 13 (3): 324–329. doi:10.1111/j.1440-1746.1998.01548.x. PMID 9570250. S2CID 25224821.
- ^ Chemistry, International Union of Pure and Applied (2009). "Hemes (heme derivatives)". Compendio IUPAC de Terminología Química. iupac.org. IUPAC. doi:10.1351/goldbook.H02773. ISBN 978-0-9678550-9-7. Archivado desde el original el 22 de agosto de 2017. Retrieved 28 de abril 2018.
- ^ Un texto de bioquímica estándar define el heme como el "grupo protésico de hierro-porfirina de proteínas hema" (Nelson, D. L.; Cox, M. "Lehninger, Principios de Bioquímica" 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.)
- ^ Poulos, Thomas L. (2014-04-09). "Heme Enzyme Structure and Function". Reseñas químicas. 114 (7): 3919–3962. doi:10.1021/cr400415k. ISSN 0009-2665. PMC3981943. PMID 24400737.
- ^ Paoli, M. (2002). "Structure-function relationships in heme-proteins" (PDF). DNA Cell Biol. 21 (4): 271–280. doi:10.1089/104454902753759690. hdl:20.500.11820/67200894-eb9f-47a2-9542-02877d41fdd7. PMID 12042067. S2CID 12806393. Archivado (PDF) del original en 2018-07-24.
- ^ Alderton, W.K. (2001). "Sintéticos de óxido nítrico: estructura, función e inhibición". Biochem. J. 357 (3): 593-615. doi:10.1042/bj3570593. PMC1221991. PMID 11463332.
- ^ Milani, M. (2005). " Bases estructurales para el reconocimiento de ligandos heme y diatómicos en hemoglobinas truncadas". J. Inorg. Biochem. 99 (1): 97–109. doi:10.1016/j.jinorgbio.2004.10.035. PMID 15598494.
- ^ Hardison, R. (1999). "La evolución de la hemoglobina: Estudios de una proteína muy antigua sugieren que los cambios en la regulación de genes son una parte importante de la historia evolutiva". American Scientist. 87 (2): 126. doi:10.1511/1999.20.809.
- ^ Poulos, T. (2014). "Heme Enzyme Structure and Function". Chem. Rev. 114 (7): 3919–3962. doi:10.1021/cr400415k. PMC3981943. PMID 24400737.
- ^ Thom, C. S. (2013). "Hemoglobina Variantes: Propiedades bioquímicas y correlatos clínicos". Cold Spring Harbor Perspectives in Medicine. 3 (3): a011858. doi:10.1101/cshperspect.a011858. PMC3579210. PMID 23388674.
- ^ Bohr; Hasselbalch, Krogh. "Concertar una relación biológicamente importante - La influencia del contenido de Dióxido de carbono de la sangre en su unión de oxígeno". Archivado desde el original en 2017-04-18.
{{cite journal}}: Cite journal requires|journal=(Ayuda) - ^ Ackers, G. K.; Holt, J. M. (2006). "Cooperatividad asimétrica en un tetramer simétrico: hemoglobina humana". J. Biol. Chem. 281 (17): 11441–3. doi:10.1074/jbc.r500019200. PMID 16423822. S2CID 6696041.
- ^ Caughey, W. S.; Smythe, G. E.; O'Keeffe, D. H.; Maskasky, J. E.; Smith, M. L. (1975). "Heme A of Cytochrome c Oxidase: Estructura y propiedades: comparaciones con hemes B, C, y S y derivados". J. Biol. Chem. 250 (19): 7602–7622. doi:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ^ Hegg, Eric L. (2004). "Heme A Synthase does not Incorporate Molecular Oxygen into the Formyl Group of Heme A". Bioquímica. 43 (27): 8616–8624. doi:10.1021/bi049056m. PMID 15236569.
- ^ Yoshikawa, S. (2012). "Estudios estructurales sobre la citocroma del corazón bovino c oxidasa". Biochim. Biofias. Acta. 1817 (4): 579-589. doi:10.1016/j.bbabio.2011.12.012. PMID 22236806.
- ^ Rae, T.; Goff, H. (1998). "El grupo heme prosético de lactoperoxidase. Características estructurales de la heme l y heme l-peptides". El Diario de Química Biológica. 273 (43): 27968–27977. doi:10.1074/jbc.273.43.27968. PMID 9774411. S2CID 25780396.
- ^ Purdy, M.A. (1983). "Efecto de la fase de crecimiento y estructura de sobre celular sobre susceptibilidad de Salmonella triunfante al sistema de peróxido de lactoperoxidase-thiocyanate-hidrógeno". Infecto. Inmunes. 39 (3): 1187–95. doi:10.1128/IAI.39.3.1187-1195.1983. PMC348082. PMID 6341231.
- ^ Ohshima, H. (2003). "Base química de la carcinogénesis inducida por la inflamación". Arch. Biochem. Biophys. 417 (1): 3–11. doi:10.1016/s0003-9861(03)00283-2. PMID 12921773.
- ^ Henderson, J.P. (2003). "Los phagocitos producen 5 clorouracil y 5-bromouracil, dos productos mutagénicos de mieloperoxidase, en el tejido inflamatorio humano". J. Biol. Chem. 278 (26): 23522-8. doi:10.1074/jbc.m303928200. PMID 12707270. S2CID 19631565.
- ^ Murshudov, G.; Grebenko, A.; Barynin, V.; Dauter, Z.; K.; Vainshtein, B.; Melik-Adamyan, W.; Bravo, J.; Ferrán, J.; Ferrer, J. C.; Switala, J.; Loewen, P. C.; Fita, I. (1996). "Strutura de la heme d de Penicillium vitale y catalas Escherichia coli" (PDF). El Diario de Química Biológica. 271 (15): 8863-8868. doi:10.1074/jbc.271.15.8863. PMID 8621527. Archivado (PDF) del original en 2018-07-24.
- ^ Belevich, I. (2005). "Complejo oxidado de cytochrome bd de Escherichia coli: estabilidad y fotolabilidad". Cartas FEBS. 579 (21): 4567–70. doi:10.1016/j.febslet.2005.07.011. PMID 16087180. S2CID 36465802.
- ^ Fischer, H.; Orth, H. (1934). Die Chemie des Pyrrols. Liepzig: Ischemia Verlagsgesellschaft.
- ^ Puustinen A, Wikström M. (1991). "Los grupos de citocromo de Escherichia coli". Proc. Natl. Acad. Sci. U.S.A. 88 (14): 6122–6. Código:1991 PNAS...88.6122P. doi:10.1073/pnas.88.14.6122. PMC52034. PMID 2068092.
- ^ Caughey WS, York JL (1962). "Isolación y algunas propiedades del heme verde de la citocroma oxidasa del músculo del corazón de la carne". J. Biol. Chem. 237 (7): 2414–6. doi:10.1016/S0021-9258(19)63456-3. PMID 13877421.
- ^ Caughey WS, Smythe GA, O'Keeffe DH, Maskasky JE, Smith ML (1975). "Heme A of cytochrome c oxidase. Estructura y propiedades: comparaciones con hemes B, C y S y derivados". J. Biol. Chem. 250 (19): 7602–22. doi:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ^ Battersby, Alan R. (2000). "Tetrapirroles: Los pigmentos de la vida". Informes de productos naturales. 17 (6): 507-526. doi:10.1039/B002635M. PMID 11152419.
- ^ Sridevi, Kolluri (28 de abril de 2018). Upregulation of Heme Pathway Enzyme ALA Synthase-1 by Glutethimide and 4,6-Dioxoheptanoic Acid and Downregulation by Glucose and Heme: A Dissertation. EScholarship@UMMS (Tesis). University of Massachusetts Medical School. doi:10.13028/yyyrz-qa79. Archivado desde el original el 8 de agosto de 2016. Retrieved 28 de abril 2018.
- ^ a b Kumar, Sanjay; Bandyopadhyay, Uday (julio de 2005). "La toxicidad libre de hemo y sus sistemas de desintoxicación en humanos". Cartas toxicológicas. 157 (3): 175–188. doi:10.1016/j.toxlet.2005.03.004. PMID 15917143.
- ^ Puy, Hervé; Gouya, Laurent; Deybach, Jean-Charles (marzo de 2010). "Porfirias". El Lancet. 375 (9718): 924-937. doi:10.1016/S0140-6736(09)61925-5. PMID 20226990. S2CID 208791867.
- ^ Fraser, Rachel Z.; Mierda, Mithila; Agrawal, Puja; Mendes, Odete; Klapholz, Sue (2018-04-11). "Evaluación segura de soy Leghemoglobin Protein Preparación derivada dePichia pastoris, destinada a usar como catalizador de sabor en la carne de base vegetal". International Journal of Toxicology. 37 (3): 241–262. doi:10.1177/10915818766318. ISSN 1091-5818. PMC5956568. PMID 29642729.
- ^ "Inside the Strange Science of the Fake Meat That 'Bleeds'". Wired2017-09-20. Archivado desde el original el 24 de marzo de 2018. Retrieved 28 de abril 2018.
- ^ "Silicon Valley tiene un gusto por la comida". El economista. 2015-03-05. ISSN 0013-0613. Retrieved 2019-04-08.
- ^ Maines, Mahin D. (Julio de 1988). "Oxigenasa del calor: función, multiplicidad, mecanismos regulatorios y aplicaciones clínicas". The FASEB Journal. 2 (10): 2557–2568. doi:10.1096/fasebj.2.10.3290025. ISSN 0892-6638. S2CID 22652094.
- ^ Principios de Lehninger sobre Bioquímica (5th ed.). Nueva York: W. H. Freeman and Company. 2008. pp. 876. ISBN 978-0-7167-7108-1.
- ^ Hanafy, K.A. (2013). "El monóxido de carbono y el cerebro: tiempo para repensar el dogma". Curr. Pharm. Des. 19 (15): 2771–5. doi:10.2174/1381612811319150013. PMC3672861. PMID 23092321.
- ^ Abraham, N.G.; Kappas, A. (2008). "Aspectos patmacológicos y clínicos de oxigenasa hemo". Pharmacol. Rev. 60 (1): 79–127. doi:10.1124/pr.107.07104. PMID 18323402. S2CID 12792155.
- ^ Florczyk, U.M.; Jozkowicz, A.; Dulak, J. (enero a febrero de 2008). "Biliverdin reductase: nuevas características de una vieja enzima y su potencial significado terapéutico". Pharmacological Informes. 60 1): 38 a 48 horas5536200. PMID 18276984.
- ^ King, C.; Rios, G.; Green, M.; Tephly, T. (2000). "UDP-Glucuronosyltransferases". Metabolismo actual de drogas. 1 (2): 143–161. doi:10.2174/1389200003339171. PMID 11465080.
- ^ Helmenstine, Anne Marie. "Los Productos Químicos Responsables del Color de Urine y Feces". ThoughtCo. Retrieved 2020-01-24.
- ^ Bunn, H. F.; Jandl, J. H. (Sep 1966). "Exchange of heme among hemoglobin moléculas". Proc. Natl. Acad. Sci. USA. 56 (3): 974-978. Bibcode:1966PNAS...56..974B. doi:10.1073/pnas.56.3.974. PMC219955. PMID 5230192.
- ^ Smith, M. L.; Paul, J.; Ohlsson, P. I.; Hjortsberg, K.; Paul, K. G. (Feb 1991). "Fissión hemeproteína bajo condiciones no características". Proc. Natl. Acad. Sci. USA. 88 (3): 882-886. Bibcode:1991PNAS...88..882S. doi:10.1073/pnas.88.3.882. PMC50918. PMID 1846966.
- ^ Everse, J.; Hsia, N. (1197). "Las toxicidades de las hemoglobinas nativas y modificadas". Biología Radical Libre y Medicina. 22 (6): 1075-1099. doi:10.1016/S0891-5849(96)00499-6. PMID 9034247.
- ^ Kumar, Sanjay; Bandyopadhyay, Uday (julio de 2005). "La toxicidad libre de hemo y sus sistemas de desintoxicación en humanos". Cartas toxicológicas. 157 (3): 175–188. doi:10.1016/j.toxlet.2005.03.004. PMID 15917143.
- ^ Pamplona, A.; Ferreira, A.; Balla, J.; Jeney, V.; Balla, G.; Epiphanio, S.; Chora, A.; Rodrigues, C. D.; Gregoire, I. P.; Cunha-Rodrigues, M.; Portugal, S.; Soares, M. P.; Mota, M. (Jun 2007). "Oxigenasa-1 y monóxido de carbono suprimen la patogénesis de la malaria cerebral experimental". Nature Medicine. 13 (6): 703–710. doi:10.1038/nm1586. PMID 17496899. S2CID 20675040.
- ^ Larsen, R.; Gozzelino, R.; Jeney, V.; Tokaji, L.; Bozza, F. A.; Japiassú, A. M.; Bonaparte, D.; Cavalcante, M.; Chora, A.; Ferreira, A.; Marguti, I.; Cardoso, S.; Sepúlveda, N.; Smithes. "Un papel central para la hema libre en la patogénesis de sepsis severa". Science Translational Medicina. 2 (51): 51ra71. doi:10.1126/scitranslmed.3001118. PMID 20881280. S2CID 423446.
- ^ Bastide, N. M.; Pierre, F. H.; Corpet, D. E. (2011). "El hierro de la carne y el riesgo de cáncer colorrectal: un metaanálisis y una revisión de los mecanismos involucrados" (PDF). Cáncer Prev. Res. 4 (2): 177–184. doi:10.1158/1940-6207.CAPR-10-0113. PMID 21209396. S2CID 4951579. Archivado (PDF) del original en 2015-09-25.
- ^ Bastide, Nadia M.; Pierre, Fabrice H. F.; Corpet, Denis E. (1 de febrero de 2011). "Heme Iron from Meat and Risk of Colorectal Cancer: A Meta-analysis and a Review of the Mechanisms Involved". Investigación sobre la prevención del cáncer. 4 (2): 177–184. doi:10.1158/1940-6207.CAPR-10-0113. PMID 21209396. S2CID 4951579. Archivado desde el original el 11 de octubre de 2017. Retrieved 28 de abril 2018 – via cancerpreventionresearch.aacrjournals.org.
- ^ "Diet, nutrición, actividad física y cáncer colorrectal". wcrf.org. Consultado el 12 de febrero de 2022.
- ^ Chang, Vicky C; Cotterchio, Michelle; Khoo, Edwin (2019). "La ingesta de hierro, estado de hierro corporal y riesgo de cáncer de mama: una revisión sistemática y metaanálisis". BMC Cáncer. 19 (1): 543. doi:10.1186/s12885-019-5642-0. PMC6555759. PMID 31170936.
{{cite journal}}: CS1 maint: múltiples nombres: lista de autores (link) - ^ Plewinska, Magdalena; Thunell, Stig; Holmberg, Lars; Wetmur, James; Desnick, Robert (1991). "delta-Aminolevulinate dehydratase deficiente porphyria: identificación de las lesiones moleculares en un homocigote gravemente afectado". American Journal of Human Genetics. 49 (1): 167–174. PMC1683193. PMID 2063868.
- ^ Aurizi, C.; Lupia Palmieri, G.; Barbieri, L.; Macri, A.; Sorge, F.; Usai, G.; Biolcati, G. (Febrero de 2009). "Cuatro mutaciones novedosas del gen de la oxidasa coproporfirinogen III". Biología celular y molecular. 55 (1): 8–15. PMID 19267996.
- ^ Bustad, H. J.; Vorland, M.; Ronneseth, E.; Sandberg, S.; Martinez, A.; Toska, K. (8 de agosto de 2013). "Conformacional de estabilidad y análisis de actividad de dos mutantes hidroximetilbilano, K132N y V215E, con diferentes asociaciones fenotípicas con porfiria intermitente aguda". Bioscience Reports. 33 (4): 617-626. doi:10.1042/BSR20130045. PMC3738108. PMID 23815679.
- ^ Martinez di Montemuros, F.; Di Pierro, E.; Patti, E.; Tavazzi, D.; Danielli, M. G.; Biolcati, G.; Rocchi, E.; Cappllini, M. D. (diciembre de 2002). "Caracterización molecular de las porfirias en Italia: un diagrama de flujo diagnóstico". 48 (8): 867–876.
{{cite journal}}: Cite journal requires|journal=(Ayuda) - ^ Badenas, C.; To Figueras, J.; Phillips, J. D.; Warby, C. A.; Muñoz, C.; Herrero, C. (abril de 2009). "Identificación y caracterización de mutaciones genéticas novedosas de uroporphyrinogen decarboxylase en una gran serie de porfiria cutanea tarda pacientes y parientes". Genética Clínica. 75 (4): 346–353. doi:10.1111/j.1399-0004.2009.01153.x. PMC3804340. PMID 19419417.
Contenido relacionado
Joseph bancos
Vampyrelidae
Équidos