Halogenación de cetonas
En química orgánica, la halogenación α-ceto es un tipo especial de halogenación. La reacción se puede llevar a cabo en condiciones ácidas o básicas en un medio acuoso con el halógeno elemental correspondiente. De esta manera, la funcionalidad cloruro, bromuro y yoduro (pero notablemente no fluoruro) se puede insertar selectivamente en la posición alfa de una cetona.
La posición alfa del grupo carbonilo (C=O) en una cetona se halogena fácilmente. Esto se debe a su capacidad para formar un enolato (C=C−O−) en solución básica. , o un enol (C=C−OH) en solución ácida. Un ejemplo de alfa halogenación es la monobrominación de acetona ((CH3)2C=O), llevado a cabo en condiciones ácidas o básicas, para dar bromoacetona:
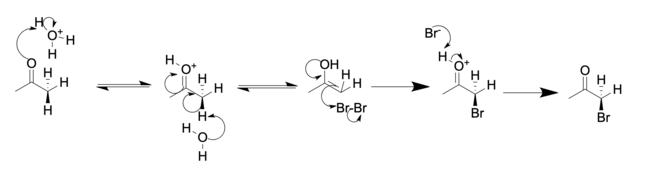
Ácido (en ácido acético):
Básico (en NaOH acuoso):
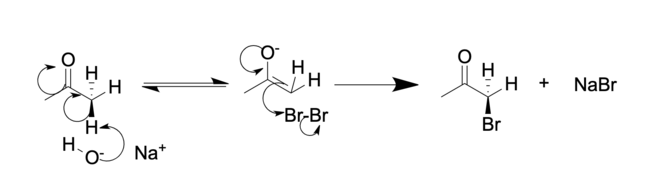
En solución ácida, normalmente sólo un hidrógeno alfa es reemplazado por un halógeno, ya que cada halogenación sucesiva es más lenta que la primera. El halógeno disminuye la basicidad del oxígeno carbonílico, haciendo así que la protonación sea menos favorable. Sin embargo, en soluciones básicas, la halogenación sucesiva es más rápida debido a la extracción inductiva de electrones por parte del halógeno. Esto hace que los hidrógenos restantes sean más ácidos. En el caso de las metilcetonas, esta reacción suele ocurrir por tercera vez para formar un trihaluro de cetona, que puede sufrir una rápida sustitución con agua para formar un carboxilato (−C(=O)O−) en lo que se conoce como reacción del haloformo.
La regioselectividad también difiere: la halogenación de una cetona asimétrica en ácido da como resultado la halogenación del grupo alquilo más sustituido. Un segundo equivalente de halógeno da como resultado la halogenación del otro sustituyente alquilo (sin el halógeno). Por el contrario, en soluciones básicas, una cetona asimétrica se halogena en el grupo alquilo menos sustituido. La halogenación posterior (que normalmente no puede detenerse mediante el control de la estequiometría) se produce en la posición que ya tiene un sustituyente halógeno, hasta que todos los hidrógenos han sido reemplazados por átomos de halógeno. Para las metil alquil cetonas (2-alcanonas), la reacción del haloformo procede para dar el ácido carboxílico de forma selectiva.
Halogenación de cetonas α,β-insaturadas
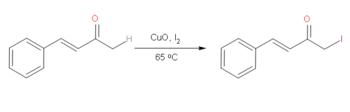
En cetonas o enonas α,β-insaturadas, es posible halogenar con yodo selectivamente la alfa más saturada de la cetona selectivamente sobre el lado insaturado. Se prefiere el yodo debido a que es más reactivo que los bromuros de alquilo, lo que hace que esta reacción sea bastante útil. Al utilizar CuO junto con I2, es posible lograr esta reacción en condiciones relativamente suaves. Esta reacción sufre un mecanismo enólico muy reactivo, facilitado por el CuO, que permite la adición selectiva de I2 sobre el carbono alfa saturado de la cetona. Sin embargo, la eficacia de esta reacción depende de la presencia de grupos funcionales arilo.
Aplicaciones en química verde
Los productos alfa halogenados son compuestos muy útiles ya que tienen una alta reactividad que los hace muy propensos a reaccionar. Las cetonas alfa halogenadas reaccionan con los nucleófilos para crear muchos compuestos valiosos. Sin embargo, muchos de los métodos actuales para la halogenación de cetonas utilizan productos químicos peligrosos, tienen procedimientos complejos y/o requieren mucho tiempo para completarse. Además, los disolventes polares que se utilizan principalmente (DMF, DMSO y CH3CN) son importantes contaminantes ambientales.
Un experimento realizado por Meshram et al. en 2005 investigó cómo hacer que la halogenación de cetonas fuera una reacción más ecológica, de acuerdo con los principios de la química verde. Meshram y cols. investigó alternativas a los productos químicos peligrosos que se utilizan principalmente en la halogenación de cetonas y descubrió que los líquidos iónicos a temperatura ambiente eran una opción prometedora. Los líquidos iónicos a temperatura ambiente son perspectivas interesantes ya que tienen propiedades químicas y físicas únicas, y sus propiedades pueden modificarse cambiando los cationes que están unidos. Además, estos líquidos iónicos tienen una alta polaridad y su capacidad para solubilizar moléculas orgánicas e inorgánicas conduce a velocidades de reacción mejoradas, lo que los hace más deseables.
Muchos experimentos descubrieron que los líquidos iónicos con N-halosuccinimidas como disolvente eran una alternativa eficaz y más ecológica a los disolventes convencionales. Este proceso también dio como resultado mayores rendimientos, reducción del tiempo de reacción, simplificó el procedimiento, utilizó productos químicos menos dañinos (sin ácidos fuertes) y no requirió catalizadores, todo lo cual hizo que el proceso fuera más ecológico.