Haemophilus influenzae
Haemophilus influenzae (antes llamado bacilo de Pfeiffer o Bacillus influenzae) es una bacteria patogénica capnófila, cocobacilar, inmóvil, gramnegativa y anaeróbica facultativa de la familia Pasteurellaceae. Las bacterias son mesófilas y crecen mejor a temperaturas entre 35 y 37 °C.
H. influenzae fue descrita por primera vez en 1893 por Richard Pfeiffer durante una pandemia de influenza cuando atribuyó incorrectamente a Haemophilus influenzae como el microbio causante, razón por la cual la bacteria conserva el nombre de "influenza".;. H. influenzae es responsable de una amplia gama de infecciones localizadas e invasivas, generalmente en bebés y niños, incluidas neumonía, meningitis o infecciones del torrente sanguíneo. El tratamiento consiste en antibióticos, sin embargo H. influenzae suele ser resistente a la familia de las penicilinas, pero en casos leves se puede utilizar amoxicilina/ácido clavulánico. La forma recomendada de prevención de la forma tipo b de H. influenzae es una serie de vacunas Hib y refuerzos, que se administran con mayor frecuencia a menores de 5 años y, a veces, junto con otras vacunas en forma de vacuna DTaP-IPV/Hib.
Esta especie fue el primer microorganismo de vida libre al que se secuenció todo su genoma.
Serotipos
En 1930, dos categorías principales de H. influenzae: las cepas no encapsuladas y las cepas encapsuladas. Las cepas encapsuladas se clasificaron según sus distintos antígenos capsulares. Los seis tipos generalmente reconocidos de H encapsulado. influenzae son: a, b, c, d, e y f. H. La influenza tipo b, también conocida como Hib, es la forma más común, reconocible por su cápsula de polirribosil ribitol fosfato (PRP), y se encuentra principalmente en niños. Los tipos a, e y f se han aislado con poca frecuencia, mientras que los tipos d y c rara vez se aíslan. Las cepas no encapsuladas son genéticamente más diversas que el grupo encapsulado. Las cepas no encapsuladas se denominan no tipificables (NTHi) porque carecen de serotipos capsulares; sin embargo, pueden clasificarse mediante tipificación de secuencias multilocus. Las cepas de NTHi se consideran parte de la flora humana normal en el tracto respiratorio superior e inferior, los genitales y las conjuntivas (membranas mucosas del ojo).
Fisiología
Estructura
H. Influenzae es una pequeña bacteria Gram negativa, de aproximadamente 0,3 micrómetros a 1 micrómetro. Al igual que otras bacterias Gram negativas, H. influenzae tiene una fina capa de peptidoglicano rodeada por una membrana externa que contiene lipopolisacárido. Algunos tipos de H. influenzae contienen una cápsula de polisacárido alrededor de la membrana externa para ayudar en la protección y colonización. Las bacterias son pleomórficas, lo que significa que la forma de la bacteria es variable; sin embargo, normalmente tiene forma de cocobacilo o de bastón. H. Influenzae contiene pili, que están especializados para adherirse a la nasofaringe humana. El H. Influenzae pili, a diferencia de los de E. coli, resisten el desenrollado, lo que permite una adhesión más fuerte para resistir la expulsión al toser o estornudar. Una minoría de H. no tipificables o no encapsulados. influenzae emplean una variedad de técnicas de unión, como pili, adhesinas o proteínas Hia y Hap. Aunque la bacteria posee pili, no se utilizan para el movimiento o la motilidad tradicional, y todavía se considera que la bacteria no es móvil.
La pared celular de H. influenzae contiene varias proteínas, denominadas autotransportadores, para la adherencia y la formación de colonias. H. influenzae prefiere unirse a revestimientos mucosos o células epiteliales no ciliadas, lo que es facilitado por los autotransportadores Hap𝘴 en la pared celular que se unen a receptores desconocidos dentro del epitelio. Los autotransportadores Hap𝘴 también facilitan la formación de microcolonias de bacterias. Es probable que estas microcolonias sean responsables de la formación de diversas biopelículas dentro del cuerpo, como las que son responsables de las infecciones del oído medio o de los pulmones.
Proteínas fijadoras de penicilina
Las proteínas fijadoras de penicilina (PBP) contienen dominios de unión a penicilina que participan en el metabolismo del peptidoglicano, que forma la pared celular, para dar rigidez a las células bacterianas. Los betalactámicos se utilizan en antibióticos que se unen a las PBP para apuntar a la síntesis de peptidoglicanos. Algunos aislados de H. Influenzae ha contenido PBP modificadas que resisten la acción de los betalactámicos al producir betalactamasas. Es probable que esta resistencia se deba a una mutación N526K o a una sustitución de R517H junto con otra mutación desconocida. La sustitución R517H por sí sola no tenía una menor afinidad por la penicilina y, por lo tanto, no puede causar resistencia por sí sola. La aparición de beta-lactamasas en la década de 1970 provocó la terapia para casos graves de H. influenzae se cambiará de ampicilina a cefalosporinas; sin embargo, se ha producido una mayor resistencia a las cefalosporinas debido a cambios en el dominio transpeptidasa de la proteína 3 fijadora de penicilina (PBP3).
Diagnóstico




Las características clínicas pueden incluir síntomas iniciales de una infección del tracto respiratorio superior que imita una infección viral, generalmente asociada con fiebres leves. Esto puede progresar al tracto respiratorio inferior en unos pocos días, con características que a menudo se asemejan a las de la bronquitis sibilante. El esputo puede ser difícil de expectorar y suele ser de color gris o cremoso. La tos puede persistir durante semanas sin el tratamiento adecuado. Muchos casos se diagnostican tras presentar infecciones respiratorias que no responden a penicilinas ni a cefalosporinas de primera generación. Una radiografía de tórax puede identificar la consolidación alveolar.
Diagnóstico clínico de H. influenzae normalmente se confirma mediante cultivo bacteriano o pruebas de aglutinación de partículas de látex o pruebas de reacción en cadena de la polimerasa en muestras clínicas obtenidas de una zona corporal estéril. En este sentido, H. influenzae cultivado de la cavidad nasofaríngea o de la garganta no indicaría H. influenzae, porque estos sitios están colonizados en individuos libres de la enfermedad. Sin embargo, H. influenzae aislado del líquido cefalorraquídeo o de la sangre o del líquido articular indicaría H. infección por influenzae.
Cultura
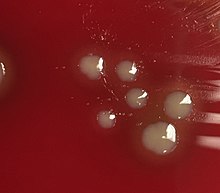
Cultivo bacteriano de H. influenzae se realiza en placas de agar, siendo preferible el agar chocolate, con factores X (hemina) y V (nicotinamida adenina dinucleótido) añadidos a 37 °C en una incubadora enriquecida con CO2. La concentración ideal de CO2 para el cultivo es ~5%. El crecimiento del agar sangre sólo se logra como un fenómeno satélite alrededor de otras bacterias. Colonias de H. influenzae aparecen como colonias convexas, lisas, pálidas, grises o transparentes.
Teñición de Gram y observación microscópica de una muestra de H. influenzae mostrará cocobacilos gramnegativos. El organismo cultivado se puede caracterizar aún más mediante pruebas de catalasa y oxidasa, las cuales deberían ser positivas. Se necesitan más pruebas serológicas para distinguir el polisacárido capsular y diferenciar entre H. influenzae by especies no encapsuladas.
Aunque es muy específico, el cultivo bacteriano de H. influenzae carece de sensibilidad. El uso de antibióticos antes de la recolección de muestras reduce en gran medida la tasa de aislamiento al matar las bacterias antes de que sea posible la identificación. Trabajos recientes han demostrado que H.influenzae utiliza un espectro altamente especializado de nutrientes donde el lactato es la fuente de carbono preferida.
H. influenzae crecerá en la zona hemolítica de Staphylococcus aureus en placas de agar sangre; la hemólisis de las células por S. aureus libera el factor V que es necesario para su crecimiento. H. influenzae no crecerá fuera de la zona hemolítica de S. aureus debido a la falta de nutrientes como el factor V en estas zonas.
Aglutinación de partículas de látex
La prueba de aglutinación de partículas de látex (LAT) es un método más sensible para detectar H. influenzae que la cultura. Debido a que el método se basa en antígenos en lugar de bacterias viables, los resultados no se ven alterados por el uso previo de antibióticos. También tiene el beneficio adicional de ser mucho más rápido que los métodos de cultivo. Sin embargo, las pruebas de sensibilidad a los antibióticos no son posibles con LAT sola, por lo que es necesario un cultivo paralelo.
Métodos moleculares
Se ha demostrado que los ensayos de reacción en cadena de la polimerasa (PCR) son más sensibles que las pruebas LAT o de cultivo, y son altamente específicos. Estas pruebas de PCR se pueden utilizar para la tipificación capsular de H encapsulado. cepas de influenzae.
Patogenicidad
H. influenzae generalmente se encuentra dentro y sobre el cuerpo humano, pero también puede vivir en diversas superficies secas y duras hasta por 12 días. La mayoría de las cepas de H. influenzae son patógenos oportunistas; es decir, normalmente viven en su huésped sin causar enfermedades, pero causan problemas sólo cuando otros factores (como una infección viral, una función inmune reducida o tejidos crónicamente inflamados, por ejemplo, debido a alergias) crean una oportunidad. Infectan al huésped adhiriéndose a la célula huésped mediante adhesinas autotransportadoras triméricas.
La patogénesis de H. influenzae no se comprende completamente, aunque se sabe que la presencia de la cápsula de polirribosil ribitol fosfato (PRP) en el tipo b (Hib) encapsulado, un serotipo que causa afecciones como la epiglotitis, es un factor importante en la virulencia. Su cápsula les permite resistir la fagocitosis y la lisis mediada por el complemento en el huésped no inmune. Las cepas no encapsuladas casi siempre son menos invasivas; sin embargo, pueden producir una respuesta inflamatoria en humanos, lo que puede provocar muchos síntomas. La vacunación con la vacuna conjugada Hib es eficaz para prevenir la infección por Hib, pero no previene la infección por cepas de NTHi.
Haemophilus influenzae puede causar infecciones del tracto respiratorio, incluyendo neumonía, otitis media, epiglotitis (hinchazón de la garganta), infecciones oculares e infecciones del torrente sanguíneo, meningitis. También puede provocar celulitis (infección de la piel) y artritis infecciosa (inflamación de la articulación).
Infección por Haemophilus influenzae tipo b (Hib)
Enfermedad adquirida naturalmente causada por H. influenzae parece ocurrir sólo en humanos. En niños sanos menores de 5 años, H. influenzae tipo b era responsable de más del 80% de las infecciones agresivas, antes de la introducción de la vacuna [Hib]. En bebés y niños pequeños, H. influenzae tipo b (Hib) causa bacteriemia, neumonía, epiglotitis y meningitis bacteriana aguda. En ocasiones provoca celulitis, osteomielitis y artritis infecciosa. Es una de las causas de infección neonatal.
Debido al uso rutinario de la vacuna Hib en los EE. UU. desde 1990, la incidencia de la enfermedad invasiva por Hib ha disminuido a 1,3/100.000 en niños. Sin embargo, Hib sigue siendo una causa importante de infecciones del tracto respiratorio inferior en bebés y niños en países en desarrollo donde la vacuna no se usa ampliamente. H sin encapsular. influenzae no se ven afectadas por la vacuna Hib y causan infecciones de oído (otitis media), infecciones oculares (conjuntivitis) y sinusitis en niños, y están asociadas con neumonía.
Colonización por Haemophilus influenzae
Muchos microbios colonizan dentro de un organismo huésped. La colonización ocurre cuando un microorganismo continúa multiplicándose dentro del huésped, sin interacción, sin causar signos visibles de enfermedad o infección. Haemophilus influenzae coloniza de manera diferente en adultos que en niños pequeños. Debido a que esta bacteria coloniza más rápidamente en los niños pequeños, estos son capaces de portar más de una cepa de la misma bacteria. Una vez en la etapa adulta de la vida, es probable que un ser humano solo sea portador de una cepa, ya que esta bacteria no coloniza de manera tan agresiva en los adultos. Casi todos los bebés sufrirán la colonización de esta bacteria durante su primer año de vida.
Tratamiento
Algunas cepas de Haemophilus influenzae producen beta-lactamasas y también son capaces de modificar sus proteínas de unión a penicilina, por lo que las bacterias han ganado resistencia a la familia de antibióticos de la penicilina. En casos graves, los antibióticos elegidos son cefotaxima y ceftriaxona administradas directamente al torrente sanguíneo y, para los casos menos graves, se prefiere una asociación de ampicilina y sulbactam, cefalosporinas de segunda y tercera generación o fluoroquinolonas. (Se ha observado Haemophilus influenzae resistente a las fluoroquinolonas).
Los macrólidos y las fluoroquinolonas tienen actividad contra el H no tipificable. influenzae y podría usarse en pacientes con antecedentes de alergia a los antibióticos betalactámicos. Sin embargo, también se ha observado resistencia a los macrólidos.
Complicaciones graves y crónicas
Las complicaciones graves de HiB son daño cerebral, pérdida de audición e incluso la muerte. Esto se asocia comúnmente con HiB, pero sin embargo, el HiB no tipificable no suele causar afecciones graves, pero tiene más riesgos de infección crónica porque tiene la capacidad de cambiar sus antígenos de superficie. Las infecciones crónicas no suelen ser tan graves como las infecciones agudas.
Existen algunas otras posibles enfermedades y afecciones que pueden surgir a partir del Haemophilus influenzae dependiendo de las áreas en las que existen dentro del cuerpo humano. Esta bacteria puede existir en las fosas nasales (especialmente en la nasofaringe), el canal auditivo y los pulmones. La presencia de la bacteria en estas áreas puede provocar algunas afecciones como otitis media (que es la inflamación del oído medio), trastorno pulmonar obstructivo crónico, que provoca una disminución del flujo de aire a los pulmones, epiglotitis (que es la hinchazón de la epiglotis) y asma que puede llegar a ser grave.
Metabolismo
H. influenzae utiliza la vía de Embden-Meyerhof-Parnas (EMP) para la glucólisis y la vía de las pentosas fosfato, que es anabólica en lugar de catabólica. El ciclo del ácido cítrico es incompleto y carece de varias enzimas que se encuentran en un ciclo en pleno funcionamiento. Este ciclo parcialmente funcional no es exclusivo del H. influenzae. Las enzimas que faltan en el ciclo del TCA son la citrato sintasa, la aconitato hidratasa y la isocitrato deshidrogenasa. Haemophilus influenzae se ha encontrado en entornos aeróbicos y anaeróbicos, así como en entornos con diferentes pH.
Prevención

Desde principios de la década de 1990 existen vacunas eficaces contra el serotipo b de Haemophilus influenzae y se recomiendan para niños menores de 5 años y pacientes asplénicos. La Organización Mundial de la Salud recomienda una vacuna pentavalente, que combina vacunas contra la difteria, el tétanos, la tos ferina, la hepatitis B y Hib. Aún no hay pruebas suficientes sobre la eficacia de esta vacuna pentavalente en relación con las vacunas individuales.
Las vacunas Hib cuestan alrededor de siete veces el costo total de las vacunas contra el sarampión, la polio, la tuberculosis, la difteria, el tétanos y la tos ferina. En consecuencia, mientras que el 92% de la población de los países desarrollados estaba vacunada contra Hib en 2003, la cobertura de vacunación fue del 42% para los países en desarrollo y sólo del 8% para los países menos desarrollados.
Las vacunas Hib no proporcionan protección cruzada a ninguna otra Haemophilus influenzae serotipos como Hola. Hola. Hola, Hie o Hif.
Se ha desarrollado una vacuna oral contra Haemophilus influenzae (NTHi) no tipificable para pacientes con bronquitis crónica, pero no ha demostrado ser eficaz para reducir el número y la gravedad de las exacerbaciones de la EPOC. Sin embargo, no existe una vacuna eficaz para los otros tipos de Haemophilus inflenzae encapsulado o Haemophilus inflenzae no tipificable.
Genoma
H. influenzae fue el primer organismo de vida libre al que se secuenció todo su genoma. Completado por Craig Venter y su equipo en el Instituto de Investigación Genómica, ahora parte del Instituto J. Craig Venter. Se eligió Haemophilus porque uno de los líderes del proyecto, el premio Nobel Hamilton Smith, había estado trabajando en él durante décadas y pudo proporcionar bibliotecas de ADN de alta calidad. El método de secuenciación utilizado fue el de escopeta de genoma completo, que se completó y publicó en Science en 1995.
El genoma de la cepa Rd KW20 consta de 1.830.138 pares de bases de ADN en un único cromosoma circular que contiene 1.604 genes codificadores de proteínas, 117 pseudogenes, 57 genes de ARNt y otros 23 genes de ARN. Alrededor del 90% de los genes tienen homólogos en E. coli, otra gamma-proteobacteria. De hecho, la similitud entre genes de las dos especies oscila entre el 18% y el 98% de identidad de secuencia de proteínas, y la mayoría comparte entre el 40% y el 80% de sus aminoácidos (con un promedio del 59%).
Los plásmidos conjugativos (moléculas de ADN que son capaces de realizar transferencias horizontales entre diferentes especies de bacterias) se pueden encontrar con frecuencia en H. influenzae. Es común que el plásmido F+ de una bacteria Escherichia coli competente se conjugue en el plásmido H. influenzae, que luego permite que el plásmido se transfiera entre H. influenzae mediante conjugación.
Probable papel protector de la transformación
Sin encapsular H. influenzae se observa a menudo en las vías respiratorias de pacientes con enfermedad pulmonar obstructiva crónica (EPOC). También se observan grandes cantidades de neutrófilos en el esputo de pacientes con EPOC. Los neutrófilos fagocitan H. influenzae, activando así un estallido respiratorio oxidativo. Sin embargo, en lugar de matar las bacterias, los neutrófilos mueren (aunque tal explosión oxidativa probablemente cause daño al ADN en las células H. influenzae). El hecho de que los neutrófilos no puedan matar muchas de las bacterias parece explicar la persistencia de esta infección en la EPOC.
H. influenzae mutantes defectuosos en su gen rec1 (un homólogo de recA) son muy susceptibles a ser destruidos por el agente oxidante peróxido de hidrógeno. Este hallazgo sugiere que la expresión rec1 es importante para H. influenzae supervivencia en condiciones de estrés oxidativo. Dado que es un homólogo de recA, es probable que rec1 desempeñe un papel clave en la reparación recombinacional del daño del ADN. Así H. influenzae puede proteger su genoma contra las especies reactivas de oxígeno producidas por las células fagocíticas del huésped mediante la reparación recombinacional de los daños oxidativos del ADN. La reparación recombinacional de un sitio dañado de un cromosoma requiere, además de rec1, una segunda molécula de ADN homóloga no dañada. Individuo H. influenzae son capaces de tomar ADN homólogo de otras células mediante el proceso de transformación. Transformación en H. influenzae involucra al menos 15 productos genéticos y probablemente sea una adaptación para reparar el daño del ADN en el cromosoma residente.
Vacunas dirigidas al H. no encapsulado. Se están desarrollando serotipos de influenzae.