Grupo flavin
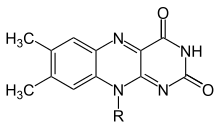
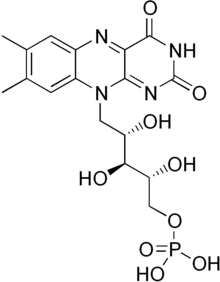
flavinas (del latín flavus, "amarillo") son compuestos orgánicos, al igual que su base, la pteridina. Están formados por el heterociclo tricíclico isoaloxazina. La fuente bioquímica es la vitamina riboflavina. El resto de flavina a menudo se une con un difosfato de adenosina para formar dinucleótido de flavina y adenina (FAD) y, en otras circunstancias, se encuentra como mononucleótido de flavina. > (o FMN), una forma fosforilada de riboflavina. Es en una u otra de estas formas que la flavina está presente como grupo prostético en las flavoproteínas.
El grupo flavina es capaz de sufrir reacciones de oxidación-reducción y puede aceptar un electrón en un proceso de dos pasos o dos electrones a la vez. La reducción se realiza con la adición de átomos de hidrógeno a átomos de nitrógeno específicos en el sistema de anillos de isoaloxazina:
En solución acuosa, las flavinas son de color amarillo cuando se oxidan, tomando un color rojo en estado aniónico semirreducido o azul en estado neutro (semiquinona), e incoloras cuando se reducen totalmente. Las formas oxidadas y reducidas están en rápido equilibrio con la forma semiquinona (radical), desplazada contra la formación del radical:
- FlOx + FlrojoH2 ⇌ FlH•
donde Flox es la flavina oxidada, FlredH2 la flavina reducida (tras la adición de dos átomos de hidrógeno) y FlH• la forma de semiquinona (adición de un átomo de hidrógeno).
En forma de FADH2, es uno de los cofactores que pueden transferir electrones a la cadena de transferencia de electrones.
Fotorreducción
Tanto las flavinas libres como las unidas a proteínas son fotorreducibles, es decir, capaces de ser reducidas por la luz, en un mecanismo mediado por varios compuestos orgánicos, como algunos aminoácidos, ácidos carboxílicos y aminas. Esta propiedad de las flavinas es aprovechada por varias proteínas sensibles a la luz. Por ejemplo, el dominio LOV, que se encuentra en muchas especies de plantas, hongos y bacterias, sufre un cambio estructural reversible dependiente de la luz que implica la formación de un enlace entre un residuo de cisteína en su secuencia peptídica y un FMN unido.
FAD
El dinucleótido de flavina y adenina es un grupo unido a muchas enzimas, incluidas la ferredoxina-NADP+ reductasa, la monoaminooxidasa, la D-aminoácido oxidasa, la glucosa oxidasa, la xantina oxidasa y la acil CoA deshidrogenasa.FADH/FADH2
FADH y FADH2 son formas reducidas de FAD. FADH2 se produce como grupo prostético en la succinato deshidrogenasa, una enzima involucrada en el ciclo del ácido cítrico. En la fosforilación oxidativa, dos moléculas de FADH2 normalmente producen 1,5 ATP cada una, o tres ATP combinadas.
FMN
El mononucleótido de flavina es un grupo prostético que se encuentra, entre otras proteínas, en la NADH deshidrogenasa, la E.coli nitroreductasa y la enzima amarilla vieja.
Contenido relacionado
Selenocisteína
Estados de la materia
Svante Arrhenius
Plasma (física)
Materia