Gluconeogénesis
gluconeogénesis (GNG) es una vía metabólica que da como resultado la generación de glucosa a partir de ciertos sustratos de carbono distintos de los carbohidratos. Es un proceso ubicuo, presente en plantas, animales, hongos, bacterias y otros microorganismos. En los vertebrados, la gluconeogénesis ocurre principalmente en el hígado y, en menor medida, en la corteza de los riñones. Es uno de los dos mecanismos principales, el otro es la degradación del glucógeno (glucogenólisis), que utilizan los seres humanos y muchos otros animales para mantener los niveles de azúcar en la sangre, evitando niveles bajos (hipoglucemia). En los rumiantes, debido a que los carbohidratos de la dieta tienden a ser metabolizados por los organismos del rumen, la gluconeogénesis ocurre independientemente del ayuno, las dietas bajas en carbohidratos, el ejercicio, etc. En muchos otros animales, el proceso ocurre durante períodos de ayuno, inanición, dietas bajas en carbohidratos o ejercicio intenso
En los seres humanos, los sustratos para la gluconeogénesis pueden provenir de cualquier fuente distinta de los carbohidratos que se pueda convertir en piruvato o en intermediarios de la glucólisis (consulte la figura). Para la descomposición de proteínas, estos sustratos incluyen aminoácidos glucogénicos (aunque no aminoácidos cetogénicos); de la descomposición de los lípidos (como los triglicéridos), incluyen glicerol, ácidos grasos de cadena impar (aunque no ácidos grasos de cadena uniforme, véase más adelante); y de otras partes del metabolismo que incluye lactato del ciclo de Cori. En condiciones de ayuno prolongado, la acetona derivada de los cuerpos cetónicos también puede servir como sustrato, proporcionando una vía desde los ácidos grasos hasta la glucosa. Aunque la mayor parte de la gluconeogénesis ocurre en el hígado, la contribución relativa de la gluconeogénesis por parte del riñón aumenta en la diabetes y el ayuno prolongado.
La vía de la gluconeogénesis es altamente endergónica hasta que se acopla a la hidrólisis de ATP o GTP, lo que hace que el proceso sea exergónico. Por ejemplo, la vía que lleva del piruvato a la glucosa-6-fosfato requiere 4 moléculas de ATP y 2 moléculas de GTP para proceder espontáneamente. Estos ATP provienen del catabolismo de ácidos grasos a través de la oxidación beta.
Precursoras
(feminine)
- Aminoácidos Glucógenos tienen esta habilidad
- Los aminoácidos cetogénicos no. Estos productos pueden ser utilizados para la cetogénesis o síntesis de lípidos.
- Algunos aminoácidos se catabolizan en productos glucógenos y cetogénicos.
En humanos, los principales precursores gluconeogénicos son el lactato, el glicerol (que forma parte de la molécula de triglicéridos), la alanina y la glutamina. En conjunto, representan más del 90% de la gluconeogénesis global. Otros aminoácidos glucogénicos y todos los intermedios del ciclo del ácido cítrico (a través de la conversión a oxalacetato) también pueden funcionar como sustratos para la gluconeogénesis. En general, el consumo humano de sustratos gluconeogénicos en los alimentos no da como resultado un aumento de la gluconeogénesis.
En los rumiantes, el propionato es el principal sustrato gluconeogénico. En los no rumiantes, incluidos los seres humanos, el propionato surge de la β-oxidación de ácidos grasos de cadena impar y de cadena ramificada, y es un sustrato (relativamente menor) para la gluconeogénesis.
El lactato se transporta de vuelta al hígado, donde se convierte en piruvato mediante el ciclo de Cori utilizando la enzima lactato deshidrogenasa. El piruvato, el primer sustrato designado de la ruta gluconeogénica, se puede usar para generar glucosa. La transaminación o desaminación de los aminoácidos facilita la entrada de su estructura carbonada en el ciclo directamente (como piruvato u oxaloacetato) o indirectamente a través del ciclo del ácido cítrico. La contribución del lactato del ciclo de Cori a la producción total de glucosa aumenta con la duración del ayuno. Específicamente, después de 12, 20 y 40 horas de ayuno en voluntarios humanos, la contribución del lactato del ciclo de Cori a la gluconeogénesis fue del 41 %, 71 % y 92 %, respectivamente.
Hace tiempo que la bioquímica se pregunta si los ácidos grasos de cadena uniforme se pueden convertir en glucosa en animales. Los ácidos grasos de cadena impar se pueden oxidar para producir acetil-CoA y propionil-CoA, sirviendo este último como precursor de succinil-CoA, que se puede convertir en piruvato y entrar en la gluconeogénesis. Por el contrario, los ácidos grasos de cadena uniforme se oxidan para producir solo acetil-CoA, cuya entrada en la gluconeogénesis requiere la presencia de un ciclo de glioxilato (también conocido como derivación de glioxilato) para producir precursores de ácido dicarboxílico de cuatro carbonos. La derivación de glioxilato comprende dos enzimas, malato sintasa e isocitrato liasa, y está presente en hongos, plantas y bacterias. A pesar de algunos informes de actividades enzimáticas de derivación de glioxilato detectadas en tejidos animales, los genes que codifican ambas funciones enzimáticas solo se han encontrado en nematodos, en los que existen como una sola enzima bifuncional. Se han identificado genes que codifican solo para la malato sintasa (pero no para la isocitrato liasa) en otros animales, incluidos artrópodos, equinodermos e incluso algunos vertebrados. Los mamíferos que poseen el gen de la malato sintasa incluyen monotremas (ornitorrincos) y marsupiales (zarigüeyas), pero no mamíferos placentarios.
No se ha establecido la existencia del ciclo del glioxilato en humanos, y se cree ampliamente que los ácidos grasos no se pueden convertir directamente en glucosa en humanos. Se ha demostrado que el carbono 14 termina en la glucosa cuando se suministra en ácidos grasos, pero esto se puede esperar de la incorporación de átomos marcados derivados del acetil-CoA en los intermedios del ciclo del ácido cítrico que son intercambiables con los derivados de otras fuentes fisiológicas., como los aminoácidos glucogénicos. En ausencia de otras fuentes glucogénicas, el acetil-CoA de 2 carbonos derivado de la oxidación de ácidos grasos no puede producir un rendimiento neto de glucosa a través del ciclo del ácido cítrico, ya que se liberan dos átomos de carbono equivalentes como dióxido de carbono durante el ciclo. Sin embargo, durante la cetosis, la acetil-CoA de los ácidos grasos produce cuerpos cetónicos, incluida la acetona, y hasta ~60% de la acetona puede oxidarse en el hígado a los precursores del piruvato, acetol y metilglioxal. Por lo tanto, los cuerpos cetónicos derivados de los ácidos grasos podrían representar hasta el 11 % de la gluconeogénesis durante la inanición. El catabolismo de los ácidos grasos también produce energía en forma de ATP que es necesaria para la vía de la gluconeogénesis.
Ubicación
En los mamíferos, se cree que la gluconeogénesis está restringida al hígado, el riñón, el intestino y los músculos, pero evidencia reciente indica que la gluconeogénesis ocurre en los astrocitos del cerebro. Estos órganos utilizan precursores gluconeogénicos algo diferentes. El hígado usa preferentemente lactato, glicerol y aminoácidos glucogénicos (especialmente alanina) mientras que el riñón usa preferentemente lactato, glutamina y glicerol. El lactato del ciclo de Cori es cuantitativamente la mayor fuente de sustrato para la gluconeogénesis, especialmente para el riñón. El hígado usa tanto la glucogenólisis como la gluconeogénesis para producir glucosa, mientras que el riñón solo usa la gluconeogénesis. Después de una comida, el hígado pasa a la síntesis de glucógeno, mientras que el riñón aumenta la gluconeogénesis. El intestino utiliza principalmente glutamina y glicerol.
El propionato es el sustrato principal para la gluconeogénesis en el hígado de los rumiantes, y el hígado de los rumiantes puede hacer un mayor uso de los aminoácidos gluconeogénicos (p. ej., alanina) cuando aumenta la demanda de glucosa. La capacidad de las células hepáticas para usar lactato para la gluconeogénesis disminuye desde la etapa prerrumiante hasta la etapa rumiante en terneros y corderos. En tejido renal de oveja, se han observado tasas muy altas de gluconeogénesis a partir de propionato.
En todas las especies, la formación de oxalacetato a partir del piruvato y los intermedios del ciclo TCA está restringida a la mitocondria, y las enzimas que convierten el ácido fosfoenolpirúvico (PEP) en glucosa-6-fosfato se encuentran en el citosol. La ubicación de la enzima que une estas dos partes de la gluconeogénesis al convertir el oxalacetato en PEP (PEP carboxiquinasa (PEPCK)) varía según la especie: se puede encontrar completamente dentro de las mitocondrias, completamente dentro del citosol o dispersada uniformemente entre los dos. como lo es en los humanos. El transporte de PEP a través de la membrana mitocondrial se logra mediante proteínas de transporte dedicadas; sin embargo, no existen tales proteínas para el oxaloacetato. Por lo tanto, en las especies que carecen de PEPCK intramitocondrial, el oxaloacetato debe convertirse en malato o aspartato, exportarse desde la mitocondria y volver a convertirse en oxaloacetato para permitir que continúe la gluconeogénesis.
Camino
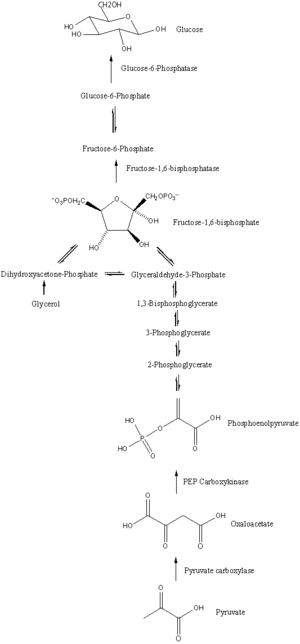
La gluconeogénesis es una vía que consta de una serie de once reacciones catalizadas por enzimas. La vía comenzará en el hígado o el riñón, en la mitocondria o el citoplasma de esas células, dependiendo del sustrato que se utilice. Muchas de las reacciones son inversas a los pasos que se encuentran en la glucólisis.
- La Gluconeogenesis comienza en la mitocondria con la formación de oxaloaceta por la carboxilación de piruvato. Esta reacción también requiere una molécula de ATP, y es catalizada por piruvate carboxylase. Esta enzima es estimulada por altos niveles de acetil-CoA (producido en β-oxidación en el hígado) e inhibida por altos niveles de ADP y glucosa.
- La oxaloaceta se reduce a malata utilizando la NADH, un paso necesario para su transporte fuera de la mitocondria.
- Malato es oxidado a oxaloaceta utilizando NAD+ en el citosol, donde se dan los pasos restantes de la gluconeogenesis.
- La oxaloaceta es decarboxilada y luego fosforilada para formar fosfoenolpyruvate usando la enzima PEPCK. Una molécula de GTP es hidrolizada al PIB durante esta reacción.
- Los siguientes pasos en la reacción son los mismos que la glicolisis inversa. Sin embargo, la fructosa 1,6-bisfosfatasa convierte fructosa 1,6-bisfosfato a fructosa 6-fosfato, utilizando una molécula de agua y liberando un fosfato (en glucolisis, fosfofructokinasa 1 convierte F6P y ATP a F1,6BP y ADP). Este es también el paso límite de velocidad de la gluconeogenesis.
- Glucose-6-fosfato se forma a partir de fructosa 6-fosfato por fosfoglucoisomerasa (el reverso del paso 2 en glucolisis). Glucose-6-fosfato se puede utilizar en otras vías metabólicas o desfosforiladas para la glucosa libre. Mientras que la glucosa libre puede difundir fácilmente dentro y fuera de la célula, la forma fosforilada (glucosa-6-fosfato) está bloqueada en la célula, un mecanismo por el cual los niveles de glucosa intracelular son controlados por las células.
- La gluconeogenesis final, la formación de la glucosa, ocurre en el lumen del reticulum endoplasmático, donde la glucosa-6-fosfato es hidrolizada por glucosa-6-fosfatasa para producir glucosa y liberar un fosfato inorgánico. Como dos pasos anteriores, este paso no es una simple inversión de glucolisis, en la que el hexokinasa cataliza la conversión de glucosa y ATP en G6P y ADP. Glucose es transferido al citoplasma por transportadores de glucosa ubicados en la membrana del reticulum endoplasmático.
| Metabolismo de monosacáridos comunes, incluyendo glucolisis, gluconeogenesis, glicogénesis y glucogenolisis |
|---|
Regulación
Si bien la mayoría de los pasos de la gluconeogénesis son inversos a los que se encuentran en la glucólisis, tres reacciones reguladas y fuertemente endergónicas se reemplazan por reacciones cinéticamente más favorables. Las enzimas hexoquinasa/glucoquinasa, fosfofructoquinasa y piruvato quinasa de la glucólisis se reemplazan con glucosa-6-fosfatasa, fructosa-1,6-bisfosfatasa y PEP carboxquinasa/piruvato carboxilasa. Estas enzimas suelen estar reguladas por moléculas similares, pero con resultados opuestos. Por ejemplo, el acetil CoA y el citrato activan las enzimas de la gluconeogénesis (piruvato carboxilasa y fructosa-1,6-bisfosfatasa, respectivamente), mientras que al mismo tiempo inhiben la enzima glucolítica piruvato quinasa. Este sistema de control recíproco permite que la glucólisis y la gluconeogénesis se inhiban entre sí y evita un ciclo inútil de síntesis de glucosa para solo descomponerla. La piruvato cinasa también puede pasarse por alto por 86 vías no relacionadas con la gluconeogénesis, con el fin de formar piruvato y, posteriormente, lactato; algunas de estas vías utilizan átomos de carbono originados a partir de la glucosa.
La mayoría de las enzimas responsables de la gluconeogénesis se encuentran en el citosol; las excepciones son la piruvato carboxilasa mitocondrial y, en animales, la fosfoenolpiruvato carboxicinasa. Este último existe como una isozima ubicada tanto en la mitocondria como en el citosol. La tasa de gluconeogénesis está controlada en última instancia por la acción de una enzima clave, la fructosa-1,6-bisfosfatasa, que también está regulada a través de la transducción de señales por cAMP y su fosforilación.
El control global de la gluconeogénesis está mediado por el glucagón (liberado cuando la glucosa en sangre es baja); desencadena la fosforilación de enzimas y proteínas reguladoras por la proteína quinasa A (una quinasa regulada por AMP cíclico) que da como resultado la inhibición de la glucólisis y la estimulación de la gluconeogénesis. La insulina contrarresta el glucagón al inhibir la gluconeogénesis. La diabetes tipo 2 se caracteriza por un exceso de glucagón y resistencia a la insulina del cuerpo. La insulina ya no puede inhibir la expresión génica de enzimas como PEPCK, lo que conduce a un aumento de los niveles de hiperglucemia en el cuerpo. El fármaco antidiabético metformina reduce la glucosa en sangre principalmente a través de la inhibición de la gluconeogénesis, superando el fracaso de la insulina para inhibir la gluconeogénesis debido a la resistencia a la insulina.
Los estudios han demostrado que la ausencia de producción de glucosa hepática no tiene un efecto importante en el control de la concentración de glucosa plasmática en ayunas. La inducción compensatoria de la gluconeogénesis se produce en los riñones y el intestino, impulsada por el glucagón, los glucocorticoides y la acidosis.
Resistencia a la insulina
En el hígado, la proteína FOX FOXO6 normalmente promueve la gluconeogénesis en ayunas, pero la insulina bloquea la FOXO6 al alimentarse. En una condición de resistencia a la insulina, la insulina no puede bloquear FOXO6, lo que da como resultado una gluconeogénesis continua incluso después de la alimentación, lo que da como resultado un nivel alto de glucosa en sangre (hiperglucemia).
La resistencia a la insulina es una característica común del síndrome metabólico y la diabetes tipo 2. Por esta razón, la gluconeogénesis es un objetivo de la terapia para la diabetes tipo 2, como el fármaco antidiabético metformina, que inhibe la formación de glucosa gluconeogénica y estimula la absorción de glucosa por las células.
Contenido relacionado
Boragináceas
Diferenciación
Yersinia