Glucocinasa
Glucoquinasa (EC 2.7.1.2) es una enzima que facilita la fosforilación de la glucosa a glucosa-6-fosfato. La glucoquinasa se encuentra en las células del hígado y el páncreas de los humanos y de la mayoría de los demás vertebrados. En cada uno de estos órganos juega un papel importante en la regulación del metabolismo de los carbohidratos al actuar como un sensor de glucosa, desencadenando cambios en el metabolismo o la función celular en respuesta al aumento o disminución de los niveles de glucosa, como los que ocurren después de una comida o durante el ayuno. Las mutaciones del gen de esta enzima pueden causar formas inusuales de diabetes o hipoglucemia.
La glucoquinasa (GK) es una isoenzima de hexoquinasa, relacionada homólogamente con al menos otras tres hexoquinasas. Todas las hexocinasas pueden mediar la fosforilación de la glucosa a glucosa-6-fosfato (G6P), que es el primer paso tanto de la síntesis de glucógeno como de la glucólisis. Sin embargo, la glucoquinasa está codificada por un gen separado y sus propiedades cinéticas distintivas le permiten cumplir un conjunto diferente de funciones. La glucoquinasa tiene una menor afinidad por la glucosa que las otras hexoquinasas y su actividad se localiza en unos pocos tipos de células, lo que deja a las otras tres hexoquinasas como preparadoras de glucosa más importantes para la glucólisis y la síntesis de glucógeno en la mayoría de los tejidos y órganos. Debido a esta afinidad reducida, la actividad de la glucocinasa, en condiciones fisiológicas habituales, varía sustancialmente según la concentración de glucosa.
Nomenclatura
Los nombres alternativos para esta enzima son: hexoquinasa IV humana, hexoquinasa D y ATP:D-hexosa 6-fosfotransferasa, EC 2.7.1.1 (anteriormente 2.7.1.2). El nombre común, glucoquinasa, se deriva de su relativa especificidad por la glucosa en condiciones fisiológicas.
Algunos bioquímicos han argumentado que el nombre glucoquinasa debería abandonarse por ser engañoso, ya que esta enzima puede fosforilar otras hexosas en las condiciones adecuadas, y hay enzimas lejanamente relacionadas en bacterias con especificidad más absoluta por la glucosa que merecen mejor el nombre y la CE 2.7.1.2. Sin embargo, glucoquinasa sigue siendo el nombre preferido en los contextos de la medicina y la fisiología de los mamíferos.
En 2004 se descubrió otra glucosa quinasa de mamíferos, la glucocinasa específica de ADP. El gen es distinto y similar al de los organismos primitivos. Depende del ADP más que del ATP (lo que sugiere la posibilidad de una función más eficaz durante la hipoxia), y su papel metabólico y su importancia aún no se han dilucidado.
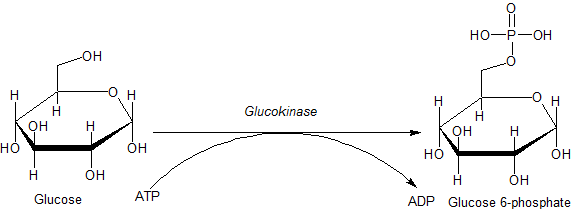
Catálisis
Sustratos y productos
El principal sustrato de importancia fisiológica de la glucocinasa es la glucosa, y el producto más importante es la glucosa-6-fosfato (G6P). El otro sustrato necesario, del que se deriva el fosfato, es el trifosfato de adenosina (ATP), que se convierte en difosfato de adenosina (ADP) cuando se elimina el fosfato. La reacción catalizada por la glucocinasa es:
El ATP participa en la reacción en forma de complejo con magnesio (Mg) como cofactor. Además, bajo ciertas condiciones, la glucoquinasa, al igual que otras hexoquinasas, puede inducir la fosforilación de otras hexosas (azúcares de 6 carbonos) y moléculas similares. Por lo tanto, la reacción general de la glucoquinasa se describe con mayor precisión como:
- Hexose + MgATP2 - 2
→ hexosa-PO2 - 2
3 + MgADP−
+ H+
- Hexose + MgATP2 - 2
Entre los sustratos de hexosa se encuentran manosa, fructosa y glucosamina, pero la afinidad de la glucoquinasa por estos requiere concentraciones que no se encuentran en las células para una actividad significativa.
Cinética
Dos propiedades cinéticas importantes distinguen a la glucoquinasa de las otras hexoquinasas, lo que le permite funcionar en un papel especial como sensor de glucosa.
- La Glucokinase tiene una afinidad menor para la glucosa que las otras hexoquinas. Glucokinase cambia la conformación y/o función en paralelo con crecientes concentraciones de glucosa en el rango fisiológicamente importante de 4–10 mmol/L (72–180 mg/dL). Está medio saturado a una concentración de glucosa de aproximadamente 8 mmol/L (144 mg/dL).
- La glucosa-6-fosfato no es inhibida por su producto. Esto permite una salida de señal continua (por ejemplo, para activar la liberación de insulina) en cantidades significativas de su producto
Estas dos características le permiten regular un sistema "basado en la oferta" camino metabólico. Es decir, la velocidad de reacción depende del suministro de glucosa, no de la demanda de productos finales.
Otra propiedad distintiva de la glucoquinasa es su moderada cooperatividad con la glucosa, con un coeficiente de Hill (nH) de aproximadamente 1,7. La glucoquinasa tiene un solo sitio de unión para la glucosa y es la única enzima reguladora monomérica que se sabe que muestra cooperatividad de sustrato. Se ha postulado que la naturaleza de la cooperatividad implica una "transición lenta" entre dos estados enzimáticos diferentes con diferentes tasas de actividad. Si el estado dominante depende de la concentración de glucosa, se produciría una cooperatividad aparente similar a la observada.
Debido a esta cooperatividad, la interacción cinética de la glucocinasa con la glucosa no sigue la cinética clásica de Michaelis-Menten. En lugar de un Km para la glucosa, es más exacto describir un nivel de media saturación S0,5, que es la concentración a la cual la enzima está 50% saturada y activa.
El S0,5 y el nH se extrapolan a un "punto de inflexión" de la curva que describe la actividad enzimática como una función. de concentración de glucosa en aproximadamente 4 mmol/L. En otras palabras, a una concentración de glucosa de aproximadamente 72 mg/dL, que está cerca del extremo inferior del rango normal, la actividad de la glucoquinasa es más sensible a pequeños cambios en la concentración de glucosa.
La relación cinética con el otro sustrato, MgATP, puede describirse mediante la cinética clásica de Michaelis-Menten, con una afinidad de aproximadamente 0,3 a 0,4 mmol/L, muy por debajo de una concentración intracelular típica de 2,5 mmol/L. El hecho de que casi siempre haya un exceso de ATP disponible implica que la concentración de ATP rara vez influye en la actividad de la glucoquinasa.
La actividad específica máxima (kcat, también conocida como tasa de recambio) de la glucocinasa cuando está saturada con ambos sustratos es 62/s.
El pH óptimo de la glucocinasa humana se identificó recientemente y es sorprendentemente alto, entre 8,5 y 8,7.
Se ha ideado un "modelo matemático mínimo" basado en la información cinética anterior para predecir la tasa de fosforilación de glucosa de las células beta (BGPR) de células normales ("tipo salvaje&). #34;) glucoquinasa y las mutaciones conocidas. El BGPR para la glucocinasa de tipo natural es aproximadamente del 28 % con una concentración de glucosa de 5 mmol/L, lo que indica que la enzima está funcionando al 28 % de su capacidad en el umbral habitual de glucosa para desencadenar la liberación de insulina.
Mecanismo
Los grupos sulfhidrilo de varias cisteínas rodean el sitio de unión de la glucosa. Todos, excepto cys 230, son esenciales para el proceso catalítico, formando múltiples puentes disulfuro durante la interacción con los sustratos y reguladores. Al menos en las células beta, la proporción de moléculas de glucoquinasa activas e inactivas está determinada al menos en parte por el equilibrio de oxidación de los grupos sulfhidrilo o la reducción de los puentes disulfuro.
Estos grupos sulfhidrilo son bastante sensibles al estado de oxidación de las células, lo que convierte a la glucoquinasa en uno de los componentes más vulnerables al estrés oxidativo, especialmente en las células beta.
Mapa de ruta interactivo
Haga clic en genes, proteínas y metabolitos a continuación para vincular a los artículos respectivos.
- ^ El mapa interactivo se puede editar en WikiPathways: "GlycolysisGluconeogenesis_WP534".
Estructura
La glucoquinasa es una proteína monomérica de 465 aminoácidos y un peso molecular de aproximadamente 50 kD. Hay al menos dos hendiduras, una para el sitio activo, que une la glucosa y el MgATP, y la otra para un supuesto activador alostérico que aún no ha sido identificado.
Esto es aproximadamente la mitad del tamaño de las hexoquinasas de otros mamíferos, que conservan cierto grado de estructura dimérica. Varias secuencias y la estructura tridimensional de los sitios activos clave. El dominio de unión a ATP, por ejemplo, se comparte con hexoquinasas, glucoquinasas bacterianas y otras proteínas, y la estructura común se denomina pliegue de actina.
Genética
La glucoquinasa humana está codificada por el gen GCK en el cromosoma 7. Este único gen autosómico tiene 10 exones. Los genes de la glucoquinasa en otros animales son homólogos a la GCK humana.
Una característica distintiva del gen es que comienza con dos regiones promotoras. El primer exón del 5' El extremo contiene dos regiones promotoras específicas de tejido. La transcripción puede comenzar en cualquiera de los promotores (dependiendo del tejido), de modo que el mismo gen pueda producir una molécula ligeramente diferente en el hígado y en otros tejidos. Las dos isoformas de la glucocinasa difieren sólo en 13 a 15 aminoácidos en el extremo N-terminal de la molécula, lo que produce sólo una diferencia mínima en la estructura. Las dos isoformas tienen las mismas características cinéticas y funcionales.
El primer promotor del 5' final, denominado proceso "upstream" o promotor neuroendocrino, está activo en las células de los islotes pancreáticos, el tejido neural y los enterocitos (células del intestino delgado) para producir la "isoforma neuroendocrina" de glucoquinasa. El segundo promotor, el "downstream" o promotor hepático, está activo en los hepatocitos y dirige la producción de la "isoforma hepática". Los dos promotores tienen poca o ninguna homología de secuencia y están separados por una secuencia de 30 kpb que aún no se ha demostrado que incurra en diferencias funcionales entre isoformas. Los dos promotores son funcionalmente exclusivos y se rigen por conjuntos distintos de factores reguladores, de modo que la expresión de glucocinasa puede regularse por separado en diferentes tipos de tejido. Los dos promotores corresponden a dos categorías amplias de función de la glucocinasa: en el hígado, la glucocinasa actúa como puerta de entrada para el "procesamiento masivo" de la proteína. de glucosa disponible, mientras que, en las células neuroendocrinas, actúa como un sensor, desencadenando respuestas celulares que afectan el metabolismo de los carbohidratos en todo el cuerpo.
Distribución entre sistemas de órganos
La glucoquinasa se ha descubierto en células específicas de cuatro tipos de tejido de mamíferos: hígado, páncreas, intestino delgado y cerebro. Todos desempeñan papeles cruciales en la respuesta al aumento o disminución de los niveles de glucosa en sangre.
- Las células predominantes del hígado son los hepatocitos, y GK se encuentra exclusivamente en estas células. Durante la digestión de una comida de carbohidratos, cuando la glucosa sanguínea es abundante y los niveles de insulina son altos, los hepatocitos eliminan la glucosa de la sangre y la almacenan como glucógeno. Después de completar la digestión y absorción, el hígado fabrica glucosa de sustratos no glucosa (gluconeogenesis) y glicógeno (glucogenolisis), y la exporta a la sangre, para mantener niveles adecuados de glucosa en sangre durante el ayuno. Debido a que la actividad GK aumenta rápidamente a medida que aumenta la concentración de glucosa, sirve como un interruptor metabólico central para cambiar el metabolismo de carbohidratos hepáticos entre estados alimentados y estados de ayuno. La fosforilación de la glucosa a la glucosa-6-fosfato por GK facilita el almacenamiento de la glucosa como glucógeno y la eliminación por glicolisis. El promotor del hígado separado permite regular la glucoquinasa de manera diferente en hepatocitos que en las células neuroendocrinas.
- Las células neuroendocrinas del páncreas, intestino y cerebro comparten algunos aspectos comunes de la producción, regulación y función de glucoquinasa. Estos tejidos se denominan colectivamente células "neuroendocrinas" en este contexto.
- Células beta y células alfa de los islotes pancreáticos
- Las células beta liberan insulina en respuesta al aumento de los niveles de glucosa. La insulina permite a muchos tipos de células importar y utilizar la glucosa, y señala al hígado para sintetizar el glucógeno. Las células alfa producen menos glucagones en respuesta al aumento de los niveles de glucosa y más glucago si la glucosa sanguínea es baja. Glucagon sirve como señal al hígado para descomponer el glucógeno y liberar la glucosa en la sangre. La glucosa en células beta sirve como sensor de glucosa, amplificando la secreción de insulina a medida que aumenta la glucosa en sangre.
- En la célula beta pancreática, la glucoquinasa es una enzima reguladora clave. Glucokinase es muy importante en la regulación de la secreción de la insulina y ha sido conocido como el sensor beta-celular pancreático. Las mutaciones en la glucoquinasa de codificación de genes pueden causar hiperglucemia e hipoglicemia debido a su papel central en la regulación de la liberación de la insulina.
- neuronas sensibles al glucoso del hipotálamo
- En respuesta al aumento o descenso de los niveles de glucosa, las células del hipotálamo polarizan o despolarizan. Entre las reacciones neuroendocrinas del sistema nervioso central a la hipoglicemia está la activación de las respuestas adrenergicas del sistema nervioso autonómico. La glucosa también sirve como señal de glucosa. Glucokinase también se ha encontrado en células de la pituitaria anterior.
- Enterocitos del intestino delgado
- Este es el menor entendimiento de los sistemas de sensores de glucokinasa. Parece probable que las respuestas a la glucosa entrante durante la digestión juegan un papel en la amplificación de la incretina de la secreción de la insulina durante una comida, o en la generación de señales de saciedad de intestino al cerebro.
- Células beta y células alfa de los islotes pancreáticos
Distribución entre especies
La glucoquinasa hepática se encuentra ampliamente, pero no universalmente, en todas las especies de vertebrados. La estructura genética y la secuencia de aminoácidos están altamente conservadas en la mayoría de los mamíferos (p. ej., la glucoquinasa de rata y humana es homóloga en más del 80%). Sin embargo, existen algunas excepciones inusuales: por ejemplo, no se ha descubierto en gatos ni murciélagos, aunque algunos reptiles, aves, anfibios y peces lo tienen. Aún no se ha determinado si la glucoquinasa ocurre de manera similar en el páncreas y otros órganos. Se ha postulado que la presencia de glucoquinasa en el hígado refleja la facilidad con la que se pueden incluir los carbohidratos en la dieta de los animales. dietas.
Función y regulación
La mayor parte de la glucoquinasa en un mamífero se encuentra en el hígado y la glucocinasa proporciona aproximadamente el 95 % de la actividad de la hexoquinasa en los hepatocitos. La fosforilación de la glucosa a glucosa-6-fosfato (G6P) por la glucocinasa es el primer paso tanto de la síntesis de glucógeno como de la glucólisis en el hígado.
Cuando hay suficiente glucosa disponible, la síntesis de glucógeno continúa en la periferia de los hepatocitos hasta que las células están repletas de glucógeno. Luego, el exceso de glucosa se convierte cada vez más en triglicéridos para exportarlos y almacenarlos en el tejido adiposo. La actividad de la glucoquinasa en el citoplasma aumenta y disminuye con la glucosa disponible.
G6P, el producto de la glucocinasa, es el principal sustrato de la síntesis de glucógeno, y la glucocinasa tiene una estrecha asociación funcional y reguladora con la síntesis de glucógeno. Cuando su actividad es máxima, la GK y la glucógeno sintasa parecen estar ubicadas en las mismas áreas periféricas del citoplasma de los hepatocitos en las que se produce la síntesis de glucógeno. El suministro de G6P afecta la tasa de síntesis de glucógeno no sólo como sustrato primario, sino también mediante la estimulación directa de la glucógeno sintasa y la inhibición de la glucógeno fosforilasa.
La actividad de la glucoquinasa puede amplificarse o atenuarse rápidamente en respuesta a cambios en el suministro de glucosa, generalmente como resultado de comer y ayunar. La regulación se produce en varios niveles y velocidades, y está influenciada por muchos factores que afectan principalmente a dos mecanismos generales:
- La actividad de Glucokinase puede ser amplificada o reducida en minutos por acciones de la proteína reguladora de glucoquinasa (GKRP). Las acciones de esta proteína están influenciadas por pequeñas moléculas como la glucosa y la fructosa.
- La cantidad de glucokinasa puede aumentarse mediante la síntesis de nueva proteína. La insulina es la señal principal para una mayor transcripción, operando principalmente a través de un factor de transcripción llamado elemento regulatorio de esterol proteína-1c (SREBP1c) en el hígado. Esto ocurre dentro de una hora después de un aumento en los niveles de insulina, como después de una comida de carbohidratos.
Transcripcional
Se cree que la insulina que actúa a través de la proteína 1c de unión al elemento regulador de esteroles (SREBP1c) es el activador directo más importante de la transcripción del gen de la glucocinasa en los hepatocitos. SREBP1c es un transactivador básico de cremallera de hélice-bucle-hélice (bHLHZ). Esta clase de transactivadores se une a la "caja E" secuencia de genes para una serie de enzimas reguladoras. El promotor hepático en el primer exón del gen de la glucocinasa incluye dicha caja E, que parece ser el principal elemento de respuesta a la insulina del gen en los hepatocitos. Anteriormente se pensaba que SREBP1c debía estar presente para la transcripción de la glucocinasa en los hepatocitos; sin embargo, recientemente se demostró que la transcripción de la glucocinasa se llevaba a cabo normalmente en ratones inactivados con SREBP1c. SREBP1c aumenta en respuesta a una dieta rica en carbohidratos, presumiblemente como un efecto directo de la elevación frecuente de la insulina. Se puede detectar un aumento de la transcripción en menos de una hora después de que los hepatocitos se exponen a niveles crecientes de insulina.
Fructosa-2,6-bisfosfato (F2,6P
2) también estimula la transcripción GK, al parecer a través de Akt2 en lugar de SREBP1c. No se sabe si este efecto es uno de los efectos posteriores a la activación de los receptores de insulina o es independiente de la acción de la insulina. Niveles de F2,6P
2 desempeñan otras funciones amplificadoras en la glucólisis en los hepatocitos.
Otros factores de transacción que se sospecha que desempeñan un papel en la regulación de la transcripción de las células hepáticas incluyen:
- El factor nuclear hepático-4-alfa (HNF4α) es un receptor nuclear huérfano importante en la transcripción de muchos genes para enzimas de carbohidratos y metabolismo lipídico. Se activa GCK transcripción.
- El factor estimulante de corriente superior 1 (USF1) es otro transactivador básico de helix-loop-helix (bHLHZ).
- El factor nuclear hepático 6 (HNF6) es un regulador transcripcional homeodomain de la "clase de un solo corte". HNF6 también está involucrado en la regulación de la transcripción de enzimas gluconeogénicas tales como glucosa-6-fosfatasa y fosfoenolpyruvate carboxykinase.
Hormonal y dietético
La insulina es, con diferencia, la más importante de las hormonas que tienen efectos directos o indirectos sobre la expresión y actividad de la glucoquinasa en el hígado. La insulina parece afectar tanto la transcripción como la actividad de la glucoquinasa a través de múltiples vías directas e indirectas. Mientras que el aumento de los niveles de glucosa en la vena porta aumenta la actividad de la glucocinasa, el aumento concomitante de la insulina amplifica este efecto mediante la inducción de la síntesis de glucocinasa. La transcripción de la glucoquinasa comienza a aumentar una hora después del aumento de los niveles de insulina. La transcripción de la glucoquinasa se vuelve casi indetectable en caso de inanición prolongada, privación grave de carbohidratos o diabetes con deficiencia de insulina no tratada.
Los mecanismos por los cuales la insulina induce la glucocinasa pueden involucrar las dos principales vías intracelulares de acción de la insulina, la cascada de la quinasa regulada por señales extracelulares (ERK 1/2) y la cascada de la fosfoinositida 3-quinasa (PI3-K). Este último puede funcionar a través del transactivador FOXO1.
Sin embargo, como se esperaría dado su efecto antagonista sobre la síntesis de glucógeno, el glucagón y su segundo mensajero intracelular AMPc suprimen la transcripción y la actividad de la glucoquinasa, incluso en presencia de insulina.
Otras hormonas como la triyodotironina (T
3) y los glucocorticoides proporcionan efectos permisivos o estimulantes sobre la glucocinasa en determinadas circunstancias. La biotina y el ácido retinoico aumentan la transcripción del ARNm de GCK y la actividad de GK. Los ácidos grasos en cantidades significativas amplifican la actividad de GK en el hígado, mientras que la acil-CoA de cadena larga la inhibe.
Hepática
(feminine)La glucoquinasa se puede activar e inactivar rápidamente en los hepatocitos mediante una nueva proteína reguladora (proteína reguladora de la glucoquinasa), que opera para mantener una reserva inactiva de GK, que puede estar disponible rápidamente en respuesta a los niveles crecientes de glucosa en la vena porta.
El GKRP se mueve entre el núcleo y el citoplasma de los hepatocitos y puede estar unido al citoesqueleto de microfilamentos. Forma complejos reversibles 1:1 con GK y puede trasladarlo desde el citoplasma al núcleo. Actúa como un inhibidor competitivo con la glucosa, de modo que la actividad enzimática se reduce a casi cero mientras está unida. Los complejos GK:GKRP están secuestrados en el núcleo mientras los niveles de glucosa y fructosa son bajos. El secuestro nuclear puede servir para proteger a GK de la degradación por proteasas citoplasmáticas. GK puede liberarse rápidamente de GKRP en respuesta al aumento de los niveles de glucosa. A diferencia de la GK en las células beta, la GK en los hepatocitos no está asociada con las mitocondrias.
La fructosa en cantidades pequeñas (micromolares) (después de la fosforilación por la cetohexoquinasa a fructosa-1-fosfato (F1P)) acelera la liberación de GK del GKRP. Esta sensibilidad a la presencia de pequeñas cantidades de fructosa permite que GKRP, GK y la cetohexoquinasa actúen como un "sistema sensor de fructosa", lo que indica que se está digiriendo una comida mixta con carbohidratos y acelera la utilización de la glucosa. Sin embargo, la fructosa 6-fosfato (F6P) potencia la unión de GK por GKRP. F6P disminuye la fosforilación de glucosa por GK cuando están en marcha la glucogenólisis o la gluconeogénesis. Tanto F1P como F6P se unen al mismo sitio en GKRP. Se postula que producen 2 conformaciones diferentes de GKRP, una capaz de unirse a GK y la otra no.
Pancreática
(feminine)Aunque la mayor parte de la glucoquinasa del cuerpo se encuentra en el hígado, cantidades más pequeñas en las células beta y alfa del páncreas, ciertas neuronas hipotalámicas y células específicas (enterocitos) del intestino desempeñan un papel cada vez más apreciado en la regulación de los carbohidratos. metabolismo. En el contexto de la función de la glucocinasa, estos tipos de células se denominan colectivamente tejidos neuroendocrinos y comparten algunos aspectos de la regulación y función de la glucocinasa, especialmente el promotor neuroendocrino común. De las células neuroendocrinas, las células beta de los islotes pancreáticos son las más estudiadas y mejor comprendidas. Es probable que muchas de las relaciones reguladoras descubiertas en las células beta también existan en otros tejidos neuroendocrinos con la glucoquinasa.
Una señal para la insulina
En las células beta de los islotes, la actividad de la glucocinasa sirve como control principal de la secreción de insulina en respuesta al aumento de los niveles de glucosa en sangre. A medida que se consume G6P, cantidades crecientes de ATP inician una serie de procesos que resultan en la liberación de insulina. Una de las consecuencias inmediatas del aumento de la respiración celular es un aumento en las concentraciones de NADH y NADPH (denominados colectivamente NAD(P)H). Este cambio en el estado redox de las células beta da como resultado un aumento de los niveles de calcio intracelular, el cierre de los canales KATP, la despolarización de la membrana celular, la fusión de los gránulos secretores de insulina con la membrana y la liberación de insulina en la sangre.
Es como señal para la liberación de insulina que la glucocinasa ejerce el mayor efecto sobre los niveles de azúcar en la sangre y la dirección general del metabolismo de los carbohidratos. La glucosa, a su vez, influye tanto en la actividad inmediata como en la cantidad de glucocinasa producida en las células beta.
Regulación en células beta
La glucosa amplifica inmediatamente la actividad de la glucoquinasa por el efecto de cooperatividad.
Un segundo regulador rápido importante de la actividad de la glucoquinasa en las células beta se produce mediante la interacción directa proteína-proteína entre la glucoquinasa y la "enzima bifuncional" (fosfofructoquinasa-2/fructosa-2,6-bisfosfatasa), que también desempeña un papel en la regulación de la glucólisis. Esta asociación física estabiliza la glucocinasa en una conformación catalíticamente favorable (algo opuesta al efecto de la unión de GKRP) que mejora su actividad.
En tan solo 15 minutos, la glucosa puede estimular la transcripción de GCK y la síntesis de glucoquinasa a través de la insulina. La insulina es producida por las células beta, pero parte de ella actúa sobre los receptores de insulina de tipo B de las células beta, proporcionando una amplificación autocrina de retroalimentación positiva de la actividad de la glucocinasa. Se produce una amplificación adicional por la acción de la insulina (a través de receptores de tipo A) para estimular su propia transcripción.
La transcripción del gen GCK se inicia a través del proceso "ascendente" o neuroendocrino, promotor. Este promotor, a diferencia del promotor hepático, tiene elementos homólogos a otros promotores de genes inducidos por insulina. Entre los probables factores de transacción se encuentran Pdx-1 y PPARγ. Pdx-1 es un factor de transcripción de homeodominio implicado en la diferenciación del páncreas. PPARγ es un receptor nuclear que responde a los fármacos con glitazona mejorando la sensibilidad a la insulina.
Asociación con gránulos secretores de insulina
Gran parte, pero no toda, de la glucocinasa que se encuentra en el citoplasma de las células beta está asociada con los gránulos secretores de insulina y con las mitocondrias. La proporción así "consolidada" cae rápidamente en respuesta al aumento de la secreción de glucosa e insulina. Se ha sugerido que la unión tiene un propósito similar al de la proteína reguladora de la glucocinasa hepática: proteger a la glucocinasa de la degradación para que esté rápidamente disponible a medida que aumenta la glucosa. El efecto es amplificar la respuesta de la glucoquinasa a la glucosa más rápidamente de lo que podría hacerlo la transcripción.
Supresión del glucagón en las células alfa
También se ha propuesto que la glucocinasa desempeña un papel en la detección de glucosa de las células alfa pancreáticas, pero la evidencia es menos consistente y algunos investigadores no han encontrado evidencia de actividad de la glucocinasa en estas células. Las células alfa se encuentran en los islotes pancreáticos, mezcladas con células beta y otras. Mientras que las células beta responden al aumento de los niveles de glucosa secretando insulina, las células alfa responden reduciendo la secreción de glucagón. Cuando la concentración de glucosa en sangre cae a niveles hipoglucémicos, las células alfa liberan glucagón. El glucagón es una hormona proteica que bloquea el efecto de la insulina en los hepatocitos, induciendo glucogenólisis, gluconeogénesis y reducción de la actividad de la glucoquinasa en los hepatocitos. Aún no se sabe hasta qué punto la supresión del glucagón por parte de la glucosa es un efecto directo de la glucosa a través de la glucocinasa en las células alfa, o un efecto indirecto mediado por la insulina u otras señales de las células beta.
Hipotálamo
Si bien todas las neuronas utilizan la glucosa como combustible, ciertas neuronas sensibles a la glucosa alteran su velocidad de activación en respuesta al aumento o disminución de los niveles de glucosa. Estas neuronas sensibles a la glucosa se concentran principalmente en el núcleo ventromedial y el núcleo arqueado del hipotálamo, que regulan muchos aspectos de la homeostasis de la glucosa (especialmente la respuesta a la hipoglucemia), la utilización de combustible, la saciedad y el apetito, y el mantenimiento del peso. Estas neuronas son más sensibles a los cambios de glucosa en el rango de 0,5 a 3,5 mmol/L.
Se ha encontrado glucocinasa en el cerebro en gran medida en las mismas áreas que contienen neuronas sensibles a la glucosa, incluidos ambos núcleos hipotalámicos. La inhibición de la glucocinasa suprime la respuesta del núcleo ventromedial a una comida. Sin embargo, los niveles de glucosa en el cerebro son más bajos que los niveles plasmáticos, normalmente entre 0,5 y 3,5 mmol/L. Aunque este rango coincide con la sensibilidad de las neuronas sensibles a la glucosa, está por debajo de la sensibilidad de inflexión óptima para la glucocinasa. La presunción, basada en evidencia indirecta y especulaciones, es que la glucocinasa neuronal está de alguna manera expuesta a los niveles de glucosa plasmática incluso en las neuronas.
Enterocitos e incretina
Aunque se ha demostrado que la glucocinasa se encuentra en ciertas células (enterocitos) del intestino delgado y del estómago, no se ha determinado su función y regulación. Se ha sugerido que también en este caso la glucocinasa sirve como sensor de glucosa, permitiendo a estas células proporcionar una de las respuestas metabólicas más tempranas a los carbohidratos entrantes. Se sospecha que estas células participan en las funciones de las incretinas.
Importancia clínica
Debido a que la insulina es uno de los reguladores de la síntesis de glucocinasa, si no el más importante, la diabetes mellitus de todo tipo disminuye la síntesis y la actividad de la glucocinasa mediante una variedad de mecanismos. La actividad de la glucoquinasa es sensible al estrés oxidativo de las células, especialmente las células beta.
Se han descubierto al menos 497 mutaciones del gen de la glucoquinasa humana GCK, que pueden cambiar la eficiencia de la unión y fosforilación de la glucosa, aumentando o disminuyendo la sensibilidad de la secreción de insulina de las células beta en respuesta a la glucosa. y producir hiperglucemia o hipoglucemia clínicamente significativa.
Diabetes mellitus
Las mutacionesGCK reducen la eficacia funcional de la molécula de glucoquinasa. La heterocigosidad para los alelos con actividad enzimática reducida da como resultado un umbral más alto para la liberación de insulina y una hiperglucemia leve y persistente. Esta afección se conoce como diabetes juvenil de inicio en la madurez, tipo 2 (MODY2). El resumen más reciente de la mutación GCK observada en pacientes afirma que hay 791 mutaciones, de las cuales se cree que 489 causan la diabetes MODY y, por lo tanto, reducen la eficiencia funcional de la molécula de glucoquinasa.
La homocigosidad de los alelos GCK con función reducida puede provocar una deficiencia congénita grave de insulina, lo que provoca diabetes neonatal persistente.
Hipoglucemia hiperinsulinémica
Se ha descubierto que algunas mutaciones mejoran la secreción de insulina. La heterocigosidad para las mutaciones de ganancia de función reduce el umbral de glucosa que desencadena la liberación de insulina. Esto crea hipoglucemia de patrones variables, incluido hiperinsulinismo congénito transitorio o persistente, o hipoglucemia en ayunas o reactiva que aparece a una edad más avanzada. La descripción general más reciente de la mutación GCK que se observó en pacientes afirmó que 17 mutaciones GCK causaban hipoglucemia hiperinsulinémica.
No se ha encontrado homocigosidad para mutaciones de ganancia de función.
Investigación
Varias compañías farmacéuticas están investigando moléculas que activen la glucoquinasa con la esperanza de que sea útil en el tratamiento de la diabetes tipo 1 y tipo 2.
Enlaces externos
- Glucokinase en la Biblioteca Nacional de Medicina de EE.UU.