Glicosilación
Glicosilación es la reacción en la que un carbohidrato (o 'glicano'), es decir, un donante de glucosilo, se une a un hidroxilo u otro grupo funcional de otra molécula (un glucosilo). aceptor) para formar un glicoconjugado. En biología (pero no siempre en química), la glicosilación generalmente se refiere a una reacción catalizada por enzimas, mientras que la glicación (también 'glicación no enzimática' y 'no enzimática glicosilación') puede referirse a una reacción no enzimática.
La glicosilación es una forma de modificación cotraduccional y postraduccional. Los glicanos desempeñan una variedad de funciones estructurales y funcionales en las proteínas de membrana y secretadas. La mayoría de las proteínas sintetizadas en el retículo endoplásmico rugoso sufren glicosilación. La glicosilación también está presente en el citoplasma y el núcleo como modificación de O-GlcNAc. La aglicosilación es una característica de los anticuerpos diseñados para evitar la glicosilación. Se producen cinco clases de glicanos:
- N-Glycans ligados a un nitrógeno de cadenas laterales asparaginas o argininas. La glucosilación ligada N requiere la participación de un lípido especial llamado fosfato dolichol.
- O-Glycans ligados a la hidroxila oxigeno de serina, troonina, tirosina, hidroxilisina o cadenas laterales hidroxiprolinas, o a oxígenos en lípidos como la ceramida.
- Phosphoglycans ligados a través del fosfato de una fosfoserina.
- C-Glycans enlazados, una rara forma de glucosilación donde se agrega un azúcar a un carbono en una cadena lateral triptófana. El aloin es una de las pocas sustancias naturales.
- Glypiation, que es la adición de un ancla GPI que une las proteínas a los lípidos a través de los vínculos glucanos.
Propósito
La glicosilación es el proceso mediante el cual un carbohidrato se une covalentemente a una macromolécula objetivo, típicamente proteínas y lípidos. Esta modificación cumple varias funciones. Por ejemplo, algunas proteínas no se pliegan correctamente a menos que estén glicosiladas. En otros casos, las proteínas no son estables a menos que contengan oligosacáridos unidos al nitrógeno amida de ciertos residuos de asparagina. La influencia de la glicosilación sobre el plegamiento y la estabilidad de la glicoproteína es doble. En primer lugar, los glicanos altamente solubles pueden tener un efecto de estabilización fisicoquímico directo. En segundo lugar, los glicanos unidos a N median en un punto crítico de control de calidad en el plegamiento de glicoproteínas en el retículo endoplásmico. La glicosilación también desempeña un papel en la adhesión de célula a célula (un mecanismo empleado por las células del sistema inmunológico) a través de proteínas de unión a azúcar llamadas lectinas, que reconocen fracciones de carbohidratos específicas. La glicosilación es un parámetro importante en la optimización de muchos fármacos basados en glicoproteínas, como los anticuerpos monoclonales. La glicosilación también sustenta el sistema del grupo sanguíneo ABO. Es la presencia o ausencia de glicosiltransferasas lo que dicta qué antígenos de grupo sanguíneo se presentan y, por tanto, qué especificidades de anticuerpos se exhiben. Este papel inmunológico bien puede haber impulsado la diversificación de la heterogeneidad de los glicanos y crear una barrera para la transmisión zoonótica de virus. Además, los virus suelen utilizar la glicosilación para proteger la proteína viral subyacente del reconocimiento inmunológico. Un ejemplo significativo es el denso escudo de glucano de la espiga de la envoltura del virus de la inmunodeficiencia humana.
En general, la glicosilación debe entenderse a la luz de las probables presiones de selección evolutiva que la han moldeado. En un modelo, la diversificación puede considerarse puramente como resultado de una funcionalidad endógena (como el tráfico de células). Sin embargo, es más probable que la diversificación sea impulsada por la evasión del mecanismo de infección del patógeno (por ejemplo, la unión de Helicobacter a los residuos de sacáridos terminales) y que la diversidad dentro del organismo multicelular se explote endógenamente.
La glicosilación también puede modular la estabilidad termodinámica y cinética de las proteínas.
Diversidad de glicoproteínas
La glicosilación aumenta la diversidad en el proteoma, porque casi todos los aspectos de la glicosilación pueden modificarse, incluidos:
- Lazos glucosídicos: el sitio de la conexión glicana
- Composición glucana: los tipos de azúcares que están vinculados a una proteína dada
- Estructura glucana - puede ser cadenas de azúcar sin marca o ramificadas
- Longitud glucana: puede ser oligosacáridos de cadena corta o larga
Mecanismos
Existen varios mecanismos para la glicosilación, aunque la mayoría comparte varias características comunes:
- La glucosilación, a diferencia de la gllicación, es un proceso enzimático. De hecho, se cree que la glicosilación es la modificación post-translacional más compleja, debido al gran número de pasos enzimáticos involucrados.
- La molécula de donante es a menudo un azúcar nucleótido activado.
- El proceso no es tentado (a diferencia de la transcripción de ADN o la traducción de proteínas); en cambio, la célula depende de la segregación de enzimas en diferentes compartimentos celulares (por ejemplo, reticulum endoplasmático, cisternae en el aparato de Golgi). Por lo tanto, la glucosilación es una modificación específica del sitio.
Tipos
Glicosilación ligada a N
La glicosilaciónN es una forma muy frecuente de glicosilación y es importante para el plegamiento de muchas glicoproteínas eucariotas y para la unión célula-célula y célula-matriz extracelular. El proceso de glicosilación ligada a N ocurre en eucariotas en la luz del retículo endoplasmático y ampliamente en arqueas, pero muy raramente en bacterias. Además de su función en el plegamiento de proteínas y la unión celular, los glicanos N unidos a una proteína pueden modular la función de una proteína, actuando en algunos casos como un interruptor de encendido/apagado.
Glicosilación ligada a O
La glicosilación ligada aO es una forma de glicosilación que ocurre en eucariotas en el aparato de Golgi, pero también ocurre en arqueas y bacterias.
Glicosilación de fosfoserina
En la literatura se han informado glicanos de xilosa, fucosa, manosa y fosfoserina GlcNAc. Se han encontrado fucosa y GlcNAc únicamente en Dictyostelium discoideum, manosa en Leishmania mexicana y xilosa en Trypanosoma cruzi. Recientemente se ha informado de manosa en un vertebrado, el ratón, Mus musculus, en el receptor de laminina alfa distroglicano4 de la superficie celular. Se ha sugerido que este raro hallazgo puede estar relacionado con el hecho de que el alfa distroglicano está altamente conservado desde los vertebrados inferiores hasta los mamíferos.
C-manosilación
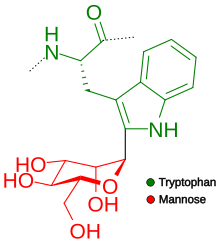
Se agrega un azúcar manosa al primer residuo de triptófano en la secuencia W–X–X–W (W indica triptófano; X es cualquier aminoácido). Se forma un enlace C-C entre el primer carbono de la alfa-manosa y el segundo carbono del triptófano. Sin embargo, no todas las secuencias que presentan este patrón están manosiladas. Se ha establecido que, de hecho, sólo dos tercios lo son y que existe una clara preferencia por que el segundo aminoácido sea uno de los polares (Ser, Ala, Gly y Thr) para que se produzca la manosilación. Recientemente ha habido un gran avance en la técnica de predecir si la secuencia tendrá o no un sitio de manosilación que proporciona una precisión del 93% frente al 67% de precisión si solo consideramos el motivo WXXW.
Las trombospondinas son una de las proteínas más comúnmente modificadas de esta forma. Sin embargo, hay otro grupo de proteínas que se someten a manosilación C: los receptores de citoquinas tipo I. La manosilación C es inusual porque el azúcar está unido a un carbono en lugar de a un átomo reactivo como el nitrógeno o el oxígeno. En 2011 se determinó la primera estructura cristalina de una proteína que contiene este tipo de glicosilación: la del componente 8 del complemento humano. Actualmente se establece que el 18% de las proteínas humanas, secretadas y transmembrana, pasan por el proceso de C-manosilación. Numerosos estudios han demostrado que este proceso juega un papel importante en la secreción de trombospondina tipo 1, que contiene proteínas que se retienen en el retículo endoplásmico si no se someten a C-manosilación. Esto explica por qué un tipo de receptores de citoquinas, el receptor de eritropoyetina, permaneció en el retículo endoplásmico. retículo si carecía de sitios de C-manosilación.
Formación de anclajes GPI (glipiación)
La glipiación es una forma especial de glicosilación que presenta la formación de un ancla GPI. En este tipo de glicosilación, una proteína se une a un ancla lipídica, a través de una cadena de glucano. (Ver también prenilación.)
Glicosilación química
La glicosilación también se puede realizar utilizando herramientas de química orgánica sintética. A diferencia de los procesos bioquímicos, la glicoquímica sintética depende en gran medida de grupos protectores (por ejemplo, el 4,6-O-bencilideno) para lograr la regioselectividad deseada. El otro desafío de la glicosilación química es la estereoselectividad de que cada enlace glicosídico tiene dos resultados estereoscópicos, α/β o cis/trans. Generalmente, el glucósido α o cis es más difícil de sintetizar. Se han desarrollado nuevos métodos basados en la participación de disolventes o la formación de iones de sulfonio bicíclicos como grupos auxiliares quirales.
Glicosilación no enzimática
La glicosilación no enzimática también se conoce como glicación o glicación no enzimática. Es una reacción espontánea y un tipo de modificación postraduccional de las proteínas, por lo que altera su estructura y actividad biológica. Es la unión covalente entre el grupo carbonilo de un azúcar reductor (principalmente glucosa y fructosa) y la cadena lateral de aminoácidos de la proteína. En este proceso no es necesaria la intervención de una enzima. Tiene lugar a través y cerca de los canales de agua y los túbulos que sobresalen.
Al principio, la reacción forma moléculas temporales que luego sufren diferentes reacciones (reordenamientos de Amadori, reacciones de bases de Schiff, reacciones de Maillard, entrecruzamientos...) y forman residuos permanentes conocidos como productos finales de glicación avanzada (AGE).
Los AGE se acumulan en proteínas extracelulares de larga vida, como el colágeno, que es la proteína más glicada y estructuralmente más abundante, especialmente en los seres humanos. Además, algunos estudios han demostrado que la lisina puede desencadenar una glicosilación no enzimática espontánea.
Papel de los AGE
Los AGE son responsables de muchas cosas. Estas moléculas juegan un papel importante sobre todo en la nutrición, son las responsables del color pardusco y de los aromas y sabores de algunos alimentos. Está demostrado que cocinar a alta temperatura da como resultado que varios productos alimenticios tengan altos niveles de AGE.
Tener niveles elevados de AGE en el cuerpo tiene un impacto directo en el desarrollo de muchas enfermedades. Tiene una implicación directa en la diabetes mellitus tipo 2 que puede provocar muchas complicaciones como: cataratas, insuficiencia renal, daños cardíacos... Y, si están presentes en un nivel disminuido, se reduce la elasticidad de la piel, lo que es un síntoma importante de la diabetes mellitus tipo 2. envejecimiento.
También son los precursores de muchas hormonas y regulan y modifican sus mecanismos receptores a nivel del ADN.
Desglicosilación
Existen diferentes enzimas para eliminar los glicanos de las proteínas o eliminar alguna parte de la cadena de azúcar.
- α2-3,6,8,9-Neuraminidase (de Arthrobacter ureafaciens): cuelga todos los ácidos siálicos no reductores ramificados y sin marca.
- β1,4-Galactosidase (de Streptococcus pneumoniae): libera solamente β1,4-enlazado, no reducción de la galactosa terminal de carbohidratos complejos y glicoproteínas.
- β-N-Acetylglucosaminidase (de Streptococcus pneumoniae): colga todos los residuos de N-acetilglucosamina no reductores terminales vinculados con β de carbohidratos complejos y glucoproteínas.
- endo-α-N-AcetylgalactosaminidaseO- Glycosidase de Streptococcus pneumoniae): eliminaciones O- glucosalación. Esta enzima cuelga la serina o la treonina no sustituida Galβ1,3Gal NAc
- PNGase F: oligosacáridos acoplados a la asparagina a menos que se fucosilen α1,3-core.
Regulación de la señalización Notch
La señalización Notch es una vía de señalización celular cuya función es, entre muchas otras, controlar el proceso de diferenciación celular en células precursoras equivalentes. Esto significa que es crucial en el desarrollo embrionario, hasta el punto de que se ha probado en ratones que la eliminación de glicanos en las proteínas Notch puede provocar muerte embrionaria o malformaciones de órganos vitales como el corazón.
Algunos de los moduladores específicos que controlan este proceso son las glicosiltransferasas ubicadas en el retículo endoplásmico y el aparato de Golgi. Las proteínas Notch pasan por estos orgánulos en su proceso de maduración y pueden ser sometidas a diferentes tipos de glicosilación: glicosilación ligada a N y glicosilación ligada a O (más concretamente: glucosa ligada a O y fucosa ligada a O).
Todas las proteínas Notch son modificadas por una O-fucosa, porque comparten un rasgo común: secuencias consenso de O-fucosilación. Uno de los moduladores que intervienen en este proceso es la Fringe, una glicosiltransferasa que modifica la O-fucosa para activar o desactivar partes de la señalización, actuando como regulador positivo o negativo, respectivamente.
Clínica
Existen tres tipos de trastornos de la glicosilación ordenados según el tipo de alteraciones que se producen en el proceso de glicosilación: alteraciones congénitas, alteraciones adquiridas y alteraciones adquiridas no enzimáticas.
- Reformas congénitas: Más de 40 trastornos congénitos de la glucosilación (CGD) se han reportado en humanos. Estos pueden dividirse en cuatro grupos: trastornos de la proteína N-glucosilación, trastornos de la proteína O- glucosilación, trastornos de la glucosilación lipídica y trastornos de otras vías de glucosilación y de múltiples vías de glucosilación. No se conoce ningún tratamiento eficaz para ninguno de estos trastornos. El 80% de estos afectan al sistema nervioso.
- Reformas requeridas: En este segundo grupo los principales trastornos son enfermedades infecciosas, enfermedades autoinmunes o cáncer. En estos casos, los cambios en la glicosilación son la causa de ciertos acontecimientos biológicos. Por ejemplo, en la artritis reumatoide (RA), el cuerpo del paciente produce anticuerpos contra la enzima linfocitos galactosiltransferasa que inhibe la glicosislación del IgG. Por lo tanto, los cambios en la glucosalación N producen la inmunodeficiencia implicada en esta enfermedad. En este segundo grupo también podemos encontrar trastornos causados por mutaciones en las enzimas que controlan la glucosilación de las proteínas Notch, como el síndrome de Alagille.
- alteraciones no-enzimáticas adquiridas: También se adquieren trastornos no enzimáticos, pero se deben a la falta de enzimas que adhieren oligosacáridos a la proteína. En este grupo las enfermedades que destacan son la enfermedad de Alzheimer y la diabetes.
Todas estas enfermedades son difíciles de diagnosticar porque no afectan sólo a un órgano, sino que afectan a muchos de ellos y de diferentes formas. Como consecuencia de ello, también son difíciles de tratar. Sin embargo, gracias a los numerosos avances que se han logrado en la secuenciación de próxima generación, los científicos ahora pueden comprender mejor estos trastornos y han descubierto nuevos CDG.
Efectos sobre la eficacia terapéutica
Se ha informado que la glicosilación en mamíferos puede mejorar la eficacia terapéutica de los bioterapéuticos. Por ejemplo, se mejoró la eficacia terapéutica del interferón gamma humano recombinante, expresado en la plataforma HEK 293, contra líneas celulares de cáncer de ovario resistentes a los medicamentos.