Glándula suprarrenal
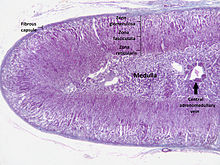
Las glándulas suprarrenales (también conocidas como glándulas suprarrenales) son glándulas endocrinas que producen una variedad de hormonas, incluida la adrenalina y los esteroides aldosterona y cortisol. Se encuentran por encima de los riñones. Cada glándula tiene una corteza externa que produce hormonas esteroides y una médula interna. La corteza suprarrenal en sí misma se divide en tres zonas principales: la zona glomerulosa, la zona fasciculada y la zona reticularis.
La corteza suprarrenal produce tres tipos principales de hormonas esteroides: mineralocorticoides, glucocorticoides y andrógenos. Los mineralocorticoides (como la aldosterona) producidos en la zona glomerulosa ayudan en la regulación de la presión arterial y el equilibrio electrolítico. Los glucocorticoides cortisol y cortisona se sintetizan en la zona fasciculada; sus funciones incluyen la regulación del metabolismo y la supresión del sistema inmunológico. La capa más interna de la corteza, la zona reticularis, produce andrógenos que se convierten en hormonas sexuales totalmente funcionales en las gónadas y otros órganos diana. La producción de hormonas esteroides se denomina esteroidogénesis e implica una serie de reacciones y procesos que tienen lugar en las células corticales. La médula produce las catecolaminas, que funcionan para producir una respuesta rápida en todo el cuerpo en situaciones de estrés.
Varias enfermedades endocrinas implican disfunciones de la glándula suprarrenal. La sobreproducción de cortisol conduce al síndrome de Cushing, mientras que la producción insuficiente se asocia con la enfermedad de Addison. La hiperplasia suprarrenal congénita es una enfermedad genética producida por la desregulación de los mecanismos de control endocrino. Una variedad de tumores pueden surgir del tejido suprarrenal y se encuentran comúnmente en imágenes médicas cuando se buscan otras enfermedades.
Estructura
Las glándulas suprarrenales están ubicadas a ambos lados del cuerpo en el retroperitoneo, arriba y ligeramente medial a los riñones. En los humanos, la glándula suprarrenal derecha tiene forma piramidal, mientras que la izquierda tiene forma semilunar o de media luna y algo más grande. Las glándulas suprarrenales miden aproximadamente 5 cm de largo, 3 cm de ancho y hasta 1 cm de grosor. Su peso combinado en un ser humano adulto oscila entre 7 y 10 gramos. Las glándulas son de color amarillento.
Las glándulas suprarrenales están rodeadas por una cápsula de grasa y se encuentran dentro de la fascia renal, que también rodea los riñones. Un tabique (pared) débil de tejido conectivo separa las glándulas de los riñones. Las glándulas suprarrenales están directamente debajo del diafragma y están unidas a los pilares del diafragma por la fascia renal.
Cada glándula suprarrenal tiene dos partes distintas, cada una con una función única, la corteza suprarrenal externa y la médula interna, las cuales producen hormonas.
Corteza suprarrenal
La corteza suprarrenal es la región externa y también la parte más grande de una glándula suprarrenal. Se divide en tres zonas separadas: zona glomerulosa, zona fasciculada y zona reticularis. Cada zona es responsable de producir hormonas específicas. La corteza suprarrenal es la capa más externa de la glándula suprarrenal. Dentro de la corteza hay tres capas, llamadas "zonas". Cuando se observa bajo un microscopio, cada capa tiene una apariencia distinta y cada una tiene una función diferente. La corteza suprarrenal se dedica a la producción de hormonas, a saber, aldosterona, cortisol y andrógenos.
Zona glomerulosa
La zona más externa de la corteza suprarrenal es la zona glomerulosa. Se encuentra inmediatamente debajo de la cápsula fibrosa de la glándula. Las células de esta capa forman grupos ovalados, separados por finas hebras de tejido conjuntivo de la cápsula fibrosa de la glándula y portan capilares anchos.
Esta capa es el sitio principal para la producción de aldosterona, un mineralocorticoide, por la acción de la enzima aldosterona sintasa. La aldosterona juega un papel importante en la regulación a largo plazo de la presión arterial.
Zona fasciculada
La zona fasciculada está situada entre la zona glomerulosa y la zona reticularis. Las células de esta capa son responsables de producir glucocorticoides como el cortisol. Es la más grande de las tres capas y representa casi el 80% del volumen de la corteza. En la zona fasciculada, las células están dispuestas en columnas orientadas radialmente hacia la médula. Las células contienen numerosas gotitas de lípidos, abundantes mitocondrias y un retículo endoplásmico liso complejo.
Zona reticular
La capa cortical más interna, la zona reticularis, se encuentra directamente adyacente a la médula. Produce andrógenos, principalmente dehidroepiandrosterona (DHEA), sulfato de DHEA (DHEA-S) y androstenediona (el precursor de la testosterona) en humanos. Sus pequeñas células forman cordones y racimos irregulares, separados por capilares y tejido conjuntivo. Las células contienen cantidades relativamente pequeñas de citoplasma y gotitas de lípidos y, a veces, muestran pigmento de lipofuscina marrón.
Médula
La médula suprarrenal se encuentra en el centro de cada glándula suprarrenal y está rodeada por la corteza suprarrenal. Las células cromafines de la médula son la principal fuente del cuerpo de catecolaminas, como la adrenalina y la noradrenalina, liberadas por la médula. Aproximadamente el 20 % de la noradrenalina (norepinefrina) y el 80 % de la adrenalina (epinefrina) se secretan aquí.
La médula suprarrenal es impulsada por el sistema nervioso simpático a través de fibras preganglionares que se originan en la médula espinal torácica, desde las vértebras T5–T11. Debido a que está inervada por fibras nerviosas preganglionares, la médula suprarrenal puede considerarse como un ganglio simpático especializado. Sin embargo, a diferencia de otros ganglios simpáticos, la médula suprarrenal carece de sinapsis definidas y libera sus secreciones directamente a la sangre.
Suministro de sangre
Las glándulas suprarrenales tienen una de las mayores tasas de suministro de sangre por gramo de tejido de cualquier órgano: hasta 60 arterias pequeñas pueden entrar en cada glándula. Tres arterias generalmente irrigan cada glándula suprarrenal:
- La arteria suprarrenal superior, rama de la arteria ferina inferior
- La arteria suprarrenal media, una rama directa de la aorta abdominal
- La arteria suprarenal inferior, rama de la arteria renal
Estos vasos sanguíneos irrigan una red de pequeñas arterias dentro de la cápsula de las glándulas suprarrenales. Los hilos delgados de la cápsula ingresan a las glándulas y les llevan sangre.
La sangre venosa es drenada de las glándulas por las venas suprarrenales, generalmente una para cada glándula:
- La vena suprarenal derecha drena en la vena cava inferior
- La vena suprarenal izquierda drena en la vena renal izquierda o la vena ferina inferior izquierda.
La vena adrenomedular central, en la médula suprarrenal, es un tipo inusual de vaso sanguíneo. Su estructura es diferente de las otras venas en que el músculo liso en su túnica media (la capa media del vaso) está dispuesto en haces conspicuos orientados longitudinalmente.
Variabilidad
Es posible que las glándulas suprarrenales no se desarrollen en absoluto o que se fusionen en la línea media detrás de la aorta. Estos están asociados con otras anomalías congénitas, como la falta de desarrollo de los riñones o los riñones fusionados. La glándula puede desarrollarse con una ausencia parcial o completa de la corteza, o puede desarrollarse en una ubicación inusual.
Función
La glándula suprarrenal secreta varias hormonas diferentes que son metabolizadas por enzimas dentro de la glándula o en otras partes del cuerpo. Estas hormonas están implicadas en una serie de funciones biológicas esenciales.
Corticosteroides
Los corticosteroides son un grupo de hormonas esteroides producidas en la corteza de la glándula suprarrenal, de ahí su nombre.
- Mineralocorticoides como la aldosterona regulan el equilibrio de sal ("mineral") y la presión arterial
- Glucocorticoides como las tasas de metabolismo de la influencia del cortisol de proteínas, grasas y azúcares ("glucosa").
- Andrógenos como deshidroepiandrosterona.
- Mineralocorticoides
La glándula suprarrenal produce aldosterona, un mineralocorticoide, que es importante en la regulación del equilibrio salino ("mineral") y el volumen sanguíneo. En los riñones, la aldosterona actúa sobre los túbulos contorneados distales y los conductos colectores aumentando la reabsorción de sodio y la excreción de iones de potasio e hidrógeno. La aldosterona es responsable de la reabsorción de alrededor del 2% del filtrado glomerular filtrado. La retención de sodio también es una respuesta del colon distal y las glándulas sudoríparas a la estimulación del receptor de aldosterona. La angiotensina II y el potasio extracelular son los dos principales reguladores de la producción de aldosterona. La cantidad de sodio presente en el cuerpo afecta el volumen extracelular, que a su vez influye en la presión arterial. Por lo tanto, los efectos de la aldosterona en la retención de sodio son importantes para la regulación de la presión arterial.
- Glucocorticoides
El cortisol es el principal glucocorticoide en humanos. En las especies que no crean cortisol, este papel lo desempeña la corticosterona. Los glucocorticoides tienen muchos efectos sobre el metabolismo. Como su nombre indica, aumentan el nivel circulante de glucosa. Este es el resultado de un aumento en la movilización de aminoácidos de las proteínas y la estimulación de la síntesis de glucosa a partir de estos aminoácidos en el hígado. Además, aumentan los niveles de ácidos grasos libres, que las células pueden utilizar como alternativa a la glucosa para obtener energía. Los glucocorticoides también tienen efectos no relacionados con la regulación de los niveles de azúcar en la sangre, incluida la supresión del sistema inmunitario y un potente efecto antiinflamatorio. El cortisol reduce la capacidad de los osteoblastos para producir tejido óseo nuevo y disminuye la absorción de calcio en el tracto gastrointestinal.
La glándula suprarrenal secreta un nivel basal de cortisol pero también puede producir ráfagas de la hormona en respuesta a la hormona adrenocorticotrópica (ACTH) de la hipófisis anterior. El cortisol no se libera uniformemente durante el día: sus concentraciones en la sangre son más altas temprano en la mañana y más bajas en la noche como resultado del ritmo circadiano de la secreción de ACTH. La cortisona es un producto inactivo de la acción de la enzima 11β-HSD sobre el cortisol. La reacción catalizada por la 11β-HSD es reversible, lo que significa que puede convertir la cortisona administrada en cortisol, la hormona biológicamente activa.
- Formación
Todas las hormonas corticosteroides comparten el colesterol como precursor común. Por lo tanto, el primer paso en la esteroidogénesis es la captación o síntesis de colesterol. Las células que producen hormonas esteroides pueden adquirir colesterol a través de dos vías. La fuente principal es el colesterol dietético transportado a través de la sangre como ésteres de colesterol dentro de las lipoproteínas de baja densidad (LDL). LDL ingresa a las células a través de endocitosis mediada por receptor. La otra fuente de colesterol es la síntesis en el retículo endoplásmico de la célula. La síntesis puede compensar cuando los niveles de LDL son anormalmente bajos. En el lisosoma, los ésteres de colesterol se convierten en colesterol libre, que luego se utiliza para la esteroidogénesis o se almacena en la célula.
La parte inicial de la conversión del colesterol en hormonas esteroides implica una serie de enzimas de la familia del citocromo P450 que se encuentran en la membrana interna de las mitocondrias. El transporte de colesterol desde la membrana externa a la interna es facilitado por la proteína reguladora aguda esteroidogénica y es el paso limitante de la velocidad de síntesis de esteroides.
Las capas de la glándula suprarrenal difieren según su función, y cada capa tiene enzimas distintas que producen diferentes hormonas a partir de un precursor común. El primer paso enzimático en la producción de todas las hormonas esteroides es la ruptura de la cadena lateral del colesterol, una reacción que da lugar a la pregnenolona como producto y es catalizada por la enzima P450scc, también conocida como colesterol desmolasa. Después de la producción de pregnenolona, las enzimas específicas de cada capa cortical la modifican aún más. Las enzimas involucradas en este proceso incluyen P450 mitocondriales y microsomales e hidroxiesteroide deshidrogenasas. Por lo general, se requieren varios pasos intermedios en los que la pregnenolona se modifica varias veces para formar las hormonas funcionales. Las enzimas que catalizan reacciones en estas vías metabólicas están implicadas en varias enfermedades endocrinas. Por ejemplo, la forma más común de hiperplasia suprarrenal congénita se desarrolla como resultado de la deficiencia de 21-hidroxilasa, una enzima involucrada en un paso intermedio de la producción de cortisol.
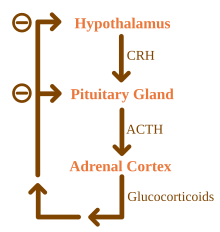
- Reglamento
Los glucocorticoides están bajo la influencia reguladora del eje hipotálamo-hipófisis-suprarrenal (HPA). La síntesis de glucocorticoides es estimulada por la hormona adrenocorticotrópica (ACTH), una hormona liberada en el torrente sanguíneo por la hipófisis anterior. A su vez, la producción de ACTH es estimulada por la presencia de la hormona liberadora de corticotropina (CRH), que es liberada por las neuronas del hipotálamo. La ACTH actúa primero sobre las células suprarrenales aumentando los niveles de StAR dentro de las células y luego de todas las enzimas esteroidogénicas P450. El eje HPA es un ejemplo de un sistema de retroalimentación negativa, en el que el propio cortisol actúa como un inhibidor directo de la síntesis de CRH y ACTH. El eje HPA también interactúa con el sistema inmunitario a través del aumento de la secreción de ACTH en presencia de ciertas moléculas de la respuesta inflamatoria.
La secreción de mineralocorticoides está regulada principalmente por el sistema renina-angiotensina-aldosterona (SRAA), la concentración de potasio y, en menor medida, la concentración de ACTH. Los sensores de presión arterial en el aparato yuxtaglomerular de los riñones liberan la enzima renina en la sangre, lo que inicia una cascada de reacciones que conducen a la formación de angiotensina II. Los receptores de angiotensina en las células de la zona glomerulosa reconocen la sustancia y, al unirse, estimulan la liberación de aldosterona.
Andrógenos
Las células de la zona reticular de las glándulas suprarrenales producen hormonas sexuales masculinas, o andrógenos, de los cuales el más importante es la DHEA. En general, estas hormonas no tienen un efecto global en el cuerpo masculino y se convierten en andrógenos más potentes como la testosterona y la DHT o en estrógenos (hormonas sexuales femeninas) en las gónadas, actuando así como un intermediario metabólico.
Catecolaminas
Principalmente conocidas en los Estados Unidos como epinefrina y norepinefrina, la adrenalina y la noradrenalina son catecolaminas, compuestos solubles en agua que tienen una estructura formada por un grupo catecol y un grupo amina. Las glándulas suprarrenales son responsables de la mayor parte de la adrenalina que circula en el cuerpo, pero solo de una pequeña cantidad de noradrenalina circulante. Estas hormonas son liberadas por la médula suprarrenal, que contiene una densa red de vasos sanguíneos. La adrenalina y la noradrenalina actúan interactuando con los receptores adrenérgicos de todo el cuerpo, con efectos que incluyen un aumento de la presión arterial y la frecuencia cardíaca. Las acciones de la adrenalina y la noradrenalina son responsables de la respuesta de lucha o huida, caracterizada por una aceleración de la respiración y el ritmo cardíaco, un aumento de la presión arterial y la constricción de los vasos sanguíneos en muchas partes del cuerpo.
- Formación
Las catecolaminas se producen en las células cromafines de la médula de la glándula suprarrenal, a partir de la tirosina, un aminoácido no esencial derivado de los alimentos o producido a partir de la fenilalanina en el hígado. La enzima tirosina hidroxilasa convierte la tirosina en L-DOPA en el primer paso de la síntesis de catecolaminas. Luego, la L-DOPA se convierte en dopamina antes de que pueda convertirse en noradrenalina. En el citosol, la noradrenalina se convierte en epinefrina por la enzima feniletanolamina N-metiltransferasa (PNMT) y se almacena en gránulos. Los glucocorticoides producidos en la corteza suprarrenal estimulan la síntesis de catecolaminas al aumentar los niveles de tirosina hidroxilasa y PNMT.
La liberación de catecolaminas es estimulada por la activación del sistema nervioso simpático. Los nervios esplácnicos del sistema nervioso simpático inervan la médula de la glándula suprarrenal. Cuando se activa, provoca la liberación de catecolaminas de los gránulos de almacenamiento al estimular la apertura de los canales de calcio en la membrana celular.
Expresión de genes y proteínas
El genoma humano incluye aproximadamente 20 000 genes que codifican proteínas y el 70 % de estos genes se expresan en las glándulas suprarrenales adultas normales. Solo unos 250 genes se expresan más específicamente en las glándulas suprarrenales en comparación con otros órganos y tejidos. Los genes específicos de las glándulas suprarrenales con el nivel más alto de expresión incluyen miembros de la superfamilia de enzimas del citocromo P450. Las proteínas correspondientes se expresan en los diferentes compartimentos de la glándula suprarrenal, como CYP11A1, HSD3B2 y FDX1 involucradas en la síntesis de hormonas esteroides y expresadas en capas de células corticales, y PNMT y DBH involucradas en la síntesis de noradrenalina y adrenalina y expresadas en la médula.
Desarrollo
Las glándulas suprarrenales están compuestas por dos tipos heterogéneos de tejido. En el centro está la médula suprarrenal, que produce adrenalina y noradrenalina y las libera al torrente sanguíneo, como parte del sistema nervioso simpático. Alrededor de la médula se encuentra la corteza, que produce una variedad de hormonas esteroides. Estos tejidos provienen de diferentes precursores embriológicos y tienen distintas vías de desarrollo prenatal. La corteza de la glándula suprarrenal se deriva del mesodermo, mientras que la médula se deriva de la cresta neural, que es de origen ectodérmico.
Las glándulas suprarrenales en un bebé recién nacido son mucho más grandes en proporción al tamaño del cuerpo que en un adulto. Por ejemplo, a la edad de tres meses las glándulas son cuatro veces más grandes que los riñones. El tamaño de las glándulas disminuye relativamente después del nacimiento, principalmente debido a la contracción de la corteza. La corteza, que desaparece casi por completo al año de edad, se desarrolla de nuevo entre los 4 y los 5 años. Las glándulas pesan aproximadamente 1 g al nacer y se desarrollan hasta alcanzar un peso adulto de aproximadamente 4 gramos cada una. En un feto, las glándulas se detectan por primera vez después de la sexta semana de desarrollo.
Corteza
El tejido de la corteza suprarrenal se deriva del mesodermo intermedio. Aparece por primera vez 33 días después de la fertilización, muestra capacidades de producción de hormonas esteroides en la octava semana y experimenta un rápido crecimiento durante el primer trimestre del embarazo. La corteza suprarrenal fetal es diferente de su contraparte adulta, ya que se compone de dos zonas distintas: la interna "fetal" zona, que lleva la mayor parte de la actividad productora de hormonas, y la externa "definitiva" zona que se encuentra en fase proliferativa. La zona fetal produce grandes cantidades de andrógenos suprarrenales (hormonas sexuales masculinas) que la placenta utiliza para la biosíntesis de estrógenos. El desarrollo cortical de la glándula suprarrenal está regulado principalmente por ACTH, una hormona producida por la glándula pituitaria que estimula la síntesis de cortisol. Durante la mitad de la gestación, la zona fetal ocupa la mayor parte del volumen cortical y produce 100-200 mg/día de DHEA-S, un andrógeno y precursor tanto de andrógenos como de estrógenos (hormonas sexuales femeninas). Las hormonas suprarrenales, especialmente los glucocorticoides como el cortisol, son esenciales para el desarrollo prenatal de los órganos, particularmente para la maduración de los pulmones. La glándula suprarrenal disminuye de tamaño después del nacimiento debido a la rápida desaparición de la zona fetal, con la correspondiente disminución de la secreción de andrógenos.
Adrenarquia
Durante la primera infancia, la síntesis y secreción de andrógenos sigue siendo baja, pero varios años antes de la pubertad (entre los 6 y los 8 años de edad) se producen cambios tanto en los aspectos anatómicos como funcionales de la producción de andrógenos corticales que conducen a una mayor secreción de los esteroides DHEA y DHEA. -S. Estos cambios son parte de un proceso llamado adrenarquia, que solo se ha descrito en humanos y algunos otros primates. La adrenarquia es independiente de la ACTH o las gonadotropinas y se correlaciona con un engrosamiento progresivo de la capa de la zona reticular de la corteza. Funcionalmente, la adrenarquia proporciona una fuente de andrógenos para el desarrollo del vello axilar y púbico antes del comienzo de la pubertad.
Médula
La médula suprarrenal se deriva de las células de la cresta neural, que provienen de la capa ectodérmica del embrión. Estas células migran desde su posición inicial y se agregan en las proximidades de la aorta dorsal, un vaso sanguíneo primitivo, lo que activa la diferenciación de estas células mediante la liberación de proteínas conocidas como BMP. Luego, estas células experimentan una segunda migración desde la aorta dorsal para formar la médula suprarrenal y otros órganos del sistema nervioso simpático. Las células de la médula suprarrenal se llaman células cromafines porque contienen gránulos que se tiñen con sales de cromo, una característica que no está presente en todos los órganos simpáticos. Alguna vez se pensó que los glucocorticoides producidos en la corteza suprarrenal eran responsables de la diferenciación de las células cromafines. Investigaciones más recientes sugieren que la BMP-4 secretada en el tejido suprarrenal es la principal responsable de esto, y que los glucocorticoides solo juegan un papel en el desarrollo posterior de las células.
Importancia clínica
La función normal de la glándula suprarrenal puede verse afectada por afecciones como infecciones, tumores, trastornos genéticos y enfermedades autoinmunes, o como efecto secundario de la terapia médica. Estos trastornos afectan a la glándula ya sea directamente (como en el caso de infecciones o enfermedades autoinmunes) o como resultado de la desregulación de la producción de hormonas (como en algunos tipos de síndrome de Cushing) que conducen a un exceso o insuficiencia de hormonas suprarrenales y las hormonas relacionadas. síntomas.
Sobreproducción de corticosteroides
Síndrome de Cushing
El síndrome de Cushing es la manifestación del exceso de glucocorticoides. Puede ser el resultado de un tratamiento prolongado con glucocorticoides o estar causado por una enfermedad de base que produzca alteraciones en el eje HPA o en la producción de cortisol. Las causas se pueden clasificar además en dependientes de ACTH o independientes de ACTH. La causa más común del síndrome de Cushing endógeno es un adenoma hipofisario que provoca una producción excesiva de ACTH. La enfermedad produce una amplia variedad de signos y síntomas que incluyen obesidad, diabetes, aumento de la presión arterial, vello corporal excesivo (hirsutismo), osteoporosis, depresión y, de manera más particular, estrías en la piel, causadas por su adelgazamiento progresivo.
Aldosteronismo primario
Cuando la zona glomerulosa produce un exceso de aldosterona, el resultado es aldosteronismo primario. Las causas de esta afección son la hiperplasia bilateral (crecimiento excesivo de tejido) de las glándulas o los adenomas productores de aldosterona (una afección llamada síndrome de Conn). El aldosteronismo primario produce hipertensión y desequilibrio electrolítico, aumentando la depleción de potasio y la retención de sodio.
Insuficiencia suprarrenal
La insuficiencia suprarrenal (la deficiencia de glucocorticoides) ocurre en aproximadamente 5 de cada 10 000 personas en la población general. Las enfermedades clasificadas como insuficiencia suprarrenal primaria (incluida la enfermedad de Addison y las causas genéticas) afectan directamente a la corteza suprarrenal. Si un problema que afecta al eje hipotálamo-pituitario-suprarrenal surge fuera de la glándula, se trata de una insuficiencia suprarrenal secundaria.
Enfermedad de Addison
La enfermedad de Addison se refiere al hipoadrenalismo primario, que es una deficiencia en la producción de glucocorticoides y mineralocorticoides por parte de la glándula suprarrenal. En el mundo occidental, la enfermedad de Addison es más comúnmente una condición autoinmune, en la que el cuerpo produce anticuerpos contra las células de la corteza suprarrenal. En todo el mundo, la enfermedad es causada con mayor frecuencia por infección, especialmente por tuberculosis. Una característica distintiva de la enfermedad de Addison es la hiperpigmentación de la piel, que se presenta con otros síntomas inespecíficos como la fatiga.
Una complicación que se observa en la enfermedad de Addison no tratada y otros tipos de insuficiencia suprarrenal primaria es la crisis suprarrenal, una emergencia médica en la que los niveles bajos de glucocorticoides y mineralocorticoides provocan un shock hipovolémico y síntomas como vómitos y fiebre. Una crisis suprarrenal puede conducir progresivamente al estupor y al coma. El manejo de las crisis suprarrenales incluye la aplicación de inyecciones de hidrocortisona.
Insuficiencia suprarrenal secundaria
En la insuficiencia suprarrenal secundaria, una disfunción del eje hipotálamo-pituitario-suprarrenal provoca una disminución de la estimulación de la corteza suprarrenal. Además de la supresión del eje por la terapia con glucocorticoides, la causa más común de insuficiencia suprarrenal secundaria son los tumores que afectan la producción de hormona adrenocorticotrópica (ACTH) por la glándula pituitaria. Este tipo de insuficiencia suprarrenal por lo general no afecta la producción de mineralocorticoides, que en cambio están bajo la regulación del sistema renina-angiotensina.
Hiperplasia suprarrenal congénita
La hiperplasia suprarrenal congénita es una enfermedad congénita en la que las mutaciones de las enzimas que producen hormonas esteroides provocan una deficiencia de glucocorticoides y un mal funcionamiento del ciclo de retroalimentación negativa del eje HPA. En el eje HPA, el cortisol (un glucocorticoide) inhibe la liberación de CRH y ACTH, hormonas que a su vez estimulan la síntesis de corticosteroides. Como el cortisol no se puede sintetizar, estas hormonas se liberan en grandes cantidades y, en su lugar, estimulan la producción de otros esteroides suprarrenales. La forma más común de hiperplasia suprarrenal congénita se debe a la deficiencia de 21-hidroxilasa. La 21-hidroxilasa es necesaria para la producción de mineralocorticoides y glucocorticoides, pero no de andrógenos. Por lo tanto, la estimulación con ACTH de la corteza suprarrenal induce la liberación de cantidades excesivas de andrógenos suprarrenales, lo que puede conducir al desarrollo de genitales ambiguos y características sexuales secundarias.
Tumores suprarrenales
Los tumores suprarrenales se encuentran comúnmente como incidentalomas, tumores asintomáticos inesperados que se encuentran durante las imágenes médicas. Se ven en alrededor del 3,4% de las tomografías computarizadas, y en la mayoría de los casos son adenomas benignos. Los carcinomas suprarrenales son muy raros, con una incidencia de 1 caso por millón por año.
Los feocromocitomas son tumores de la médula suprarrenal que surgen de las células cromafines. Pueden producir una variedad de síntomas inespecíficos, que incluyen dolores de cabeza, sudoración, ansiedad y palpitaciones. Los signos comunes incluyen hipertensión y taquicardia. La cirugía, especialmente la laparoscopia suprarrenal, es el tratamiento más común para los feocromocitomas pequeños.
Historia
A Bartolomeo Eustachi, un anatomista italiano, se le atribuye la primera descripción de las glándulas suprarrenales en 1563–4. Sin embargo, estas publicaciones formaban parte de la biblioteca papal y no recibieron la atención del público, que se recibió por primera vez con las ilustraciones de Caspar Bartholin the Elder en 1611.
Las glándulas suprarrenales reciben su nombre por su ubicación en relación con los riñones. El término "adrenal" proviene del latín ad, "cerca", y ren, "riñón". Del mismo modo, "suprarrenal", como lo denominó Jean Riolan el Joven en 1629, se deriva del latín supra, "arriba", y ren, "riñón", también. La naturaleza suprarrenal de las glándulas no se aceptó realmente hasta el siglo XIX, cuando los anatomistas aclararon la naturaleza sin conductos de las glándulas y su probable función secretora; antes de esto, hubo cierto debate sobre si las glándulas eran realmente suprarrenales o parte del sistema nervioso central. riñón.
Uno de los trabajos más reconocidos sobre las glándulas suprarrenales llegó en 1855 con la publicación de Sobre los efectos constitucionales y locales de la enfermedad de la cápsula suprarrenal, del médico inglés Thomas Addison. En su monografía, Addison describió lo que el médico francés George Trousseau llamaría más tarde la enfermedad de Addison, un epónimo que todavía se usa hoy en día para una afección de insuficiencia suprarrenal y sus manifestaciones clínicas relacionadas. En 1894, los fisiólogos ingleses George Oliver y Edward Schafer estudiaron la acción de los extractos suprarrenales y observaron sus efectos presores. En las décadas siguientes, varios médicos experimentaron con extractos de la corteza suprarrenal para tratar la enfermedad de Addison. Edward Calvin Kendall, Philip Hench y Tadeusz Reichstein recibieron el Premio Nobel de Fisiología o Medicina de 1950 por sus descubrimientos sobre la estructura y los efectos de las hormonas suprarrenales.
Contenido relacionado
Pajaro secretario
Tropaeolum
Gastrotric