Geometría molecular tetraédrica
En una geometría molecular tetraédrica, un átomo central se ubica en el centro con cuatro sustituyentes que se ubican en las esquinas de un tetraedro. Los ángulos de enlace son cos−1(−1⁄3) = 109.4712206...° ≈ 109.5° cuando los cuatro sustituyentes son iguales, como en el metano (CH4) así como sus análogos más pesados. El metano y otras moléculas tetraédricas perfectamente simétricas pertenecen al grupo puntual Td, pero la mayoría de las moléculas tetraédricas tienen una simetría menor. Las moléculas tetraédricas pueden ser quirales.
Ángulo de enlace tetraédrico


El ángulo de enlace de una molécula tetraédrica simétrica como CH4 se puede calcular utilizando el producto escalar de dos vectores. Como se muestra en el diagrama de la izquierda, la molécula se puede inscribir en un cubo con el átomo tetravalente (por ejemplo, carbono) en el centro del cubo, que es el origen de las coordenadas, O. Los cuatro átomos monovalentes (por ejemplo, hidrógenos) están en las cuatro esquinas de el cubo (A, B, C, D) elegido de modo que no haya dos átomos en esquinas adyacentes unidos por un solo borde del cubo.
Si la longitud de la arista del cubo se elige en 2 unidades, entonces los dos enlaces OA y OB corresponden a los vectores a = (1, –1, 1) y b = (1, 1, –1), y el ángulo de enlace θ es el ángulo entre estos dos vectores. Este ángulo se puede calcular a partir del producto escalar de los dos vectores, definido como a • b = ||a|| ||b|| cos θ donde ||a|| denota la longitud del vector a. Como se muestra en el diagrama, el producto escalar aquí es –1 y la longitud de cada vector es √3, de modo que cos θ = –1/3 y el ángulo del enlace tetraédrico θ = arccos(–1/3) ≃ 109,47°.
En el diagrama de la derecha se muestra una prueba alternativa que utiliza trigonometría.
Ejemplos
Química del grupo principal

Aparte de prácticamente todos los compuestos orgánicos saturados, la mayoría de los compuestos de Si, Ge y Sn son tetraédricos. A menudo, las moléculas tetraédricas presentan enlaces múltiples a los ligandos externos, como en el tetróxido de xenón (XeO4), el ion perclorato (ClO−4), el ion sulfato (SO2−4), el ion fosfato (PO3−4). El trifluoruro de tiazilo (SNF3) es tetraédrico y presenta un triple enlace de azufre a nitrógeno.
Otras moléculas tienen una disposición tetraédrica de pares de electrones alrededor de un átomo central; por ejemplo, amoníaco (NH3) con el átomo de nitrógeno rodeado por tres hidrógenos y un par libre. Sin embargo, la clasificación habitual considera sólo los átomos unidos y no el par libre, por lo que el amoníaco se considera en realidad piramidal. Los ángulos H – N – H son 107 °, contraídos desde 109,5 °. Esta diferencia se atribuye a la influencia del par solitario que ejerce una influencia repulsiva mayor que un átomo enlazado.
Química de los metales de transición
Nuevamente, la geometría está muy extendida, particularmente en los complejos donde el metal tiene una configuración d0 o d10. Los ejemplos ilustrativos incluyen tetrakis(trifenilfosfina)paladio(0) (Pd[P(C6H5)3]4), carbonilo de níquel (Ni(CO)4) y tetracloruro de titanio (TiCl4). Muchos complejos con capas d incompletamente llenas suelen ser tetraédricos, p. los tetrahaluros de hierro (II), cobalto (II) y níquel (II).
Estructura del agua
En la fase gaseosa, una sola molécula de agua tiene un átomo de oxígeno rodeado por dos hidrógenos y dos pares libres, y el H2 La geometría O se describe simplemente como doblada sin considerar los pares solitarios no enlazantes.
Sin embargo, en agua líquida o en hielo, los pares solitarios forman enlaces de hidrógeno con las moléculas de agua vecinas. La disposición más común de los átomos de hidrógeno alrededor de un oxígeno es tetraédrica con dos átomos de hidrógeno unidos covalentemente al oxígeno y dos unidos mediante enlaces de hidrógeno. Dado que los enlaces de hidrógeno varían en longitud, muchas de estas moléculas de agua no son simétricas y forman tetraedros irregulares transitorios entre sus cuatro átomos de hidrógeno asociados.
Estructuras bittraédricas
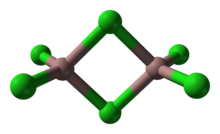
Muchos compuestos y complejos adoptan estructuras bittraédricas. En este motivo, los dos tetraedros comparten un borde común. El polímero inorgánico disulfuro de silicio presenta una cadena infinita de tetraedros de bordes compartidos. En un sistema de hidrocarburos completamente saturado, la molécula bittraédrica C8H6 se ha propuesto como candidata a la molécula con el enlace simple carbono-carbono más corto posible.
Excepciones y distorsiones
La inversión de tetraedros ocurre ampliamente en la química orgánica y de grupos principales. La inversión de Walden ilustra las consecuencias estereoquímicas de la inversión en el carbono. La inversión de nitrógeno en amoníaco también implica la formación transitoria de NH3 plano.
Geometría tetraédrica invertida
Las restricciones geométricas en una molécula pueden causar una severa distorsión de la geometría tetraédrica idealizada. En compuestos que presentan "invertida" En la geometría tetraédrica de un átomo de carbono, los cuatro grupos unidos a este carbono están en un lado de un plano. El átomo de carbono se encuentra en o cerca del vértice de una pirámide cuadrada con los otros cuatro grupos en las esquinas.
Los ejemplos más simples de moléculas orgánicas que muestran una geometría tetraédrica invertida son los propelanos más pequeños, como el [1.1.1]propelano; o más generalmente los paddlanes y el piramidano ([3.3.3.3]fenestrano). Por lo general, estas moléculas se tensan, lo que da como resultado una mayor reactividad.
Planarización
Un tetraedro también se puede distorsionar aumentando el ángulo entre dos de los enlaces. En el caso extremo, se produce un aplanamiento. En el caso del carbono, este fenómeno se puede observar en una clase de compuestos llamados fenestranos.
Moléculas tetraédricas sin átomo central
Algunas moléculas tienen una geometría tetraédrica sin átomo central. Un ejemplo inorgánico es el tetrafósforo (P4) que tiene cuatro átomos de fósforo en los vértices de un tetraedro y cada uno unido a los otros tres. Un ejemplo orgánico es el tetraedrano (C4H4) con cuatro átomos de carbono, cada uno unido a un hidrógeno y los otros tres carbonos. En este caso, el ángulo teórico de enlace C-C-C es de sólo 60° (en la práctica, el ángulo será mayor debido a los enlaces doblados), lo que representa un gran grado de tensión.
