Geometría molecular
La geometría molecular es la disposición tridimensional de los átomos que constituyen una molécula. Incluye la forma general de la molécula, así como longitudes de enlace, ángulos de enlace, ángulos de torsión y cualquier otro parámetro geométrico que determine la posición de cada átomo.
La geometría molecular influye en varias propiedades de una sustancia, incluida su reactividad, polaridad, fase de la materia, color, magnetismo y actividad biológica. Los ángulos entre los enlaces que forma un átomo dependen sólo débilmente del resto de la molécula, es decir, pueden entenderse como propiedades aproximadamente locales y, por lo tanto, transferibles.
Determinación
La geometría molecular se puede determinar mediante varios métodos espectroscópicos y métodos de difracción. La espectroscopia de IR, microondas y Raman puede proporcionar información sobre la geometría de la molécula a partir de los detalles de la absorbancia vibratoria y rotacional detectada por estas técnicas. La cristalografía de rayos X, la difracción de neutrones y la difracción de electrones pueden dar una estructura molecular para sólidos cristalinos en función de la distancia entre los núcleos y la concentración de densidad de electrones. La difracción de electrones de gas se puede utilizar para moléculas pequeñas en la fase gaseosa. Los métodos NMR y FRET se pueden utilizar para determinar información complementaria, incluidas distancias relativas, ángulos diédricos, ángulos y conectividad. Las geometrías moleculares se determinan mejor a baja temperatura porque a temperaturas más altas la estructura molecular se promedia sobre geometrías más accesibles (consulte la siguiente sección). Las moléculas más grandes a menudo existen en múltiples geometrías estables (isomerismo conformacional) que tienen una energía cercana en la superficie de energía potencial. Las geometrías también se pueden calcular mediante métodos de química cuántica ab initio con gran precisión. La geometría molecular puede ser diferente como sólido, en solución y como gas.
La posición de cada átomo está determinada por la naturaleza de los enlaces químicos por los que está conectado a sus átomos vecinos. La geometría molecular se puede describir por las posiciones de estos átomos en el espacio, evocando longitudes de enlace de dos átomos unidos, ángulos de enlace de tres átomos conectados y ángulos de torsión (ángulos diédricos) de tres enlaces consecutivos.
La influencia de la excitación térmica.
Dado que los movimientos de los átomos en una molécula están determinados por la mecánica cuántica, el "movimiento" debe definirse de manera mecánica cuántica. La traslación y la rotación de los movimientos mecánicos cuánticos generales (externos) apenas cambian la geometría de la molécula. (Hasta cierto punto, la rotación influye en la geometría a través de las fuerzas de Coriolis y la distorsión centrífuga, pero esto es insignificante para la presente discusión). Además de la traslación y la rotación, un tercer tipo de movimiento es la vibración molecular, que corresponde a los movimientos internos de los átomos tales como como estiramiento de enlace y variación del ángulo de enlace. Las vibraciones moleculares son armónicas (al menos en buena aproximación), y los átomos oscilan alrededor de sus posiciones de equilibrio, incluso en el cero absoluto de temperatura.n = 0 representado en el artículo sobre el oscilador armónico cuántico). A temperaturas más altas, los modos de vibración pueden excitarse térmicamente (en una interpretación clásica, esto se expresa afirmando que "las moléculas vibrarán más rápido"), pero todavía oscilan alrededor de la geometría reconocible de la molécula.
Para tener una idea de la probabilidad de que la vibración de la molécula pueda excitarse térmicamente, inspeccionamos el factor de Boltzmann β ≡ exp(−Δ mi/kT), donde Δ E es la energía de excitación del modo vibratorio, k la constante de Boltzmann y T la temperatura absoluta. A 298 K (25 °C), los valores típicos del factor β de Boltzmann son:
- β = 0.089 para Δ E = 500 cm
- β = 0.008 para Δ E = 1000 cm
- β = 0,0007 para Δ E = 1500 cm.
(El centímetro recíproco es una unidad de energía que se usa comúnmente en espectroscopia infrarroja; 1 cm corresponde a1,239 84 × 10 eV). Cuando la energía de excitación es de 500 cm, entonces aproximadamente el 8,9 por ciento de las moléculas se excitan térmicamente a temperatura ambiente. Para poner esto en perspectiva: la energía vibratoria de excitación más baja en el agua es el modo de flexión (alrededor de 1600 cm). Por lo tanto, a temperatura ambiente, menos del 0,07 por ciento de todas las moléculas de una determinada cantidad de agua vibrarán más rápido que en el cero absoluto.
Como se indicó anteriormente, la rotación apenas influye en la geometría molecular. Pero, como movimiento mecánico cuántico, se excita térmicamente a temperaturas relativamente bajas (en comparación con la vibración). Desde un punto de vista clásico, se puede afirmar que a temperaturas más altas, más moléculas rotarán más rápido, lo que implica que tienen una velocidad angular y un momento angular más altos. En el lenguaje de la mecánica cuántica: más estados propios de mayor momento angular se pueblan térmicamente con temperaturas en aumento. Las energías típicas de excitación rotacional son del orden de unos pocos cm. Los resultados de muchos experimentos espectroscópicos se amplían porque implican un promedio sobre estados rotacionales. A menudo es difícil extraer geometrías de espectros a altas temperaturas, porque el número de estados de rotación probados en el promedio experimental aumenta con el aumento de la temperatura. Por lo tanto, solo se puede esperar que muchas observaciones espectroscópicas produzcan geometrías moleculares confiables a temperaturas cercanas al cero absoluto, porque a temperaturas más altas, demasiados estados rotacionales más altos están poblados térmicamente.
Vinculación
Las moléculas, por definición, se mantienen unidas con mayor frecuencia con enlaces covalentes que involucran enlaces simples, dobles y/o triples, donde un "enlace" es un par de electrones compartidos (el otro método de enlace entre átomos se llama enlace iónico e involucra un catión positivo y un anión negativo).
Las geometrías moleculares se pueden especificar en términos de 'longitudes de enlace', 'ángulos de enlace' y 'ángulos de torsión'. La longitud del enlace se define como la distancia promedio entre los núcleos de dos átomos unidos en cualquier molécula dada. Un ángulo de enlace es el ángulo formado entre tres átomos a través de al menos dos enlaces. Para cuatro átomos unidos en una cadena, el ángulo de torsión es el ángulo entre el plano formado por los primeros tres átomos y el plano formado por los últimos tres átomos.
Existe una relación matemática entre los ángulos de enlace de un átomo central y cuatro átomos periféricos (etiquetados del 1 al 4) expresada por el siguiente determinante. Esta restricción elimina un grado de libertad de las opciones de (originalmente) seis ángulos de enlace libres para dejar solo cinco opciones de ángulos de enlace. (Observe que los ángulos θ 11, θ 22, θ 33 y θ 44 son siempre cero y que esta relación se puede modificar para un número diferente de átomos periféricos expandiendo/contrayendo la matriz cuadrada).
La geometría molecular está determinada por el comportamiento mecánico cuántico de los electrones. Usando la aproximación del enlace de valencia, esto se puede entender por el tipo de enlaces entre los átomos que forman la molécula. Cuando los átomos interactúan para formar un enlace químico, se dice que los orbitales atómicos de cada átomo se combinan en un proceso llamado hibridación orbital. Los dos tipos de enlaces más comunes son los enlaces sigma (normalmente formados por orbitales híbridos) y los enlaces pi (formados por orbitales p no hibridados para los átomos de los elementos del grupo principal). La geometría también se puede entender mediante la teoría de orbitales moleculares donde los electrones están deslocalizados.
La comprensión del comportamiento ondulatorio de los electrones en átomos y moléculas es el tema de la química cuántica.
Isómeros
Los isómeros son tipos de moléculas que comparten una fórmula química pero tienen geometrías diferentes, lo que da como resultado diferentes propiedades:
- Una sustancia pura se compone de un solo tipo de isómero de una molécula (todos tienen la misma estructura geométrica).
- Los isómeros estructurales tienen la misma fórmula química pero diferentes arreglos físicos, a menudo formando geometrías moleculares alternas con propiedades muy diferentes. Los átomos no están enlazados (conectados) entre sí en el mismo orden.
- Los isómeros funcionales son tipos especiales de isómeros estructurales, donde ciertos grupos de átomos exhiben un tipo especial de comportamiento, como un éter o un alcohol.
- Los estereoisómeros pueden tener muchas propiedades fisicoquímicas similares (punto de fusión, punto de ebullición) y, al mismo tiempo, actividades bioquímicas muy diferentes. Esto se debe a que exhiben una lateralidad que se encuentra comúnmente en los sistemas vivos. Una manifestación de esta quiralidad o lateralidad es que tienen la capacidad de rotar la luz polarizada en diferentes direcciones.
- El plegamiento de proteínas se refiere a las geometrías complejas y los diferentes isómeros que pueden tomar las proteínas.
Tipos de estructura molecular
Un ángulo de enlace es el ángulo geométrico entre dos enlaces adyacentes. Algunas formas comunes de moléculas simples incluyen:
- Lineal: en un modelo lineal, los átomos están conectados en línea recta. Los ángulos de enlace se establecen en 180°. Por ejemplo, el dióxido de carbono y el óxido nítrico tienen una forma molecular lineal.
- Planar trigonal: Las moléculas con forma plana trigonal son algo triangulares y en un plano (planas). En consecuencia, los ángulos de enlace se fijan en 120°. Por ejemplo, trifluoruro de boro.
- Angular: Las moléculas angulares (también llamadas dobladas o en forma de V) tienen una forma no lineal. Por ejemplo, el agua (H 2 O), que tiene un ángulo de unos 105°. Una molécula de agua tiene dos pares de electrones enlazados y dos pares solitarios no compartidos.
- Tetraédrico: Tetra- significa cuatro, y -édrico se relaciona con una cara de un sólido, por lo que "tetraédrico" significa literalmente "que tiene cuatro caras". Esta forma se encuentra cuando hay cuatro enlaces en un átomo central, sin pares de electrones adicionales no compartidos. De acuerdo con la VSEPR (teoría de la repulsión del par de electrones de la capa de valencia), los ángulos de enlace entre los enlaces de electrones son arccos(−1/3) = 109,47°. Por ejemplo, el metano (CH 4) es una molécula tetraédrica.
- Octaédrico: Octa- significa ocho, y -édrico se relaciona con una cara de un sólido, por lo que "octaédrico" significa "que tiene ocho caras". El ángulo de enlace es de 90 grados. Por ejemplo, el hexafluoruro de azufre (SF 6) es una molécula octaédrica.
- Piramidal trigonal: una molécula piramidal trigonal tiene forma de pirámide con una base triangular. A diferencia de las formas planas lineales y trigonales, pero similares a la orientación tetraédrica, las formas piramidales requieren tres dimensiones para separar completamente los electrones. Aquí, solo hay tres pares de electrones enlazados, dejando un par solitario no compartido. Par solitario: las repulsiones de pares de enlaces cambian el ángulo de enlace del ángulo tetraédrico a un valor ligeramente más bajo. Por ejemplo, amoníaco (NH 3).
Tabla VSEPR
Los ángulos de enlace en la siguiente tabla son ángulos ideales de la teoría VSEPR simple (pronunciada "Teoría de Vesper"), seguidos del ángulo real para el ejemplo dado en la siguiente columna donde esto difiere. Para muchos casos, como trigonal piramidal e inclinado, el ángulo real del ejemplo difiere del ángulo ideal, y los ejemplos difieren en cantidades diferentes. Por ejemplo, el ángulo del H 2 S (92°) difiere del ángulo tetraédrico en mucho más que el ángulo del H 2 O (104,48°).
| Átomos unidos alátomo central | Pares solitarios | Dominios de electrones(número estérico) | Forma | Ángulo de enlace ideal(ángulo de enlace del ejemplo) | Ejemplo | Imagen |
|---|---|---|---|---|---|---|
| 2 | 0 | 2 | lineal | 180° | CO2 _ | |
| 3 | 0 | 3 | trigonal plana | 120° | BF 3 | |
| 2 | 1 | 3 | doblado | 120° (119°) | TAN 2 | |
| 4 | 0 | 4 | tetraédrico | 109,5° | Canal 4 |  |
| 3 | 1 | 4 | piramidal trigonal | 109,5 (107,8°) | NH 3 | |
| 2 | 2 | 4 | doblado | 109,5° (104,48°) | H2O _ _ | |
| 5 | 0 | 5 | triangular bipiramidal | 90°, 120° | PCl 5 |  |
| 4 | 1 | 5 | balancín | ax–ax 180° (173,1°),eq–eq 120° (101,6°),ax–eq 90° | SF 4 | |
| 3 | 2 | 5 | en forma de T | 90° (87,5°), 180° (175°) | CLF 3 | |
| 2 | 3 | 5 | lineal | 180° | XeF 2 | |
| 6 | 0 | 6 | octaédrico | 90°, 180° | SF 6 |  |
| 5 | 1 | 6 | pirámide cuadrada | 90° (84,8°) | BRF 5 | |
| 4 | 2 | 6 | plano cuadrado | 90°, 180° | XeF 4 | |
| 7 | 0 | 7 | bipiramidal pentagonal | 90°, 72°, 180° | SI 7 |  |
| 6 | 1 | 7 | piramidal pentagonal | 72°, 90°, 144° | XeOF−5 | |
| 5 | 2 | 7 | plano pentagonal | 72°, 144° | XeF−5 | |
| 8 | 0 | 8 | cuadrado antiprismático | XeF2−8 | ||
| 9 | 0 | 9 | prismático trigonal tricpado | ReH2−9 |  |
Representaciones 3D
- Línea o palo: los núcleos atómicos no están representados, solo los enlaces como palos o líneas. Como en las estructuras moleculares 2D de este tipo, los átomos están implícitos en cada vértice.
 |  | 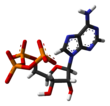 |  |
- Gráfico de densidad de electrones: muestra la densidad de electrones determinada ya sea cristalográficamente o usando mecánica cuántica en lugar de átomos o enlaces distintos.
 |  |
- Bola y palo: los núcleos atómicos están representados por esferas (bolas) y los enlaces como palos.
 |  | 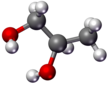 |  |
- Modelos de relleno de espacio o modelos CPK (también un esquema de coloración atómica en las representaciones): la molécula se representa mediante esferas superpuestas que representan los átomos.
 |  | 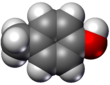 |  |
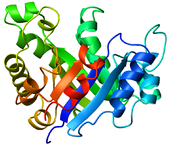
- Caricatura: una representación utilizada para las proteínas donde los bucles, las láminas beta y las hélices alfa se representan en forma de diagrama y no se representan átomos ni enlaces explícitamente (por ejemplo, la columna vertebral de la proteína se representa como un tubo liso).
 |  |  |  |
Cuanto mayor sea la cantidad de pares solitarios contenidos en una molécula, menores serán los ángulos entre los átomos de esa molécula. La teoría VSEPR predice que los pares solitarios se repelen entre sí, lo que aleja a los diferentes átomos de ellos.
Contenido relacionado
Halogenación
Proteína anclada en lípidos
Química de materiales
