Fórmula esquelética
La fórmula esquelética, o fórmula de línea-ángulo o fórmula abreviada, de un compuesto orgánico es un tipo de fórmula estructural molecular que sirve como una representación abreviada del enlace de una molécula y algunos detalles de su geometría molecular. Una fórmula esquelética muestra la estructura esquelética o el esqueleto de una molécula, que se compone de los átomos esqueléticos que forman la molécula. Se representa en dos dimensiones, como en una hoja de papel. Emplea ciertas convenciones para representar los átomos de carbono e hidrógeno, que son los más comunes en química orgánica.
Una forma temprana de esta representación fue desarrollada por primera vez por el químico orgánico August Kekulé, mientras que la forma moderna está estrechamente relacionada e influenciada por la estructura de Lewis de las moléculas y sus electrones de valencia. Por lo tanto, a veces se denominan estructuras de Kekulé o estructuras de Lewis-Kekulé. Las fórmulas esqueléticas se han vuelto omnipresentes en la química orgánica, en parte porque son relativamente rápidas y simples de dibujar, y también porque la notación de flecha curva utilizada para discutir los mecanismos de reacción y la deslocalización de electrones se puede superponer fácilmente.
Varias otras formas de representar estructuras químicas también se usan comúnmente en química orgánica (aunque con menos frecuencia que las fórmulas esqueléticas). Por ejemplo, las estructuras conformacionales se parecen a las fórmulas esqueléticas y se utilizan para representar las posiciones aproximadas de los átomos en el espacio 3D, como un dibujo en perspectiva. Otros tipos de representación, como la proyección de Newman, la proyección de Haworth o la proyección de Fischer, también se parecen un poco a las fórmulas esqueléticas. Sin embargo, existen ligeras diferencias en las convenciones utilizadas, y el lector debe conocerlas para comprender los detalles estructurales codificados en la representación. Si bien las estructuras esqueléticas y conformacionales también se usan en química organometálica e inorgánica, las convenciones empleadas también difieren un poco.
El esqueleto
Terminología
La estructura esquelética de un compuesto orgánico es la serie de átomos unidos entre sí que forman la estructura esencial del compuesto. El esqueleto puede consistir en cadenas, ramas y/o anillos de átomos enlazados. Los átomos del esqueleto que no sean de carbono o hidrógeno se denominan heteroátomos.
El esqueleto tiene hidrógeno y/o varios sustituyentes unidos a sus átomos. El hidrógeno es el átomo que no es carbono más común que está unido al carbono y, por simplicidad, no se dibuja explícitamente. Además, los átomos de carbono generalmente no se etiquetan como tales directamente (es decir, con "C"), mientras que los heteroátomos siempre se indican explícitamente como tales ("N" para nitrógeno, "O" para oxígeno, etc.)
Los heteroátomos y otros grupos de átomos que dan lugar a tasas relativamente altas de reactividad química, o introducen características específicas e interesantes en los espectros de los compuestos, se denominan grupos funcionales, ya que le dan una función a la molécula. Los heteroátomos y los grupos funcionales se denominan colectivamente "sustituyentes", ya que se consideran sustitutos del átomo de hidrógeno que estaría presente en el hidrocarburo original del compuesto orgánico.
Estructura basica
Como en las estructuras de Lewis, los enlaces covalentes se indican mediante segmentos de línea, con un segmento de línea doble o triple que indica un enlace doble o triple, respectivamente. Del mismo modo, las fórmulas esqueléticas indican cargas formales asociadas con cada átomo (aunque los pares solitarios suelen ser opcionales, ver más abajo). De hecho, las fórmulas esqueléticas se pueden considerar como estructuras de Lewis abreviadas que observan las siguientes simplificaciones:
- Los átomos de carbono están representados por los vértices (intersecciones o terminales) de los segmentos de línea. Para mayor claridad, los grupos metilo a menudo se escriben explícitamente como Me o CH 3, mientras que los carbonos (hetero)cumuleno se representan con frecuencia con un punto central grueso.
- Los átomos de hidrógeno unidos al carbono están implícitos. Se entiende que un vértice sin marcar representa un carbono unido al número de hidrógenos necesarios para satisfacer la regla del octeto, mientras que un vértice marcado con una carga formal y/o electrones no enlazantes se entiende que tiene el número de átomos de hidrógeno necesarios para dar el átomo de carbono estas propiedades indicadas. Opcionalmente, los hidrógenos acetilénicos y formílicos pueden mostrarse explícitamente en aras de la claridad.
- Los átomos de hidrógeno unidos a un heteroátomo se muestran explícitamente. El heteroátomo y los átomos de hidrógeno unidos a ellos generalmente se muestran como un solo grupo (p. ej., OH, NH 2) sin mostrar explícitamente el enlace hidrógeno-heteroátomo. Los heteroátomos con sustituyentes arilo o alquilo simples, como metoxi (OMe) o dimetilamino (NMe 2), a veces se muestran de la misma manera, por analogía.
- Los pares solitarios en los carbonos de carbeno deben indicarse explícitamente, mientras que los pares solitarios en otros casos son opcionales y se muestran solo para enfatizar. Por el contrario, las cargas formales y los electrones desapareados en los elementos del grupo principal siempre se muestran explícitamente.
En la representación estándar de una molécula, se dibuja la forma canónica (estructura de resonancia) con la mayor contribución. Sin embargo, se entiende que la fórmula esquelética representa la "molécula real", es decir, el promedio ponderado de todas las formas canónicas contribuyentes. Por lo tanto, en los casos en que dos o más formas canónicas contribuyen con el mismo peso (p. ej., en el benceno o en un anión carboxilato) y una de las formas canónicas se selecciona arbitrariamente, se entiende que la fórmula esquelética representa la verdadera estructura, que contiene enlaces equivalentes de orden fraccionario, aunque los enlaces deslocalizados se representan como enlaces simples y dobles no equivalentes.
Convenciones gráficas contemporáneas
Desde que se introdujeron las estructuras esqueléticas en la segunda mitad del siglo XIX, su apariencia ha sufrido una evolución considerable. Las convenciones gráficas en uso hoy en día datan de la década de 1980. Gracias a la adopción del paquete de software ChemDraw como un estándar industrial de facto (por las publicaciones de la American Chemical Society, Royal Society of Chemistry y Gesellschaft Deutscher Chemiker, por ejemplo), estas convenciones han sido casi universales en la literatura química desde finales de la década de 1990.. Siguen existiendo algunas variaciones convencionales menores, especialmente con respecto al uso de enlaces estereoscópicos, como resultado de las diferentes prácticas de EE. UU., Reino Unido y Europa, o como una cuestión de preferencia personal.Como otra variación menor entre autores, los cargos formales se pueden mostrar con el signo más o menos en un círculo (⊕, ⊖) o sin el círculo. El conjunto de convenciones que siguen la mayoría de los autores se proporciona a continuación, junto con ejemplos ilustrativos.
- Los enlaces entre carbono hibridado sp o sp o heteroátomos se representan convencionalmente usando ángulos de 120° siempre que sea posible, con la cadena más larga de átomos siguiendo un patrón en zigzag a menos que esté interrumpida por un doble enlace cis. A menos que los cuatro sustituyentes sean explícitos, esto es cierto incluso cuando la estereoquímica se representa utilizando enlaces en cuña o discontinuos (ver más abajo).

- Si se muestran explícitamente los cuatro sustituyentes de un carbono tetraédrico, los enlaces a los dos sustituyentes en el plano aún se encuentran a 120°; los otros dos sustituyentes, sin embargo, generalmente se muestran con enlaces en cuña y discontinuos (para representar la estereoquímica) y subtienden un ángulo más pequeño de 60 a 90 °.

- La geometría lineal en los átomos con hibridación sp normalmente se representa mediante segmentos de línea que se encuentran en 180°. Cuando esto implica el encuentro de dos dobles enlaces (un aleno o un cumuleno), los enlaces están separados por un punto.

- Los carbociclos y heterociclos (de 3 a 8 miembros) generalmente se representan como polígonos regulares; los tamaños de anillo más grandes tienden a estar representados por polígonos cóncavos.

- Los átomos en un grupo están ordenados de modo que el enlace emane del átomo que está directamente unido al esqueleto. Por ejemplo, el grupo nitro NO 2 se denota —NO 2 u O 2 N—, dependiendo de la colocación del enlace. Por el contrario, el grupo nitrito isomérico se denota —ONO u ONO—.

Átomos de carbono e hidrógeno implícitos
Por ejemplo, la fórmula básica del hexano (arriba) se muestra a continuación. El átomo de carbono etiquetado como C 1 parece tener solo un enlace, por lo que también debe haber tres hidrógenos enlazados a él, para que el número total de enlaces sea cuatro. El átomo de carbono marcado como C 3 tiene dos enlaces con otros carbonos y, por lo tanto, también está unido a dos átomos de hidrógeno. A modo de comparación, se muestra una estructura de Lewis (centro) y un modelo de bola y palo (abajo) de la estructura molecular real del hexano, determinada por cristalografía de rayos X.



No importa de qué extremo de la cadena se comience a numerar, siempre que se mantenga la consistencia al dibujar los diagramas. La fórmula condensada o el nombre IUPAC confirmarán la orientación. Algunas moléculas se volverán familiares independientemente de la orientación.
Heteroátomos explícitos y átomos de hidrógeno
Todos los átomos que no son carbono o hidrógeno se representan por su símbolo químico, por ejemplo, Cl para cloro, O para oxígeno, Na para sodio, etc. En el contexto de la química orgánica, estos átomos se conocen comúnmente como heteroátomos (el prefijo hetero- proviene del griego ἕτερος héteros, que significa "otro").
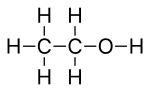
Cualquier átomo de hidrógeno unido a heteroátomos se dibuja explícitamente. En el etanol, C 2 H 5 OH, por ejemplo, el átomo de hidrógeno unido al oxígeno se indica con el símbolo H, mientras que los átomos de hidrógeno que están unidos a los átomos de carbono no se muestran directamente.
Las líneas que representan los enlaces heteroátomo-hidrógeno generalmente se omiten por motivos de claridad y compacidad, por lo que un grupo funcional como el grupo hidroxilo suele escribirse −OH en lugar de −O−H. Estos enlaces a veces se extraen por completo para acentuar su presencia cuando participan en los mecanismos de reacción.
A continuación, a modo de comparación, se muestra una fórmula esquelética (arriba), su estructura de Lewis (centro) y su modelo de bola y palo (abajo) de la estructura 3D real de la molécula de etanol en la fase gaseosa, determinada por espectroscopia de microondas.


Símbolos de pseudoelementos
También hay símbolos que parecen ser símbolos de elementos químicos, pero representan ciertos sustituyentes muy comunes o indican un miembro no especificado de un grupo de elementos. Estos se denominan símbolos de pseudoelementos o elementos orgánicos y se tratan como "elementos" univalentes en fórmulas esqueléticas. Una lista de símbolos de pseudoelementos comunes:
Símbolos generales
- X para cualquier (pseudo)átomo de halógeno (en la notación MLXZ relacionada, X representa un ligando donador de un electrón)
- L o L n para un ligando o ligandos (en la notación MLXZ relacionada, L representa un ligando donador de dos electrones)
- M o Met para cualquier átomo de metal ([M] se usa para indicar un metal ligado, ML n, cuando las identidades de los ligandos son desconocidas o irrelevantes)
- E o El para cualquier electrófilo (en algunos contextos, E también se usa para indicar cualquier elemento del bloque p)
- Nu para cualquier nucleófilo
- Z para conjugar grupos atractores de electrones (en la notación MLXZ relacionada, Z representa un ligando donador de electrones cero; en un uso no relacionado, Z también es una abreviatura del grupo carboxibencilo).
- D de deuterio (H)
- T para tritio (H)
Grupos alquilo
- R para cualquier grupo alquilo o incluso cualquier grupo organilo (Alk se puede usar para indicar sin ambigüedades un grupo alquilo)
- Yo por el grupo metilo
- Et para el grupo etilo
- Pr, n -Pr, o Pr para el grupo propilo (normal) (Pr es también el símbolo del elemento praseodimio. Sin embargo, dado que el grupo propilo es monovalente, mientras que el praseodimio casi siempre es trivalente, la ambigüedad rara vez surge en la práctica).
- yo -Pr o Pr para el grupo isopropilo
- Todo por el grupo alilo (poco común)
- Bu, n - Bu o Bu para el grupo butilo (normal)
- yo- bu o Bu (a menudo en cursiva) para el grupo isobutilo
- s - bu o Bu para el grupo butilo secundario
- t - bu o Bu para el grupo butilo terciario
- Pn para el grupo pentilo (o Am para el grupo amilo sinónimo, aunque Am también es el símbolo del americio).
- Np o Neo para el grupo neopentilo (Advertencia: los químicos organometálicos a menudo usan Np para el grupo neófilo relacionado, PhMe 2 C–. Np también es el símbolo del elemento neptunio).
- Cy o Chx para el grupo ciclohexilo
- Anuncio para el grupo 1-adamantilo
- Tr o Trt para el grupo tritilo
Sustituyentes aromáticos e insaturados.
- Ar para cualquier sustituyente aromático (Ar también es el símbolo del elemento argón. Sin embargo, el argón es inerte en todas las condiciones habituales que se encuentran en la química orgánica, por lo que el uso de Ar para representar un sustituyente arilo nunca genera confusión).
- Het para cualquier sustituyente heteroaromático
- Bn o Bzl para el grupo bencilo (que no debe confundirse con Bz para el grupo benzoilo; sin embargo, la literatura antigua puede usar Bz para el grupo bencilo).
- Dipp para el grupo 2,6-diisopropilfenilo
- Mes para el grupo mesitilo
- Ph, Φ o φ para el grupo fenilo (el uso de phi para fenilo ha disminuido)
- Tol para el grupo tolilo, generalmente el isómero para
- Is o Tipp para el grupo 2,4,6-triisopropilfenilo (el símbolo anterior se deriva del sinónimo isitilo)
- An para el grupo anisilo, generalmente el isómero para (An es también el símbolo de un elemento actinoide genérico. Sin embargo, dado que el grupo anisilo es monovalente, mientras que los actínidos suelen ser divalentes, trivalentes o incluso de mayor valencia, la ambigüedad rara vez, o nunca, surge en la práctica.)
- Cp para el grupo ciclopentadienilo (Cp era el símbolo de casiopeio, un nombre anterior para el lutecio)
- Cp* para el grupo pentametilciclopentadienilo
- Vi para el grupo de vinilo (poco común)
Grupos funcionales
- Ac para el grupo acetilo (Ac es también el símbolo del elemento actinio. Sin embargo, el actinio casi nunca se encuentra en la química orgánica, por lo que el uso de Ac para representar el grupo acetilo nunca causa confusión);
- Bz para el grupo benzoílo; OBz es el grupo benzoato
- piv para el grupo pivalilo (t -butilcarbonilo); OPiv es el grupo pivalato
- Bt para el grupo 1-benzotriazolilo
- Im para el grupo 1-imidazolilo
- Nphth para el grupo ftalimida-1-ilo
Grupos sulfonilo/sulfonato
Los ésteres de sulfonato a menudo son grupos salientes en las reacciones de sustitución nucleófila. Consulte los artículos sobre grupos sulfonilo y sulfonato para obtener más información.
- Bs para el grupo brosilo (p -bromobencenosulfonilo); OBs es el grupo brosilato
- Ms para el grupo mesilo (metanosulfonilo); OMs es el grupo mesilato
- Ns para el grupo nosilo (p -nitrobencenosulfonilo) (Ns era el antiguo símbolo químico del bohrio, entonces llamado nielsbohrio); ONs es el grupo nosilato
- Tf para el grupo triflylo (trifluorometanosulfonilo); OTf es el grupo triflato
- Nf para el grupo nonafilo (nonafluorobutanosulfonilo), CF 3 (CF 2) 3 SO 2; ONf es el grupo no aflato
- Ts para el grupo tosilo (p- toluenosulfonilo) (Ts es también el símbolo del elemento tennessine. Sin embargo, tennessine nunca se encuentra en química orgánica, por lo que el uso de Ts para representar tosyl nunca causa confusión); OTs es el grupo tosilato
Grupos protectores
Un grupo protector o grupo protector se introduce en una molécula mediante la modificación química de un grupo funcional para obtener quimioselectividad en una reacción química posterior, lo que facilita la síntesis orgánica de varios pasos.
- Boc para el grupo t - butoxicarbonilo
- Cbz o Z para el grupo carboxibencilo
- Fmoc para el grupo fluorenilmetoxicarbonilo
- Alloc para el grupo aliloxicarbonilo
- Troc para el grupo tricloroetoxicarbonilo
- TMS, TBDMS, TES, TBDPS, TIPS,... para varios grupos de éter de sililo
- PMB para el grupo 4-metoxibencilo
- MOM para el grupo metoximetilo
- THP para el grupo 2-tetrahidropiranilo
Lazos múltiples
Dos átomos se pueden unir compartiendo más de un par de electrones. Los enlaces comunes al carbono son enlaces simples, dobles y triples. Los enlaces simples son los más comunes y están representados por una sola línea continua entre dos átomos en una fórmula esquelética. Los enlaces dobles se indican con dos líneas paralelas y los enlaces triples con tres líneas paralelas.
En teorías más avanzadas de enlace, existen valores no enteros de orden de enlace. En estos casos, una combinación de líneas continuas y discontinuas indica las partes enteras y no enteras del orden de enlace, respectivamente.Ejemplos de enlaces múltiples en fórmulas esqueléticas
 El hex-3-eno tiene un doble enlace carbono-carbono interno
El hex-3-eno tiene un doble enlace carbono-carbono interno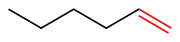 El hex-1-eno tiene un doble enlace terminal
El hex-1-eno tiene un doble enlace terminal Hex-3-yne tiene un triple enlace carbono-carbono interno
Hex-3-yne tiene un triple enlace carbono-carbono interno Hex-1-yne tiene un triple enlace terminal
Hex-1-yne tiene un triple enlace terminal
Anillos de benceno
En los últimos años, el benceno generalmente se representa como un hexágono con enlaces simples y dobles alternos, muy parecido a la estructura que Kekulé propuso originalmente en 1872. Como se mencionó anteriormente, los enlaces simples y dobles alternos de "1,3,5-ciclohexatrieno" se entienden ser un dibujo de una de las dos formas canónicas equivalentes del benceno (los isómeros 1,3,5 y 2,4,6), en las que todos los enlaces carbono-carbono tienen una longitud equivalente y un orden de enlace de exactamente 1.5. Para los anillos de arilo en general, las dos formas canónicas análogas son casi siempre las principales contribuyentes a la estructura, pero no son equivalentes, por lo que una estructura puede hacer una contribución ligeramente mayor que la otra y los órdenes de enlace pueden diferir un poco de 1,5.
Una representación alternativa que enfatiza esta deslocalización utiliza un círculo, dibujado dentro del hexágono de enlaces simples, para representar el orbital pi deslocalizado. Este estilo, basado en uno propuesto por Johannes Thiele, solía ser muy común en los libros de texto de introducción a la química orgánica y todavía se usa con frecuencia en entornos informales. Sin embargo, debido a que esta representación no realiza un seguimiento de los pares de electrones y no puede mostrar el movimiento preciso de los electrones, ha sido reemplazada en gran medida por la representación de Kekuléan en contextos académicos formales y pedagógicos.
Estereoquímica
La estereoquímica se denota convenientemente en fórmulas esqueléticas:
 Modelo de bola y palo de(R)-2-cloro-2-fluoropentano
Modelo de bola y palo de(R)-2-cloro-2-fluoropentano Fórmula esquelética de(R)-2-cloro-2-fluoropentano
Fórmula esquelética de(R)-2-cloro-2-fluoropentano Fórmula esquelética de(S)-2-cloro-2-fluoropentano
Fórmula esquelética de(S)-2-cloro-2-fluoropentano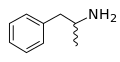 Fórmula esquelética de anfetamina, que indica una mezcla de dos estereoisómeros: (R)- y (S)-
Fórmula esquelética de anfetamina, que indica una mezcla de dos estereoisómeros: (R)- y (S)-
Los enlaces químicos relevantes se pueden representar de varias maneras:
- Las líneas sólidas representan enlaces en el plano del papel o la pantalla.
- Las cuñas sólidas representan enlaces que apuntan fuera del plano del papel o la pantalla, hacia el observador.
- Las cuñas discontinuas o las líneas discontinuas (gruesas o delgadas) representan enlaces que apuntan al plano del papel o la pantalla, lejos del observador.
- Las líneas onduladas representan estereoquímica desconocida o una mezcla de los dos posibles estereoisómeros en ese punto.
- Una representación obsoleta de la estereoquímica del hidrógeno que solía ser común en la química de los esteroides es el uso de un círculo lleno centrado en un vértice (a veces llamado H-punto/H-raya/H-círculo, respectivamente) para un átomo de hidrógeno que apunta hacia arriba y dos marcas hash junto al vértice o un círculo hueco para un átomo de hidrógeno que apunta hacia abajo.
 Un pequeño círculo lleno representaba un hidrógeno que apuntaba hacia arriba, mientras que dos marcas representaban uno que apuntaba hacia abajo.
Un pequeño círculo lleno representaba un hidrógeno que apuntaba hacia arriba, mientras que dos marcas representaban uno que apuntaba hacia abajo.
Un uso temprano de esta notación se remonta a Richard Kuhn, quien en 1932 usó líneas sólidas gruesas y líneas punteadas en una publicación. Las cuñas sólidas y trituradas modernas fueron introducidas en la década de 1940 por Giulio Natta para representar la estructura de los polímeros altos y se popularizaron ampliamente en el libro de texto de 1959 Química orgánica de Donald J. Cram y George S. Hammond.
Las fórmulas esqueléticas pueden representar isómeros cis y trans de alquenos. Los enlaces simples ondulados son la forma estándar de representar la estereoquímica desconocida o no especificada o una mezcla de isómeros (como con los estereocentros tetraédricos). A veces se ha utilizado un doble enlace cruzado; ya no se considera un estilo aceptable para uso general, pero aún puede ser requerido por software de computadora.
 Estereoquímica de alquenos
Estereoquímica de alquenos
Enlaces de hidrógeno
Los enlaces de hidrógeno generalmente se indican mediante líneas de puntos o discontinuas. En otros contextos, las líneas discontinuas también pueden representar enlaces parcialmente formados o rotos en un estado de transición.
Contenido relacionado
Efectos estéricos
Elementos del Período 2
Butirato de etilo