Formilación

La formilación se refiere a cualquier proceso químico en el que un compuesto se funcionaliza con un grupo formilo (-CH=O). En química orgánica, el término se utiliza más comúnmente en relación con los compuestos aromáticos (por ejemplo, la conversión de benceno en benzaldehído en la reacción de Gattermann-Koch). En bioquímica, la reacción está catalizada por enzimas como las formiltransferasas.
La formilación generalmente implica el uso de agentes de formilación, reactivos que dan lugar al grupo CHO. Entre los muchos reactivos de formilación, son particularmente importantes el ácido fórmico y el monóxido de carbono. Una reacción de formilación en química orgánica se refiere a reacciones orgánicas en las que un compuesto orgánico se funcionaliza con un grupo formilo (-CH=O). La reacción es una ruta hacia los aldehídos (C-CH=O), las formamidas (N-CH=O) y los ésteres de formato (O-CH=O).
Formylation agents
Un reactivo que libera el grupo formilo se denomina agente formilante.
- Ácido formico
- Dimetilformamida y fosforo oxicloruro en la reacción Vilsmeier-Haack.
- Hexametiletetramina en la reacción Duff y la reacción Sommelet
- Monóxido de carbono y ácido clorhídrico en la reacción Gattermann-Koch
- Cyanides en la reacción de Gattermann. Este método sintetiza aldehídos aromáticos usando cloruro de hidrógeno y cianuro de hidrógeno (o otro cianuro metálico como cianuro de zinc) en presencia de catalizadores ácidos de Lewis:
- Cloroformo en la reacción Reimer-Tiemann
- Metil éter de diclorometil en Rieche formylation
Un proceso de formilación particularmente importante es la hidroformilación, que convierte los alquenos en el aldehído homologado.
Formylation aromatic

Las reacciones de formilación son una forma de sustitución aromática electrofílica y, por lo tanto, funcionan mejor con materiales de partida ricos en electrones. Los fenoles son un sustrato común, ya que se desprotonan fácilmente para convertirse en excelentes nucleófilos fenóxidos. También se puede esperar que reaccionen otros sustratos ricos en electrones, como el mesitileno, el pirrol o los anillos aromáticos fusionados. El benceno reaccionará en condiciones agresivas, pero los anillos desactivados, como la piridina, son difíciles de formilar de manera efectiva.
Muchas reacciones de formilación seleccionarán únicamente el producto orto (p. ej., salicilaldehído), lo que se atribuye a la atracción entre el fenóxido y el reactivo de formilación. Se han invocado interacciones iónicas para los centros de nitrógeno catiónicos en la reacción de Vilsmeier-Haack y la reacción de Duff, y el carbeno deficiente en electrones en la reacción de Reimer-Tiemann; se ha invocado la coordinación con metales de alta oxidación en las formilaciones de Casiraghi y Rieche (cf. reacción de Kolbe-Schmitt).
La reacción directa entre el fenol y el paraformaldehído es posible a través de la formilación de Casiraghi, pero otros métodos aplican formas enmascaradas de formaldehído, en parte para limitar la formación de resinas de fenol-formaldehído. Los aldehídos son fuertemente desactivantes y, como tales, los fenoles normalmente solo reaccionan una vez. Sin embargo, ciertas reacciones, como la reacción de Duff, pueden dar lugar a una doble adición.
La formilación se puede aplicar a otros anillos aromáticos. Como generalmente comienza con el ataque nucleofílico del grupo aromático, la densidad electrónica del anillo es un factor importante. Se sabe que algunos compuestos aromáticos, como el pirrol, se formilan de forma regioselectiva.
La formilación de los anillos de benceno se puede lograr mediante la reacción de Gattermann y la reacción de Gattermann-Koch. Estas reacciones implican una catálisis ácida fuerte y se desarrollan de manera similar a la reacción de Friedel-Crafts.
Formylación alienígena
La hidroformilación de alquenos es el método más importante para obtener formilos alifáticos (es decir, aldehídos). La reacción está restringida en gran medida a entornos industriales. Existen varios métodos especializados para la síntesis a escala de laboratorio, incluida la reacción de Sommelet, la síntesis de aldehídos de Bouveault o la síntesis de aldehídos de Bodroux-Chichibabin.
Reacciones de formylation en biología
En bioquímica, la adición de un grupo funcional formilo se denomina "formilación". Un grupo funcional formilo consiste en un carbonilo unido a hidrógeno. Cuando está unido a un grupo R, un grupo formilo se denomina aldehído.
La formilación se ha identificado en varios procesos biológicos críticos. Marcker y Sanger descubrieron por primera vez que la metionina se formilaba en E. coli en 1964 y más tarde se identificó que participaba en el inicio de la síntesis de proteínas en bacterias y orgánulos. La formación de N-formilmetionina está catalizada por la enzima transformilasa de metionil-ARNtMet. Además, en la biosíntesis de novo de purinas se producen dos reacciones de formilación. Estas reacciones están catalizadas por las enzimas transformilasa de ribonucleótido de glicinamida (GAR) y transformilasa de 5-aminoimidazol-4-carboxiamida ribótida (AICAR). Más recientemente, se ha descubierto que la formilación es una modificación de histonas, que puede modular la expresión génica.
Methanogenesis

La formilación del metanofurano inicia el ciclo de la metanogénesis. El grupo formilo se deriva del dióxido de carbono y se convierte en metano.
Formylation en síntesis de proteínas

En bacterias y orgánulos, el inicio de la síntesis de proteínas se señala mediante la formación de formil-metionil-ARNt (ARNtfMet). Esta reacción depende del 10-formiltetrahidrofolato y de la enzima metionil-ARNt formiltransferasa. Esta reacción no es utilizada por eucariotas ni por arqueas, ya que la presencia de ARNtfMet en células no bacterianas se considera material intrusivo y se elimina rápidamente. Después de su producción, el ARNtfMet se envía a la subunidad 30S del ribosoma para iniciar la síntesis de proteínas. fMet posee la misma secuencia de codones que la metionina. Sin embargo, fMet solo se utiliza para el inicio de la síntesis de proteínas y, por lo tanto, se encuentra solo en el extremo N de la proteína. La metionina se utiliza durante la traducción restante. En E. coli, el ARNtfMet es reconocido específicamente por el factor de iniciación IF-2, ya que el grupo formilo bloquea la formación del enlace peptídico en el extremo N de la metionina.
Una vez que se completa la síntesis de proteínas, el grupo formilo de la metionina puede ser eliminado por la péptido deformilasa. El residuo de metionina puede ser eliminado aún más por la enzima metionina aminopeptidasa.

Reacciones de formylation en la biosíntesis purina
Se requieren dos reacciones de formilación en la síntesis de novo de once pasos del monofosfato de inosina (IMP), el precursor de los ribonucleótidos de purina AMP y GMP. La transformilasa del ribonucleótido de glicinamida (GAR) cataliza la formilación de GAR a formilglicinamidina ribótida (FGAR) en la cuarta reacción de la vía. En el penúltimo paso de la biosíntesis de novo de purina, la transformilasa AICAR formilasa del ribonucleótido de 5-aminoimidazol-4-carboxamida (AICAR) se formiliza a ribonucleótido de 5-formaminoimidazol-4-carboxamida (FAICAR).
GAR transformylase
La transformilasa PurN GAR se encuentra en eucariotas y procariotas. Sin embargo, se ha identificado una segunda transformilasa GAR, la transformilasa PurT GAR, en E. coli. Si bien las dos enzimas no tienen conservación de secuencia y requieren diferentes donantes de formilo, la actividad específica y la Km para GAR son las mismas en las transformilasas PurT y PurN GAR.
PurN GAR transformylase
La transformilasa PurN GAR 1CDE utiliza la coenzima N10-formiltetrahidrofolato (N10-formil-THF) como donante de formilo para formilar el grupo α-amino de GAR. En eucariotas, la transformilasa PurN GAR es parte de una proteína multifuncional grande, pero se encuentra como proteína única en procariotas.
Mecanismo

Se propone que la reacción de formilación se produce a través de una reacción de transferencia directa en la que el grupo amino de GAR ataca nucleofílicamente al N10-formil-THF creando un intermediario tetraédrico. Como el grupo α-amino de GAR es relativamente reactivo, se propone que la desprotonación del nucleófilo se produce por el disolvente. En el sitio activo, Asn 106, His 108 y Asp 144 están posicionados para ayudar con la transferencia de formilo. Sin embargo, los estudios de mutagénesis han indicado que estos residuos no son esenciales individualmente para la catálisis, ya que solo las mutaciones de dos o más residuos inhiben la enzima. Con base en la estructura, se cree que el Asp144 cargado negativamente aumenta el pKa de His108, lo que permite que el grupo imidazolio protonado de His108 mejore la electrofilicidad del grupo formilo del N10-formil-THF. Además, se cree que His108 y Asn106 estabilizan el oxianión formado en el estado de transición.

PurT GAR transformylase
La transformilasa PurT GAR requiere formato como donante de formilo y ATP para la catálisis. Se ha estimado que la transformilasa PurT GAR lleva a cabo entre el 14 y el 50 % de las formilaciones de GAR en E. coli. La enzima es miembro de la superfamilia de proteínas que captan ATP.
Mecanismo
Se ha propuesto un mecanismo secuencial para la transformilasa PurT GAR en el que se forma primero un intermediario de fosfato de formilo de corta duración. Luego, este intermediario de fosfato de formilo sufre un ataque nucleofílico por parte de la amina GAR para transferir el grupo formilo. Se ha detectado un intermediario de fosfato de formilo en experimentos de mutagénesis, en los que la transformilasa PurT GAR mutante tenía una afinidad débil por el formato. La incubación de la transformilasa PurT GAR con fosfato de formilo, ADP y GAR produce ATP y FGAR. Esto indica además que el fosfato de formilo puede ser un intermediario, ya que es cinética y químicamente competente para llevar a cabo la reacción de formilación en la enzima. También se ha propuesto la formación de un intermediario de fosfato enzimático que precede al intermediario de fosfato de formilo basándose en estudios de intercambio de isótopos posicionales. Sin embargo, los datos estructurales indican que el formato puede estar posicionado para un ataque directo sobre el fosfato γ del ATP en el sitio activo de la enzima para formar el intermediario de fosfato de formilo.

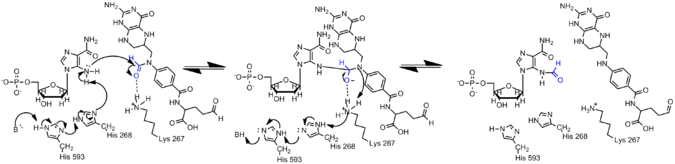
AICAR transformylase
La transformilasa AICAR requiere la coenzima N10-formiltetrahidrofolato (N10-formil-THF) como donante de formilo para la formilación de AICAR a FAICAR. Sin embargo, la transformilasa AICAR y la transformilasa GAR no comparten una gran similitud de secuencia ni homología estructural.
Mecanismo

La amina en AICAR es mucho menos nucleófila que su contraparte en GAR debido a la deslocalización de electrones en AICAR a través de la conjugación. Por lo tanto, el nucleófilo N5 de AIRCAR debe activarse para que se produzca la reacción de formilación. Se ha descubierto que la histidina 268 y la lisina 267 son esenciales para la catálisis y se conservan en todas las transformilasas AICAR. La histidina 268 participa en la desprotonación del nucleófilo N5 de AICAR, mientras que se propone que la lisina 267 estabiliza el intermediario tetraédrico.
Formylation in histone proteins

La ε-formilación es una de las muchas modificaciones postraduccionales que ocurren en las proteínas histonas, que se ha demostrado que modulan las conformaciones de la cromatina y la activación genética.

Se ha identificado la formilación en el Nε de los residuos de lisina en histonas y proteínas. Esta modificación se ha observado en las histonas de enlace y en las proteínas del grupo de alta movilidad, es muy abundante y se cree que tiene un papel en la epigenética de la función de la cromatina. Se ha demostrado que las lisinas que están formiladas desempeñan un papel en la unión del ADN. Además, se ha detectado formilación en lisinas de histonas que también se sabe que están acetiladas y metiladas. Por lo tanto, la formilación puede bloquear otras modificaciones postraduccionales. La formilación se detecta con mayor frecuencia en 19 sitios de modificación diferentes en la histona H1. La expresión genética de la célula se ve muy alterada por la formilación, lo que puede causar enfermedades como el cáncer. El desarrollo de estas modificaciones puede deberse al estrés oxidativo.
En las proteínas histonas, la lisina es modificada típicamente por las histonas acetiltransferasas (HAT) y las histonas desacetilasas (HDAC o KDAC). La acetilación de la lisina es fundamental para la regulación y expresión de ciertos genes. El estrés oxidativo crea un entorno significativamente diferente en el que la acetillisina puede ser rápidamente desplazada por la formación de formillisina debido a la alta reactividad de las especies de formilfosfato. Actualmente se cree que esta situación es causada por el daño oxidativo del ADN. Se ha propuesto un mecanismo para la formación de formilfosfato, que depende en gran medida del ADN dañado por oxidación y está impulsado principalmente por la química radical dentro de la célula. El formilfosfato producido puede luego usarse para formilar la lisina. Se cree que el estrés oxidativo juega un papel en la disponibilidad de residuos de lisina en la superficie de las proteínas y la posibilidad de ser formiladas.

Formylation in medicine
Reacciones de formylation como un objetivo de drogas
La inhibición de las enzimas implicadas en la biosíntesis de purinas se ha utilizado como posible diana farmacológica para la quimioterapia.
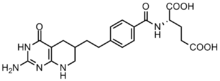
Las células cancerosas requieren altas concentraciones de purinas para facilitar la división y tienden a depender de la síntesis de novo en lugar de la vía de recuperación de nucleótidos. Se han desarrollado varios inhibidores basados en folato para inhibir las reacciones de formilación por la transformilasa GAR y la transformilasa AICAR. El primer inhibidor de la transformilasa GAR, el lometrexol [(6R)5,10-dideazatetrahidrofolato], se desarrolló en la década de 1980 mediante una colaboración entre Eli Lilly y laboratorios académicos. Aunque es similar en estructura al N10-formil-THF, el lometrexol es incapaz de llevar a cabo reacciones de transferencia de un carbono. Además, también se han sintetizado varios inhibidores de la transformilasa GAR basados en GAR. Se ha descubierto que el desarrollo de inhibidores basados en folato es particularmente desafiante ya que los inhibidores también regulan negativamente la enzima folipoliglutamato sintasa, que agrega γ-glutamatos adicionales a los folatos y antifolatos monoglutamato después de ingresar a la célula para aumentar la afinidad enzimática. Esta mayor afinidad puede provocar resistencia a los antifolatos.
Síndrome de Leigh
El síndrome de Leigh es un trastorno neurodegenerativo que se ha relacionado con un defecto en una reacción de formilación enzimática. El síndrome de Leigh se asocia típicamente con defectos en la fosforilación oxidativa, que ocurre en las mitocondrias. La secuenciación del exoma se ha utilizado para identificar una mutación en el gen que codifica para la metionil-ARNt formiltransferasa mitocondrial (MTFMT) en pacientes con síndrome de Leigh. Se cree que la mutación c.626C>T identificada en la MTFMT que produce los síntomas del síndrome de Leigh altera el empalme de exones, lo que conduce a una mutación por cambio de marco de lectura y un codón de terminación prematuro. Se descubrió que los individuos con la mutación c.626C>T de la MTFMT tenían niveles reducidos de fMet-ARNtMet y cambios en el nivel de formilación de la COX1 traducida mitocondrialmente. Este vínculo proporciona evidencia de la necesidad de metionina formilada en el inicio de la expresión de ciertos genes mitocondriales.
Véase también
- Hidroformilación
- Hidroacitación
Referencias
- ^ Olah, George A.; Ohannesian, Lena.; Arvanaghi, Massoud. (1987). "Agentes falsificadores". Reseñas químicas. 87 (4): 671–686. doi:10.1021/cr00080a001.
- ^ Olah, G. A.; Ohannesian, L.; Arvanaghi, M. (1987). "Agentes falsificadores". Chem. Rev. 87 (4): 671–686. doi:10.1021/cr00080a001.
- ^ Ding, S.; Jiao, N. (2012). "N,N-Dimetilformamida: Un bloque de construcción multipropósito". Angew. Chem. Int.. 51 (37): 9226–9237. doi:10.1002/anie.201200859. PMID 22930476.
- ^ Casiraghi, Giovanni; Casnati, Giuseppe; Puglia, Giuseppe; Sartori, Giovanni; Terenghi, Giuliana (1980). "Reacciones selectivas entre fenoles y formaldehído. Una ruta novedosa a salicylaldehydes". Journal of the Chemical Society, Perkin Transactions 1: 1862. doi:10.1039/P19800001862.
- ^ Lindoy, Leonard F. (julio de 1998). "Mono- and Diformylation of 4-Substituted Phenols: A New Application of the Duff Reaction". Síntesis. 1998 (7): 1029–1032. doi:10.1055/s-1998-2110.
- ^ Warashina, Takuya; Matsuura, Daisuke; Sengoku, Tetsuya; Takahashi, Masaki; Yoda, Hidemi; Kimura, Yoshikazu (16 de octubre de 2018). "Regioselective Formylation of Pyrrole-2-Carboxylate: Crystalline Vilsmeier Reagent vs Dichloromethyl Alkyl Ether". Organic Process Research " Development. 23 (4): 614-618. doi:10.1021/acs.oprd.8b00233. S2CID 106209464.
- ^ Marcker, K; Sanger, F. (1964). "N-formyl-methionyl-S-RNA". J. Mol. Biol. 8 (6): 835-840. doi:10.1016/S0022-2836(64)80164-9. PMID 14187409.
- ^ Adams, J.M.; Capecchi, M.R. (1966). "N-Formylmethionyl-sRNA como iniciador de síntesis de proteínas". PNAS. 55 (1): 147–155. Bibcode:1966PNAS...55..147A. doi:10.1073/pnas.55.1.147. PMC 285768. PMID 5328638.
- ^ a b c Kozak, M (1983). "Comparison of Initiation of Protein synthesis in Procaryotes, Eucaryotes, and Organelles". Microbiológica Reseñas. 47 (1): 1–45. doi:10.1128/MMBR.47.1.1-45.1983. PMC 281560. PMID 6343825.
- ^ a b c Voet y Voet (2008). Fundamentos de Bioquímica 3a edición. Wiley.
- ^ Thauer, R. K. (1998). "Bioquímica de la Metanogénesis: un tributo al marjory Stephenson". Microbiología. 144: 2377–2406. doi:10.1099/00221287-144-9-2377. PMID 9782487.
- ^ a b c d Warren, M.S.; K.M. Mattia; A.E. Marolewski; S.J. Benkovic (1996). "Las enzimas transformadoras de la biosíntesis de novo purina" (PDF). Puro Appl. Chem. 68 (11): 2029–2036. doi:10.1351/pac199668112029. S2CID 39555269. Retrieved 24 de febrero 2013.
- ^ a b c d Wolan, D; Greasley, S.E.; Beardsley, P.; Wilson, I.A. (2002). "Las visiones estructurales en el Mecanismo de Transformilasa AICAR Aviano". Bioquímica. 41 (52): 15505-15513. doi:10.1021/bi020505x. PMID 12501179.
- ^ a b Thoden, J.B.; Firestine, S.; Nixon, A.; Benkovic, S.J.; Holden, H.M (2000). "Estructura molecular de Escherichia coli PurT codificada Glycinamide Ribonucleotide Transformylase". Bioquímica. 39 (30): 8791–8802. doi:10.1021/bi000926j. PMID 10913290.
- ^ a b Marolewski, A.E.; Mattia, K.M.; Warren, M.S.; Benkovic, S.J. (1997). "Formyl phosphate: a proposed intermediate in the reaction catalyzed by Escherichia coli PurT GAR transformylase". Bioquímica. 36 (22): 6709–6716. doi:10.1021/bi962961p. PMID 9184151.
- ^ a b Wisniewski, J.R.; Zougman, A.; Mann, M. (2002). "N-Formylation of lysine is a widespread post-translational modification of nuclear proteins occurring at residues involved in regulation of chromatin function". Nucleic Acids Research. 36 (2): 570-577. doi:10.1093/nar/gkm1057. PMC 2241850. PMID 18056081.
- ^ Jiang, T; Zhou, X.; Taghizadeh, K.; Dong, M.; Dedon, PC. (2007). "N-formylation of lysine in histone proteins as a secondary modification arising from oxidative DNA damage". PNAS. 104 (1): 60–65. Código:2007PNAS.104...60J. doi:10.1073/pnas.0606775103. PMC 1765477. PMID 17190813.
- ^ a b DeMartino, J.K.; Hwang, I.; Xu, L.; Wilson, I.A.; Boger, D.L. (2006). "Descubrimiento de un Inhibidor Potente, Nopolyglutamatable de Glycinamide Ribonucleotide Transformylase". Revista de Química Medicinal. 49 (10): 2998–3002. doi:10.1021/jm0601147. 2531195. PMID 16686541.
- ^ a b c Christopherson, R.I.; Lyons, S.D.; Wilson, P.K (2002). "Inhibidores de Novo Nucleotide Biosynthesis as Drugs". Acc. Chem. Res. 35 (11): 961–971. doi:10.1021/ar0000509. PMID 12437321.
- ^ Wang, L; Desmoulin, S.K.; Cherian, C.; Polin, L.; White, K.; Kushner, J.; Fulterer, A.; Chang, M.; Mitchell, S.; Stout, M.; Romero, M.F.; Hou, Z.; Matherly, L.H.; Gangjee, A (2011). "Sintesis, actividad biológica y antitumor de un pyrrolo de 6 sustitutos altamente potente[2,3-d]pirimidina thienoyl antifolate inhibidor con proton-coupled folate transportador y selectividad de receptores folato sobre el portador de folato reducido que inhibe β-glycinamide ribonucleotide formyltransferase". Revista de Química Medicinal. 54 (20): 7150–7164. doi:10.1021/jm200739e. PMC 3209708. PMID 21879757.
- ^ "Síndrome del Alto". Herencia Mendelian en línea en el hombre. Retrieved 24 de febrero 2013.
- ^ Tucker EJ, Hershman SG, Köhrer C, Belcher-Timme CA, Patel J, Goldberger OA, Christodoulou J, Silberstein JM, McKenzie M, Ryan MT, Compton AG, Jaffe JD, Carr SA, Calvo SE, RajBhandary UL, Thorburn DR, Mootha VK (2011). "Las mutaciones en MTFMT subyacen a un trastorno humano de la formylación causando una traducción mitocondrial deteriorada". Cell Metab. 14 (3): 428-434. doi:10.1016/j.cmet.2011.07.010. PMC 3486727. PMID 21907147.
Véase también
- N-Formylmethionine