Formiato de amonio
El formiato de amonio, NH4HCO2, es la sal de amonio del ácido fórmico. Es un sólido cristalino, higroscópico e incoloro.
Amination reductivo
La acetona se puede transformar en isopropilamina de la siguiente manera:
- CH3C(O)CH3 + 2 HCO2− +NH4 →3)2CHNHCHO + 2 H2O + NH3 + CO2
- (CH)3)2CHNHCHO + H2O → (CH)3)2CHNH2 + HCO2H
Usos
El formiato de amonio puro se descompone en formamida y agua cuando se calienta, y este es su uso principal en la industria. El ácido fórmico también se puede obtener haciendo reaccionar el formiato de amonio con un ácido diluido, y dado que el formiato de amonio también se produce a partir del ácido fórmico, puede servir como una forma de almacenar el ácido fórmico.
El formiato de amonio también se puede utilizar en la reducción de grupos funcionales mediante paladio sobre carbono (Pd/C). En presencia de Pd/C, el formiato de amonio se descompone en hidrógeno, dióxido de carbono y amoníaco. Este gas hidrógeno se adsorbe en la superficie del metal paladio, donde puede reaccionar con varios grupos funcionales. Por ejemplo, los alquenos se pueden reducir a alcanos, el formaldehído a metanol y los compuestos nitro a aminas. Los enlaces simples activados a heteroátomos también se pueden reemplazar por hidrógenos (hidrogenólisis).
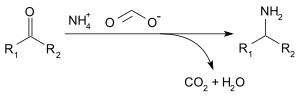
El formato de amonio se puede utilizar para la aminación reductora de aldehídos y cetonas (reacción de Leuckart), mediante la siguiente reacción:
El formato de amonio se puede utilizar como aditivo de fase móvil en cromatografía líquida de alto rendimiento (HPLC) y es adecuado para su uso con cromatografía líquida-espectrometría de masas (LC/MS). Los valores de pKa del ácido fórmico y del ion amonio son 3,8 y 9,2, respectivamente.
Reacciones
Cuando se calienta, el formiato de amonio elimina agua y forma formamida. Si se calienta más, forma cianuro de hidrógeno (HCN) y agua. Una reacción secundaria de esto es la descomposición de la formamida en monóxido de carbono (CO) y amoníaco.
Referencias
- ^ a b c d Sigma-Aldrich Co., Ammonium formate. Consultado el 2014-06-10.
- ^ a b c d "Ammonium formate".
- ^ Ram, Siya; Ehrenkaufer, Richard E. (1984). "Un procedimiento general para la reducción leve y rápida de compuestos nitro alifáticos y aromáticos utilizando el amonio formate como agente de transferencia de hidrógeno catalítico". Tetraedro Lett. 25 (32): 3415–3418. doi:10.1016/S0040-4039(01)91034-2. hdl:2027.42/25034.
- ^ Smith, Michael B.; March, Jerry (2007). Química Orgánica Avanzada de Marzo (6th ed.). John Wiley ' Sons. p. 1816. ISBN 978-0-471-72091-1.
- ^ Alexander, Elliot; Ruth Bowman Wildman (1948). "Estudios sobre el Mecanismo de la Reacción Leuckart". Journal of the American Chemical Society. 70 3): 1187 –1189. doi:10.1021/ja01183a091. PMID 18909189.
Enlaces externos
![]() Medios relacionados con la forma de amonio en Wikimedia Commons
Medios relacionados con la forma de amonio en Wikimedia Commons