Fluorocarbono
Los fluorocarbonos son compuestos químicos con enlaces carbono-flúor. Los compuestos que contienen muchos enlaces C-F a menudo tienen propiedades distintivas, por ejemplo, mayor estabilidad, volatilidad e hidrofobicidad. Los fluorocarbonos y sus derivados son polímeros comerciales, refrigerantes, fármacos y anestésicos.
Nomenclatura
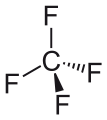
LosPerfluorocarbonos o PFCs, son compuestos organofluorados de fórmula CxFy, es decir, contienen solo carbono y flúor. La terminología no se sigue estrictamente y muchos compuestos orgánicos que contienen flúor se denominan fluorocarbonos. Los compuestos con el prefijo perfluoro- son hidrocarburos, incluidos aquellos con heteroátomos, en los que todos los enlaces C-H han sido reemplazados por enlaces C-F. Los fluorocarbonos incluyen perfluoroalcanos, fluoroalquenos, fluoroalquinos y compuestos perfluoroaromáticos.
Perfluoroalcanos
Propiedades químicas
Los perfluoroalcanos son muy estables debido a la fuerza del enlace carbono-flúor, uno de los más fuertes de la química orgánica. Su fuerza es el resultado de la electronegatividad del flúor que imparte carácter iónico parcial a través de cargas parciales en los átomos de carbono y flúor, que acortan y fortalecen el enlace a través de interacciones covalentes favorables. Además, los enlaces múltiples de carbono-flúor aumentan la fuerza y la estabilidad de otros enlaces de carbono-flúor cercanos en el mismo carbono geminal, ya que el carbono tiene una carga parcial positiva más alta. Además, los múltiples enlaces carbono-flúor también fortalecen el "esquelético" enlaces carbono-carbono del efecto inductivo. Por lo tanto, los fluorocarbonos saturados son más estables química y térmicamente que sus homólogos de hidrocarburos correspondientes y, de hecho, cualquier otro compuesto orgánico. Son susceptibles al ataque de reductores muy fuertes, p. Reducción de abedul y complejos organometálicos muy especializados.
Los fluorocarbonos son incoloros y tienen una alta densidad, hasta más del doble que el agua. No son miscibles con la mayoría de los disolventes orgánicos (p. ej., etanol, acetona, acetato de etilo y cloroformo), pero sí con algunos hidrocarburos (p. ej., hexano en algunos casos). Tienen una solubilidad muy baja en agua, y el agua tiene una solubilidad muy baja en ellos (del orden de 10 ppm). Tienen índices de refracción bajos.
Como la alta electronegatividad del flúor reduce la polarizabilidad del átomo, los fluorocarbonos son solo débilmente susceptibles a los dipolos fugaces que forman la base de la fuerza de dispersión de London. Como resultado, los fluorocarbonos tienen fuerzas de atracción intermoleculares bajas y son lipofóbicos además de hidrofóbicos y no polares. Como reflejo de las débiles fuerzas intermoleculares, estos compuestos exhiben bajas viscosidades en comparación con líquidos de puntos de ebullición similares, baja tensión superficial y bajos calores de vaporización. Las bajas fuerzas de atracción en los líquidos de fluorocarbono los hacen comprimibles (módulo volumétrico bajo) y capaces de disolver el gas relativamente bien. Los fluorocarbonos más pequeños son extremadamente volátiles. Hay cinco gases perfluoroalcanos: tetrafluorometano (pb −128 °C), hexafluoroetano (pb −78,2 °C), octafluoropropano (pb −36,5 °C), perfluoro-n-butano (pb −2,2 °C) y perfluoro-iso- butano (pe −1 °C). Casi todos los demás fluoroalcanos son líquidos; la excepción más notable es el perfluorociclohexano, que se sublima a 51 °C. Los fluorocarbonos también tienen energías superficiales bajas y resistencias dieléctricas altas.
- Perfluoroalkanes
Inflamabilidad
En la década de 1960 hubo mucho interés en los fluorocarbonos como anestésicos. La investigación no produjo ningún anestésico, pero la investigación incluyó pruebas sobre el tema de la inflamabilidad y mostró que los fluorocarbonos probados no eran inflamables en el aire en ninguna proporción, aunque la mayoría de las pruebas se realizaron en oxígeno puro u óxido nitroso puro (gases de importancia en anestesiología).
| Compuesto | Condiciones de prueba | Resultado |
|---|---|---|
| Hexafluoroetano | Límite de inflamación inferior en oxígeno | Ninguno |
| Perfluoropentano | Punto Flash en el aire | Ninguno |
| Punto Flash en oxígeno | −6 °C | |
| Oxido nitroso punto Flash | −32 °C | |
| Perfluorometilciclohexano | Límite de inflamabilidad inferior en el aire | Ninguno |
| Límite de inflamación inferior en oxígeno | 8.3% | |
| Límite de inflamación inferior en oxígeno (50 °C) | 7.4% | |
| Límite de inflamación inferior en óxido nitroso | 7.7% | |
| Perfluoro-1,3-dimetilciclohexano | Límite de inflamación inferior en oxígeno (50 °C) | 5,2% |
| Perfluorometildecalina | Prueba de ignición espontánea en oxígeno a 127 bar | Sin encendido a 500 °C |
| Ignición espontánea en shock adiabático onda en oxígeno, 0.98 a 186 bar | Sin ignición | |
| Ignición espontánea en shock adiabático onda en oxígeno, 0,98 a 196 bar | Ignición |
En 1993, 3M consideró los fluorocarbonos como extintores de incendios para reemplazar los CFC. Este efecto extintor se ha atribuido a su alta capacidad calorífica, que le quita calor al fuego. Se ha sugerido que una atmósfera que contenga un porcentaje significativo de perfluorocarbonos en una estación espacial o similar evitaría los incendios por completo. Cuando se produce la combustión, se producen vapores tóxicos, incluidos el fluoruro de carbonilo, el monóxido de carbono y el fluoruro de hidrógeno.
Propiedades de disolución de gases
Los perfluorocarbonos disuelven volúmenes relativamente altos de gases. La alta solubilidad de los gases se atribuye a las débiles interacciones intermoleculares en estos fluidos de fluorocarbono.
La tabla muestra valores para la fracción molar, x1, de nitrógeno disuelto, calculado del coeficiente de reparto sangre-gas, a 298,15 K (25 °C), 0,101325 MPa.
| Líquido | 104x1 | Concentración (mM) |
|---|---|---|
| Agua | 0.118 | 0.65 |
| Ethanol | 3.57 | 6.12 |
| Tetrahidrofuran | 5.21 | 6.42 |
| Acetone | 5.42 | 7.32 |
| Cyclohexane | 7.73 | 7.16 |
| Perfluoro-1,3-dimetilciclohexano | 31.9 | 14.6 |
| Perfluorometilciclohexano | 33.1 | 16.9 |
Fabricación
El desarrollo de la industria de los fluorocarbonos coincidió con la Segunda Guerra Mundial. Antes de eso, los fluorocarbonos se preparaban por reacción de flúor con el hidrocarburo, es decir, fluoración directa. Debido a que los enlaces C-C se escinden fácilmente con flúor, la fluoración directa produce principalmente perfluorocarbonos más pequeños, como tetrafluorometano, hexafluoroetano y octafluoropropano.
Proceso de Fowler
Un gran avance que permitió la fabricación a gran escala de fluorocarbonos fue el proceso Fowler. En este proceso, se utiliza trifluoruro de cobalto como fuente de flúor. Ilustrativa es la síntesis de perfluorohexano:
- C6H14 + 28 CoF3 → C6F14 + 14 HF + 28 CoF2
El difluoruro de cobalto resultante luego se regenera, a veces en un reactor separado:
- 2 CoF2 + F2 → 2 CoF3
Industrialmente, ambos pasos se combinan, por ejemplo, en la fabricación de la gama de fluorocarbonos Flutec por parte de F2 Chemicals Ltd, utilizando un reactor de lecho agitado vertical, con hidrocarburo introducido en la parte inferior y flúor introducido en la mitad del reactor. El vapor de fluorocarbono se recupera por la parte superior.
Fluoración electroquímica
La fluoración electroquímica (ECF) (también conocida como el proceso Simons') implica la electrólisis de un sustrato disuelto en fluoruro de hidrógeno. Como el flúor en sí mismo se fabrica mediante la electrólisis del fluoruro de hidrógeno, ECF es una ruta bastante más directa hacia los fluorocarbonos. El proceso procede a bajo voltaje (5 – 6 V) para que no se libere flúor libre. La elección del sustrato está restringida ya que idealmente debería ser soluble en fluoruro de hidrógeno. Típicamente se emplean éteres y aminas terciarias. Para hacer perfluorohexano, se usa trihexilamina, por ejemplo:
- N(C)6H13)3 + 45 HF → 3 C6F14 + NF3 + 42 H2
La amina perfluorada también se producirá:
- N(C)6H13)3 + 39 HF → N(C)6F13)3 + 39H2
Preocupaciones ambientales y de salud
Los fluoroalcanos son generalmente inertes y no tóxicos.
Los fluoroalcanos no agotan la capa de ozono, ya que no contienen átomos de cloro ni de bromo, y en ocasiones se utilizan como sustitutos de los productos químicos que la agotan. El término fluorocarbono se usa de manera bastante vaga para incluir cualquier producto químico que contenga flúor y carbono, incluidos los clorofluorocarbonos, que agotan la capa de ozono. Los fluoroalcanos a veces se confunden con los fluorotensioactivos, que se bioacumulan significativamente.
Los perfluoroalcanos no se bioacumulan; los que se utilizan en procedimientos médicos se excretan rápidamente del cuerpo, principalmente a través de la espiración con la tasa de excreción en función de la presión de vapor; la vida media del octafluoropropano es de menos de 2 minutos, en comparación con una semana para la perfluorodecalina.
Los perfluoroalcanos de bajo punto de ebullición son potentes gases de efecto invernadero, en parte debido a su larga vida atmosférica y su uso está cubierto por el Protocolo de Kioto. El potencial de calentamiento global (en comparación con el del dióxido de carbono) de muchos gases se puede encontrar en el quinto informe de evaluación del IPCC, con un extracto a continuación para algunos perfluoroalcanos.
| Nombre | Fórmula química | Lifetime (y) | GWP (100 años) |
|---|---|---|---|
| PFC-14 | CF4 | 50000 | 6630 |
| PFC-116 | C2F6 | 10000 | 11100 |
| PFC-c216 | c-C3F6 | 3000 | 9200 |
| PFC-218 | C3F6 | 2600 | 8900 |
| PFC-318 | c-C4F8 | 3200 | 9540 |
La industria de fundición de aluminio ha sido una fuente importante de perfluorocarbonos atmosféricos (especialmente tetrafluorometano y hexafluoroetano), producidos como subproductos del proceso de electrólisis. Sin embargo, la industria ha estado involucrada activamente en la reducción de emisiones en los últimos años.
Aplicaciones
Como son inertes, los perfluoroalcanos esencialmente no tienen usos químicos, pero sus propiedades físicas han llevado a su uso en muchas aplicaciones diversas. Éstos incluyen:
- Trazador de perfluorocarbono
- Diéctrico líquido
- Deposición de vapor químico
- Ciclo de Rankine orgánico
- Catálisis bifálica fluorosa
- Cosméticos
- Cerillas de esquí
Además de varios usos médicos:
- Ultrasonido mejorado por contraste
- Terapia de oxígeno
- Sustituto de sangre
- Respiración líquido
- Cirugía ocular
- Eliminación del tatuaje
Fluoroalquenos y fluoroalquinos
Los fluorocarbonos insaturados son mucho más reactivos que los fluoroalcanos. Aunque el difluoroacetileno es inestable (como es típico de los alquinos relacionados, véase dicloroacetileno), el hexafluoro-2-butino y los alquinos fluorados relacionados son bien conocidos.
- fluorocarbonos insaturados
Polimerización
Los fluoroalquenos se polimerizan de forma más exotérmica que los alquenos normales. Los fluorocarbonos insaturados tienen una fuerza impulsora hacia la hibridación sp3 debido a que los átomos de flúor electronegativos buscan una mayor proporción de electrones de enlace con un carácter s reducido en los orbitales. El miembro más famoso de esta clase es el tetrafluoroetileno, que se utiliza para fabricar politetrafluoroetileno (PTFE), más conocido bajo el nombre comercial de teflón.
Preocupaciones ambientales y de salud
Los fluoroalquenos y los alquinos fluorados son reactivos y muchos son tóxicos, por ejemplo, el perfluoroisobuteno. Para producir politetrafluoroetileno se utilizan varios tensioactivos fluorados, en el proceso conocido como polimerización en emulsión, y el tensioactivo incluido en el polímero puede bioacumularse.
Compuestos perfluoroaromáticos
Los compuestos perfluoroaromáticos contienen solo carbono y flúor, como otros fluorocarbonos, pero también contienen un anillo aromático. Los tres ejemplos más importantes son hexafluorobenceno, octafluorotolueno y octafluoronaftaleno.
- Compuestos perfluoroaromáticos
Los compuestos perfluoroaromáticos se pueden fabricar a través del proceso Fowler, como los fluoroalcanos, pero las condiciones deben ajustarse para evitar la fluoración total. También se pueden fabricar calentando el compuesto percloroaromático correspondiente con fluoruro de potasio a alta temperatura (típicamente 500 °C), durante el cual los átomos de cloro se reemplazan por átomos de flúor. Una tercera vía es la desfluoración del fluoroalcano; por ejemplo, el octafluorotolueno se puede fabricar a partir de perfluorometilciclohexano calentándolo a 500 °C con un catalizador de níquel o hierro.
Los compuestos perfluoroaromáticos son relativamente volátiles en relación con su peso molecular, con puntos de fusión y ebullición similares a los del compuesto aromático correspondiente, como muestra la siguiente tabla. Tienen alta densidad y no son inflamables. En su mayor parte, son líquidos incoloros. A diferencia de los perfluoralcanos, tienden a ser miscibles con los solventes comunes.
| Compuesto | Punto de fusión (°C) | Punto de bobinado (°C) |
|---|---|---|
| Hexafluorobenceno | 5.3 | 80,5 |
| Benzene | 5,5 | 80.1 |
| Octafluorotolueno | " 070− | 102–103 |
| Toluene | ,95 - 95 | 110.6 |
| Perfluoro (etilbenceno) | 114–115 | |
| Ethylbenzene | −93.9 | 136.2 |
| Octafluoronaphthalene | 86 a 87 | 209 |
| Naphthalene | 80.2 | 217,9 |
Contenido relacionado
Energía libre termodinámica
Transición de fase
Ferrocianuro de potasio