Flúor
El flúor es un elemento químico con el símbolo F y el número atómico 9. Es el halógeno más ligero y existe en condiciones estándar como un gas diatómico de color amarillo pálido altamente tóxico. Como el elemento más electronegativo, es extremadamente reactivo, ya que reacciona con todos los demás elementos, excepto con el argón, el neón y el helio.
Entre los elementos, el flúor ocupa el puesto 24 en abundancia universal y el 13 en abundancia terrestre. La fluorita, la principal fuente mineral de flúor que le dio su nombre al elemento, se describió por primera vez en 1529; como se agregó a los minerales metálicos para reducir sus puntos de fusión para la fundición, el verbo latino fluoque significa 'flujo' le dio su nombre al mineral. Propuesto como un elemento en 1810, el flúor resultó difícil y peligroso de separar de sus compuestos, y varios de los primeros experimentadores murieron o sufrieron lesiones a causa de sus intentos. Solo en 1886, el químico francés Henri Moissan aisló el flúor elemental mediante electrólisis a baja temperatura, un proceso que todavía se emplea para la producción moderna. La producción industrial de gas flúor para el enriquecimiento de uranio, su mayor aplicación, comenzó durante el Proyecto Manhattan en la Segunda Guerra Mundial.
Debido al costo de refinar el flúor puro, la mayoría de las aplicaciones comerciales usan compuestos de flúor, y aproximadamente la mitad de la fluorita extraída se usa en la fabricación de acero. El resto de la fluorita se convierte en fluoruro de hidrógeno corrosivo en el camino hacia varios fluoruros orgánicos, o en criolita, que juega un papel clave en la refinación del aluminio. Las moléculas que contienen un enlace carbono-flúor a menudo tienen una estabilidad química y térmica muy alta; sus principales usos son como refrigerantes, aislamiento eléctrico y utensilios de cocina, y PTFE (teflón). Los productos farmacéuticos como la atorvastatina y la fluoxetina contienen enlaces C-F. El ion de fluoruro de las sales de fluoruro disueltas inhibe las caries dentales y, por lo tanto, encuentra uso en la pasta de dientes y la fluoración del agua. Las ventas globales de fluoroquímicos ascienden a más de US$69 mil millones al año.
Los gases de fluorocarbono son generalmente gases de efecto invernadero con un potencial de calentamiento global de 100 a 23 500 veces mayor que el del dióxido de carbono, y el SF 6 tiene el mayor potencial de calentamiento global de cualquier sustancia conocida. Los compuestos organofluorados a menudo persisten en el medio ambiente debido a la fuerza del enlace carbono-flúor. El flúor no tiene un papel metabólico conocido en los mamíferos; algunas plantas y esponjas marinas sintetizan venenos organofluorados (la mayoría de las veces monofluoroacetatos) que ayudan a disuadir a la depredación.
Características
Configuración electronica
Los átomos de flúor tienen nueve electrones, uno menos que el neón, y la configuración electrónica 1s 2s 2p: dos electrones en una capa interna llena y siete en una capa externa que requiere que se llene uno más. Los electrones externos son ineficaces en el blindaje nuclear y experimentan una alta carga nuclear efectiva de 9 - 2 = 7; esto afecta las propiedades físicas del átomo.
La primera energía de ionización del flúor es la tercera más alta entre todos los elementos, detrás del helio y el neón, lo que complica la eliminación de electrones de los átomos neutros de flúor. También tiene una alta afinidad electrónica, solo superada por el cloro, y tiende a capturar un electrón para volverse isoelectrónico con el gas noble neón; tiene la electronegatividad más alta de cualquier elemento. Los átomos de flúor tienen un pequeño radio covalente de alrededor de 60 picómetros, similar a los de sus vecinos de época, el oxígeno y el neón.
Reactividad
La energía de enlace del diflúor es mucho menor que la del Cl2o hermano2y similar al enlace de peróxido fácilmente escindible; esto, junto con la alta electronegatividad, explica la fácil disociación, la alta reactividad y los fuertes enlaces del flúor con los átomos que no son flúor. Por el contrario, los enlaces con otros átomos son muy fuertes debido a la alta electronegatividad del flúor. Las sustancias no reactivas como el acero en polvo, los fragmentos de vidrio y las fibras de asbesto reaccionan rápidamente con el gas flúor frío; la madera y el agua se queman espontáneamente bajo un chorro de flúor.
Las reacciones del flúor elemental con los metales requieren condiciones variables. Los metales alcalinos provocan explosiones y los metales alcalinotérreos muestran una actividad vigorosa a granel; para evitar la pasivación por la formación de capas de fluoruro metálico, la mayoría de los demás metales, como el aluminio y el hierro, deben pulverizarse, y los metales nobles requieren gas flúor puro a 300–450 °C (575–850 °F). Algunos no metales sólidos (azufre, fósforo) reaccionan vigorosamente en el flúor líquido. El sulfuro de hidrógeno y el dióxido de azufre se combinan fácilmente con el flúor, este último a veces de forma explosiva; El ácido sulfúrico exhibe mucha menos actividad y requiere temperaturas elevadas.
El hidrógeno, como algunos de los metales alcalinos, reacciona explosivamente con el flúor. El carbono, como negro de lámpara, reacciona a temperatura ambiente para producir fluorometano. El grafito se combina con flúor por encima de los 400 °C (750 °F) para producir monofluoruro de carbono no estequiométrico; las temperaturas más altas generan fluorocarbonos gaseosos, a veces con explosiones. El dióxido de carbono y el monóxido de carbono reaccionan a temperatura ambiente o justo por encima de ella, mientras que las parafinas y otros productos químicos orgánicos generan reacciones fuertes: incluso los haloalcanos completamente sustituidos, como el tetracloruro de carbono, normalmente incombustible, pueden explotar.Aunque el trifluoruro de nitrógeno es estable, el nitrógeno requiere una descarga eléctrica a temperaturas elevadas para que se produzca la reacción con el flúor, debido al enlace triple muy fuerte del nitrógeno elemental; el amoníaco puede reaccionar explosivamente. El oxígeno no se combina con el flúor en condiciones ambientales, pero se puede hacer que reaccione mediante descargas eléctricas a bajas temperaturas y presiones; los productos tienden a desintegrarse en sus elementos constituyentes cuando se calientan. Los halógenos más pesados reaccionan fácilmente con el flúor al igual que el gas noble radón; de los demás gases nobles, sólo reaccionan el xenón y el criptón, y sólo en condiciones especiales.
Etapas
A temperatura ambiente, el flúor es un gas de moléculas diatómicas, de color amarillo pálido cuando está puro (a veces descrito como amarillo verdoso). Tiene un olor acre y mordaz similar a un halógeno característico detectable a 20 ppb. El flúor se condensa en un líquido amarillo brillante a -188 °C (-306 °F), una temperatura de transición similar a la del oxígeno y el nitrógeno.
El flúor tiene dos formas sólidas, α- y β-flúor. Este último cristaliza a -220 °C (-364 °F) y es transparente y blando, con la misma estructura cúbica desordenada del oxígeno sólido recién cristalizado, a diferencia de los sistemas ortorrómbicos de otros halógenos sólidos. El enfriamiento adicional a -228 ° C (-378 ° F) induce una transición de fase a flúor α opaco y duro, que tiene una estructura monoclínica con capas de moléculas densas y en ángulo. La transición de β- a α-flúor es más exotérmica que la condensación de flúor y puede ser violenta.
Isótopos
Solo un isótopo de flúor ocurre naturalmente en abundancia, el isótopo estableF. _ Tiene una alta relación magnetogira y una sensibilidad excepcional a los campos magnéticos; debido a que también es el único isótopo estable, se usa en imágenes de resonancia magnética. Se han sintetizado dieciocho radioisótopos con números de masa de 13 a 31, de los cualesF es el más estable con una vida media de 109,77 minutos. Otros radioisótopos tienen vidas medias inferiores a 70 segundos; la mayoría se descompone en menos de medio segundo. los isótoposF yF sufren decaimiento β y captura de electrones, los isótopos más ligeros se descomponen por emisión de protones y los más pesados queF sufren decaimiento β (los más pesados con emisión retardada de neutrones). Se conocen dos isómeros metaestables del flúor,F, con una vida media de 162(7) nanosegundos, yF, con una vida media de 2,2(1) milisegundos.
Ocurrencia
Universo
| número atómico | Elemento | cantidad relativa |
|---|---|---|
| 6 | Carbón | 4.800 |
| 7 | Nitrógeno | 1,500 |
| 8 | Oxígeno | 8,800 |
| 9 | Flúor | 1 |
| 10 | Neón | 1,400 |
| 11 | Sodio | 24 |
| 12 | Magnesio | 430 |
Entre los elementos más livianos, el valor de abundancia del flúor de 400 ppb (partes por mil millones) (el vigésimo cuarto entre los elementos del universo) es excepcionalmente bajo: otros elementos, desde el carbono hasta el magnesio, son veinte o más veces más comunes. Esto se debe a que los procesos de nucleosíntesis estelar evitan el flúor, y cualquier átomo de flúor creado de otro modo tiene secciones transversales nucleares altas, lo que permite colisiones con hidrógeno o helio para generar oxígeno o neón, respectivamente.
Más allá de esta existencia transitoria, se han propuesto tres explicaciones para la presencia de flúor:
- durante las supernovas de tipo II, el bombardeo de átomos de neón por neutrinos podría transmutarlos en flúor;
- el viento solar de las estrellas Wolf-Rayet podría alejar el flúor de cualquier átomo de hidrógeno o helio; o
- el flúor se produce en las corrientes de convección que surgen de la fusión en estrellas asintóticas de ramas gigantes.
Tierra
El flúor es el decimotercer elemento más común en la corteza terrestre con 600–700 ppm (partes por millón) por masa. Aunque se cree que no se produce de forma natural, se ha demostrado que el flúor elemental está presente como una oclusión en la antozonita, una variante de la fluorita. La mayor parte del flúor existe como minerales que contienen fluoruro. La fluorita, la fluorapatita y la criolita son las más importantes industrialmente. Fluorita (CaF2), también conocido como espato flúor, abundante en todo el mundo, es la principal fuente de flúor y, por lo tanto, de flúor. China y México son los principales proveedores. La fluorapatita (Ca 5 (PO 4) 3 F), que contiene la mayor parte del fluoruro del mundo, es una fuente inadvertida de fluoruro como subproducto de la producción de fertilizantes. Criolita (Na3AlF6), utilizado en la producción de aluminio, es el mineral más rico en flúor. Las fuentes naturales económicamente viables de criolita se han agotado y la mayoría ahora se sintetiza comercialmente.
 Fluorita: Masa globular rosa con cristales facetados
Fluorita: Masa globular rosa con cristales facetados Fluorapatito: Cristal alargado en forma de prisma, sin brillo, en ángulo que sale de una roca con forma de agregado
Fluorapatito: Cristal alargado en forma de prisma, sin brillo, en ángulo que sale de una roca con forma de agregado Criolita: un contorno en forma de paralelogramo con moléculas diatómicas dispuestas en dos capas
Criolita: un contorno en forma de paralelogramo con moléculas diatómicas dispuestas en dos capas
Otros minerales como el topacio contienen flúor. Los fluoruros, a diferencia de otros haluros, son insolubles y no se encuentran en concentraciones comercialmente favorables en aguas salinas. Se han detectado trazas de organofluorados de origen incierto en erupciones volcánicas y manantiales geotérmicos. La existencia de flúor gaseoso en los cristales, sugerida por el olor de la antozonita triturada, es polémica; un estudio de 2012 informó la presencia de 0,04% F2en peso en antozonita, atribuyendo estas inclusiones a la radiación de la presencia de pequeñas cantidades de uranio.
Historia
Primeros descubrimientos
En 1529, Georgius Agricola describió la fluorita como un aditivo utilizado para reducir el punto de fusión de los metales durante la fundición. Escribió la palabra latina fluorēs (fluor, flujo) para rocas de fluorita. Más tarde, el nombre evolucionó a espato flúor (todavía de uso común) y luego a fluorita. Más tarde se determinó que la composición de la fluorita era difluoruro de calcio.
El ácido fluorhídrico se utilizó en el grabado de vidrio desde 1720 en adelante. Andreas Sigismund Marggraf lo caracterizó por primera vez en 1764 cuando calentó fluorita con ácido sulfúrico y la solución resultante corroyó su recipiente de vidrio. El químico sueco Carl Wilhelm Scheele repitió el experimento en 1771 y nombró al producto ácido fluss-spats-syran (ácido fluorita). En 1810, el físico francés André-Marie Ampère sugirió que el hidrógeno y un elemento análogo al cloro constituían el ácido fluorhídrico. También propuso en una carta a Sir Humphry Davy fechada el 26 de agosto de 1812 que esta sustancia entonces desconocida podría llamarse flúor del ácido fluórico y el sufijo -ina de otros halógenos.Esta palabra, a menudo con modificaciones, se usa en la mayoría de los idiomas europeos; sin embargo, el griego, el ruso y algunos otros, siguiendo la sugerencia posterior de Ampère, usan el nombre ftor o derivados, del griego φθόριος (phthorios, destructivo). El nuevo nombre latino fluorum le dio al elemento su símbolo actual F; Fl se utilizó en los primeros artículos.
Aislamiento
Los estudios iniciales sobre el flúor fueron tan peligrosos que varios experimentadores del siglo XIX fueron considerados "mártires del flúor" después de las desgracias con el ácido fluorhídrico. El aislamiento del flúor elemental se vio obstaculizado por la extrema corrosividad tanto del propio flúor elemental como del fluoruro de hidrógeno, así como por la falta de un electrolito simple y adecuado. Edmond Frémy postuló que la electrólisis de fluoruro de hidrógeno puro para generar flúor era factible e ideó un método para producir muestras anhidras a partir de bifluoruro de potasio acidificado; en cambio, descubrió que el fluoruro de hidrógeno (seco) resultante no conducía la electricidad.El ex alumno de Frémy, Henri Moissan, perseveró y, después de muchas pruebas y errores, descubrió que una mezcla de bifluoruro de potasio y fluoruro de hidrógeno seco era un conductor que permitía la electrólisis. Para evitar la rápida corrosión del platino en sus celdas electroquímicas, enfrió la reacción a temperaturas extremadamente bajas en un baño especial y forjó celdas con una mezcla más resistente de platino e iridio, y utilizó tapones de fluorita. En 1886, después de 74 años de esfuerzo de muchos químicos, Moissan aisló el flúor elemental.
En 1906, dos meses antes de su muerte, Moissan recibió el Premio Nobel de Química, con la siguiente mención:
[E]n reconocimiento a los grandes servicios prestados por él en su investigación y aislamiento del elemento flúor... El mundo entero ha admirado la gran habilidad experimental con la que ha estudiado esa bestia salvaje entre los elementos.
Usos posteriores
La división Frigidaire de General Motors (GM) experimentó con refrigerantes de clorofluorocarbono a fines de la década de 1920, y Kinetic Chemicals se formó como una empresa conjunta entre GM y DuPont en 1930 con la esperanza de comercializar Freon-12 (CCl2F2) como uno de esos refrigerantes. Reemplazó compuestos anteriores y más tóxicos, aumentó la demanda de refrigeradores de cocina y se volvió rentable; en 1949, DuPont había comprado Kinetic y comercializado varios otros compuestos de freón. El politetrafluoroetileno (teflón) fue descubierto por casualidad en 1938 por Roy J. Plunkett mientras trabajaba en refrigerantes en Kinetic, y su superlativa resistencia química y térmica lo llevó a acelerar su comercialización y producción en masa en 1941.
La producción a gran escala de flúor elemental comenzó durante la Segunda Guerra Mundial. Alemania usó electrólisis a alta temperatura para producir toneladas del trifluoruro de cloro incendiario planificado y el Proyecto Manhattan usó grandes cantidades para producir hexafluoruro de uranio para el enriquecimiento de uranio. Desde UF6es tan corrosivo como el flúor, las plantas de difusión gaseosa requerían materiales especiales: níquel para las membranas, fluoropolímeros para los sellos y fluorocarbonos líquidos como refrigerantes y lubricantes. Esta floreciente industria nuclear más tarde impulsó el desarrollo de fluoroquímicos de la posguerra.
Compuestos
El flúor tiene una química rica, que abarca dominios orgánicos e inorgánicos. Se combina con metales, no metales, metaloides y la mayoría de los gases nobles, y asume casi exclusivamente un estado de oxidación de -1. La alta afinidad electrónica del flúor da como resultado una preferencia por los enlaces iónicos; cuando forma enlaces covalentes, estos son polares, y casi siempre simples.
Rieles
Los metales alcalinos forman monofluoruros iónicos y altamente solubles; estos tienen la disposición cúbica del cloruro de sodio y cloruros análogos. Los difluoruros alcalinotérreos poseen fuertes enlaces iónicos, pero son insolubles en agua, con la excepción del difluoruro de berilio, que también exhibe cierto carácter covalente y tiene una estructura similar al cuarzo. Los elementos de tierras raras y muchos otros metales forman principalmente trifluoruros iónicos.
El enlace covalente adquiere importancia por primera vez en los tetrafluoruros: los de circonio, hafnio y varios actínidos son iónicos con puntos de fusión altos, mientras que los de titanio, vanadio y niobio son poliméricos, fundiéndose o descomponiéndose a no más de 350 °C (660 °C). F). Los pentafluoruros continúan esta tendencia con sus polímeros lineales y complejos oligoméricos. Se conocen trece hexafluoruros metálicos, todos octaédricos, y en su mayoría son sólidos volátiles excepto para MoF líquido6y referencia6, y WF gaseoso6. El heptafluoruro de renio, el único heptafluoruro metálico caracterizado, es un sólido molecular de bajo punto de fusión con geometría molecular bipiramidal pentagonal. Los fluoruros metálicos con más átomos de flúor son particularmente reactivos.
| Progresión estructural de fluoruros metálicos | ||
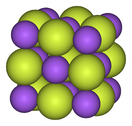 | 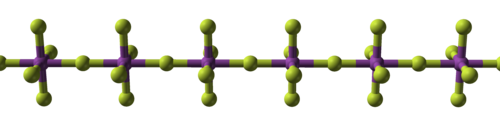 |  |
| Fluoruro de sodio, iónico | Pentafluoruro de bismuto, polimérico | Heptafluoruro de renio, molecular |
Hidrógeno
El hidrógeno y el flúor se combinan para producir fluoruro de hidrógeno, en el que las moléculas discretas forman grupos mediante enlaces de hidrógeno, que se asemejan más al agua que al cloruro de hidrógeno. Hierve a una temperatura mucho más alta que los haluros de hidrógeno más pesados y, a diferencia de ellos, es miscible con agua. El fluoruro de hidrógeno se hidrata fácilmente al contacto con el agua para formar fluoruro de hidrógeno acuoso, también conocido como ácido fluorhídrico. A diferencia de los otros ácidos hidrohálicos, que son fuertes, el ácido fluorhídrico es un ácido débil en bajas concentraciones. Sin embargo, puede atacar el vidrio, algo que los otros ácidos no pueden hacer.
Otros no metales reactivos
Los fluoruros binarios de metaloides y no metales del bloque p son generalmente covalentes y volátiles, con reactividades variables. Los no metales del período 3 y más pesados pueden formar fluoruros hipervalentes.
El trifluoruro de boro es plano y posee un octeto incompleto. Funciona como un ácido de Lewis y se combina con bases de Lewis como el amoníaco para formar aductos. El tetrafluoruro de carbono es tetraédrico e inerte; sus análogos de grupo, el silicio y el tetrafluoruro de germanio, también son tetraédricos pero se comportan como ácidos de Lewis. Los pnictógenos forman trifluoruros que aumentan en reactividad y basicidad con mayor peso molecular, aunque el trifluoruro de nitrógeno resiste la hidrólisis y no es básico. Los pentafluoruros de fósforo, arsénico y antimonio son más reactivos que sus respectivos trifluoruros, siendo el pentafluoruro de antimonio el ácido de Lewis neutro más fuerte que se conoce.
Los calcógenos tienen diversos fluoruros: se han informado difluoruros inestables para el oxígeno (el único compuesto conocido con oxígeno en un estado de oxidación de +2), azufre y selenio; existen tetrafluoruros y hexafluoruros para azufre, selenio y telurio. Estos últimos están estabilizados por más átomos de flúor y átomos centrales más ligeros, por lo que el hexafluoruro de azufre es especialmente inerte. El cloro, el bromo y el yodo pueden formar mono, tri y pentafluoruros, pero solo el heptafluoruro de yodo se ha caracterizado entre los posibles heptafluoruros interhalógenos. Muchos de ellos son fuentes poderosas de átomos de flúor, y las aplicaciones industriales que usan trifluoruro de cloro requieren precauciones similares a las que se usan con flúor.
Gases nobles
Los gases nobles, que tienen capas de electrones completas, desafiaron la reacción con otros elementos hasta 1962, cuando Neil Bartlett informó sobre la síntesis de hexafluoroplatinato de xenón; Desde entonces se han aislado difluoruro de xenón, tetrafluoruro, hexafluoruro y múltiples oxifluoruros. Entre otros gases nobles, el criptón forma un difluoruro, y el radón y el flúor generan un sólido que se sospecha que es difluoruro de radón. Los fluoruros binarios de gases nobles más ligeros son excepcionalmente inestables: el argón y el fluoruro de hidrógeno se combinan en condiciones extremas para dar argón fluorohidruro. El helio y el neón no tienen fluoruros de vida prolongada y nunca se ha observado fluoruro de neón; Se ha detectado fluorohidruro de helio durante milisegundos a altas presiones y bajas temperaturas.
Compuestos orgánicos
El enlace carbono-flúor es el más fuerte de la química orgánica y da estabilidad a los organofluorados. Es casi inexistente en la naturaleza, pero se usa en compuestos artificiales. La investigación en esta área generalmente está impulsada por aplicaciones comerciales; los compuestos involucrados son diversos y reflejan la complejidad inherente a la química orgánica.
Moléculas discretas
La sustitución de átomos de hidrógeno en un alcano por cada vez más átomos de flúor altera gradualmente varias propiedades: se reducen los puntos de fusión y ebullición, aumenta la densidad, disminuye la solubilidad en hidrocarburos y aumenta la estabilidad general. Los perfluorocarbonos, en los que todos los átomos de hidrógeno están sustituidos, son insolubles en la mayoría de los disolventes orgánicos y reaccionan en condiciones ambientales solo con sodio en amoníaco líquido.
El término compuesto perfluorado se usa para lo que de otro modo sería un perfluorocarbono si no fuera por la presencia de un grupo funcional, a menudo un ácido carboxílico. Estos compuestos comparten muchas propiedades con los perfluorocarbonos, como la estabilidad y la hidrofobicidad, mientras que el grupo funcional aumenta su reactividad, lo que les permite adherirse a las superficies o actuar como tensioactivos; Los fluorosurfactantes, en particular, pueden reducir la tensión superficial del agua más que sus análogos a base de hidrocarburos. Los fluorotelómeros, que tienen algunos átomos de carbono no fluorados cerca del grupo funcional, también se consideran perfluorados.
Polímeros
Los polímeros exhiben los mismos aumentos de estabilidad proporcionados por la sustitución de flúor (por hidrógeno) en moléculas discretas; sus puntos de fusión generalmente también aumentan. Politetrafluoroetileno (PTFE), el fluoropolímero más simple y análogo de perfluoro de polietileno con unidad estructural – CF2–, demuestra este cambio como se esperaba, pero su punto de fusión muy alto lo hace difícil de moldear. Varios derivados de PTFE son menos tolerantes a la temperatura pero más fáciles de moldear: el etileno propileno fluorado reemplaza algunos átomos de flúor con grupos trifluorometilo, los perfluoroalcoxi alcanos hacen lo mismo con grupos trifluorometoxi y Nafion contiene cadenas laterales de perfluoroéter cubiertas con grupos de ácido sulfónico. Otros fluoropolímeros retienen algunos átomos de hidrógeno; el fluoruro de polivinilideno tiene la mitad de los átomos de flúor que el PTFE y el fluoruro de polivinilo tiene una cuarta parte, pero ambos se comportan de manera muy parecida a los polímeros perfluorados.
Producción
El flúor elemental y prácticamente todos los compuestos de flúor se producen a partir del fluoruro de hidrógeno o de sus soluciones acuosas, el ácido fluorhídrico. El fluoruro de hidrógeno se produce en hornos por la reacción endotérmica de la fluorita (CaF 2) con ácido sulfúrico:CaF 2 + H 2 SO 4 → 2 HF(g) + CaSO 4
A continuación, el HF gaseoso puede absorberse en agua o licuarse.
Alrededor del 20 % del HF fabricado es un subproducto de la producción de fertilizantes, que produce ácido hexafluorosilícico (H 2 SiF 6), que puede degradarse para liberar HF térmicamente y por hidrólisis:H 2 SiF 6 → 2 HF + SiF 4SiF 4 + 2 H 2 O → 4 HF + SiO 2
Rutas industriales a F 2
El método de Moissan se utiliza para producir cantidades industriales de flúor, a través de la electrólisis de una mezcla de fluoruro de potasio/fluoruro de hidrógeno: los iones de hidrógeno y fluoruro se reducen y oxidan en un cátodo de contenedor de acero y un ánodo de bloque de carbón, a menos de 8 a 12 voltios, para generar gas hidrógeno y flúor respectivamente. Las temperaturas son elevadas, KF•2HF se funde a 70 °C (158 °F) y se electroliza a 70–130 °C (158–266 °F). KF, que actúa para proporcionar conductividad eléctrica, es esencial ya que el HF puro no se puede electrolizar porque prácticamente no es conductor. El flúor se puede almacenar en cilindros de acero que tienen interiores pasivados, a temperaturas inferiores a 200 °C (392 °F); de lo contrario, se puede usar níquel. Las válvulas reguladoras y las tuberías están hechas de níquel, este último posiblemente usando Monel en su lugar.Se debe realizar pasivación frecuente, junto con la estricta exclusión de agua y grasas. En el laboratorio, la cristalería puede contener gas flúor en condiciones anhidras y de baja presión; en cambio, algunas fuentes recomiendan sistemas de níquel-Monel-PTFE.
Rutas de laboratorio
Mientras se preparaba para una conferencia de 1986 para celebrar el centenario del logro de Moissan, Karl O. Christe razonó que la generación química de flúor debería ser factible ya que algunos aniones de fluoruro metálico no tienen contrapartes neutras estables; su acidificación desencadena potencialmente la oxidación en su lugar. Ideó un método que desarrolla flúor a alto rendimiento y presión atmosférica:2 KMnO 4 + 2 KF + 10 HF + 3 H 2 O 2 → 2 K 2 MnF 6 + 8 H 2 O + 3 O 2 ↑2 K 2 MnF 6 + 4 SbF 5 → 4 KSbF 6 + 2 MnF 3 + F 2 ↑
Christe comentó más tarde que los reactivos "se conocen desde hace más de 100 años e incluso Moissan podría haber ideado este esquema". Todavía en 2008, algunas referencias aún afirmaban que el flúor era demasiado reactivo para cualquier aislamiento químico.
Aplicaciones industriales
La extracción de fluorita, que suministra la mayor parte del flúor mundial, alcanzó su punto máximo en 1989 cuando se extrajeron 5,6 millones de toneladas métricas de mineral. Las restricciones de clorofluorocarbono redujeron esto a 3,6 millones de toneladas en 1994; desde entonces, la producción ha ido en aumento. En 2003 se generaron alrededor de 4,5 millones de toneladas de mineral y unos ingresos de 550 millones de dólares EE.UU.; Informes posteriores estimaron las ventas globales de fluoroquímicos en 2011 en $15 mil millones y pronosticaron cifras de producción de 3,5 a 5,9 millones de toneladas para 2016–18 e ingresos de al menos $20 mil millones. La flotación por espuma separa la fluorita extraída en dos grados metalúrgicos principales de igual proporción: casi todo el 60-85 % de espato metálico puro se usa en la fundición de hierro, mientras que el 97 % o más de espato ácido puro se convierte principalmente en el fluoruro de hidrógeno intermedio industrial clave.

Diagrama en el que se puede hacer clic de la industria fluoroquímica según los flujos másicos
Cada año se producen al menos 17.000 toneladas métricas de flúor. Cuesta solo $ 5-8 por kilogramo como uranio o hexafluoruro de azufre, pero muchas veces más como elemento debido a los desafíos de manejo. La mayoría de los procesos que usan flúor libre en grandes cantidades emplean generación in situ bajo integración vertical.
La mayor aplicación del gas flúor, con un consumo de hasta 7.000 toneladas métricas anuales, es en la preparación de UF6para el ciclo del combustible nuclear. El flúor se utiliza para fluorar tetrafluoruro de uranio, formado a su vez a partir de dióxido de uranio y ácido fluorhídrico. El flúor es monoisotópico, por lo que cualquier diferencia de masa entre UF6moléculas se deben a la presencia detu oU, que permite el enriquecimiento de uranio mediante difusión gaseosa o centrifugación de gases. Aproximadamente 6.000 toneladas métricas por año se dedican a producir el SF dieléctrico inerte6para transformadores de alto voltaje y disyuntores, eliminando la necesidad de bifenilos policlorados peligrosos asociados con dispositivos llenos de aceite. Varios compuestos de flúor se utilizan en la electrónica: renio y hexafluoruro de tungsteno en la deposición química de vapor, tetrafluorometano en el grabado con plasma y trifluoruro de nitrógeno en equipos de limpieza. El flúor también se usa en la síntesis de fluoruros orgánicos, pero su reactividad a menudo requiere la conversión primero al ClF más suave.3, BrF3, o SI5, que en conjunto permiten una fluoración calibrada. Los productos farmacéuticos fluorados utilizan tetrafluoruro de azufre en su lugar.
Fluoruros inorgánicos
Al igual que con otras aleaciones de hierro, se agregan alrededor de 3 kg (6,5 lb) de metspar por cada tonelada métrica de acero; los iones de fluoruro reducen su punto de fusión y viscosidad. Además de su papel como aditivo en materiales como esmaltes y capas de varillas de soldadura, la mayoría de los espatos ácidos reaccionan con ácido sulfúrico para formar ácido fluorhídrico, que se utiliza en el decapado de acero, el grabado de vidrio y el craqueo de alcanos. Un tercio del HF se dedica a sintetizar criolita y trifluoruro de aluminio, ambos fundentes en el proceso Hall-Héroult para la extracción de aluminio; la reposición es necesaria por sus reacciones ocasionales con el aparato de fundición. Cada tonelada métrica de aluminio requiere aproximadamente 23 kg (51 lb) de fundente.Los fluorosilicatos consumen la segunda porción más grande, con el fluorosilicato de sodio utilizado en la fluoración del agua y el tratamiento de efluentes de lavandería, y como intermediario en el camino hacia la criolita y el tetrafluoruro de silicio. Otros fluoruros inorgánicos importantes incluyen los de cobalto, níquel y amonio.
Fluoruros organicos
Los organofluoruros consumen más del 20 % de la fluorita extraída y más del 40 % del ácido fluorhídrico, dominando los gases refrigerantes y aumentando la cuota de mercado de los fluoropolímeros. Los surfactantes son una aplicación menor, pero generan más de mil millones de dólares en ingresos anuales. Debido al peligro de las reacciones directas de hidrocarburo-flúor por encima de -150 °C (-240 °F), la producción industrial de fluorocarbono es indirecta, principalmente a través de reacciones de intercambio de halógenos como la fluoración Swarts, en la que los cloros de clorocarbono se sustituyen por flúor por fluoruro de hidrógeno bajo catalizadores. La fluoración electroquímica somete a los hidrocarburos a electrólisis en fluoruro de hidrógeno, y el proceso Fowler los trata con portadores sólidos de flúor como el trifluoruro de cobalto.
Gases refrigerantes
Los refrigerantes halogenados, denominados freones en contextos informales, se identifican mediante números R que indican la cantidad de flúor, cloro, carbono e hidrógeno presentes. Los clorofluorocarbonos (CFC) como el R-11, R-12 y R-114 alguna vez dominaron los organofluorados, alcanzando su punto máximo de producción en la década de 1980. Usados para sistemas de aire acondicionado, propulsores y solventes, su producción estaba por debajo de una décima parte de este pico a principios de la década de 2000, luego de una prohibición internacional generalizada.Los hidroclorofluorocarbonos (HCFC) y los hidrofluorocarbonos (HFC) se diseñaron como reemplazos; su síntesis consume más del 90% del flúor en la industria orgánica. Los HCFC importantes incluyen R-22, clorodifluorometano y R-141b. El principal HFC es el R-134a con un nuevo tipo de molécula HFO-1234yf, una hidrofluoroolefina (HFO) que cobra prominencia debido a su potencial de calentamiento global inferior al 1% del HFC-134a.
Polímeros
En 2006 y 2007 se produjeron alrededor de 180 000 toneladas métricas de fluoropolímeros, lo que generó ingresos por más de $3500 millones al año. El mercado global se estimó en poco menos de $ 6 mil millones en 2011 y se predijo que crecería un 6,5% por año hasta 2016. Los fluoropolímeros solo se pueden formar mediante la polimerización de radicales libres.
El politetrafluoroetileno (PTFE), a veces llamado por su nombre DuPont Teflon, representa entre el 60% y el 80% en masa de la producción mundial de fluoropolímeros. La mayor aplicación es en el aislamiento eléctrico ya que el PTFE es un excelente dieléctrico. También se usa en la industria química donde se necesita resistencia a la corrosión, en el revestimiento de tuberías, tuberías y juntas. Otro uso importante es la tela de fibra de vidrio recubierta con PFTE para techos de estadios. La principal aplicación de consumo es para utensilios de cocina antiadherentes. La película de PTFE sacudida se convierte en PTFE expandido (ePTFE), una membrana de poros finos a la que a veces se hace referencia con el nombre de marca Gore-Tex y que se usa para ropa impermeable, prendas protectoras y filtros; Las fibras de ePTFE se pueden convertir en sellos y filtros de polvo.Otros fluoropolímeros, incluido el etileno propileno fluorado, imitan las propiedades del PTFE y pueden sustituirlo; son más moldeables, pero también más costosos y tienen menor estabilidad térmica. Películas de dos fluoropolímeros diferentes reemplazan el vidrio en las células solares.
Los ionómeros fluorados químicamente resistentes (pero costosos) se utilizan como membranas celulares electroquímicas, de las cuales el primer y más destacado ejemplo es Nafion. Desarrollado en la década de 1960, se utilizó inicialmente como material de celda de combustible en naves espaciales y luego reemplazó a las celdas de proceso de cloro-álcali a base de mercurio. Recientemente, la aplicación de celdas de combustible ha resurgido con esfuerzos para instalar celdas de combustible de membrana de intercambio de protones en automóviles. Los fluoroelastómeros como Viton son mezclas de fluoropolímeros reticulados que se utilizan principalmente en juntas tóricas; El perfluorobutano (C 4 F 10) se utiliza como agente extintor de incendios.
Surfactantes
Los fluorosurfactantes son pequeñas moléculas organofluoradas que se utilizan para repeler el agua y las manchas. Aunque costosos (comparables a los productos farmacéuticos a $ 200–2000 por kilogramo), generaron más de $ 1 mil millones en ingresos anuales para 2006; Solo Scotchgard generó más de $ 300 millones en 2000. Los fluorosurfactantes son una minoría en el mercado general de surfactantes, la mayor parte del cual está ocupado por productos basados en hidrocarburos mucho más baratos. Las aplicaciones en pinturas están sobrecargadas por los costos de composición; este uso se valoró en solo $ 100 millones en 2006.
Agroquimicos
Alrededor del 30% de los agroquímicos contienen flúor, la mayoría de ellos herbicidas y fungicidas con algunos reguladores de cultivos. La sustitución de flúor, generalmente de un solo átomo o como máximo un grupo trifluorometilo, es una modificación robusta con efectos análogos a los productos farmacéuticos fluorados: mayor tiempo de permanencia biológica, cruce de membrana y alteración del reconocimiento molecular. Trifluralin es un ejemplo destacado, con un uso a gran escala en los EE. UU. como herbicida, pero se sospecha que es cancerígeno y ha sido prohibido en muchos países europeos.El monofluoroacetato de sodio (1080) es un veneno para mamíferos en el que dos hidrógenos del ácido acético se reemplazan con flúor y sodio; interrumpe el metabolismo celular al reemplazar el acetato en el ciclo del ácido cítrico. Sintetizado por primera vez a fines del siglo XIX, fue reconocido como insecticida a principios del siglo XX y luego se implementó en su uso actual. Nueva Zelanda, el mayor consumidor de 1080, lo usa para proteger a los kiwis de la invasora zarigüeya cola de cepillo común australiana. Europa y Estados Unidos han prohibido 1080.
Aplicaciones medicinales
Cuidado dental
Los estudios de población de mediados del siglo XX en adelante muestran que el fluoruro tópico reduce la caries dental. Esto se atribuyó primero a la conversión de la hidroxiapatita del esmalte dental en fluorapatita más duradera, pero los estudios sobre dientes prefluorados refutaron esta hipótesis, y las teorías actuales implican que el fluoruro ayuda al crecimiento del esmalte en caries pequeñas. Después de estudios de niños en áreas donde el fluoruro estaba naturalmente presente en el agua potable, la fluoración controlada del suministro público de agua para combatir la caries dental comenzó en la década de 1940 y ahora se aplica al agua que abastece al 6 por ciento de la población mundial, incluidos dos tercios de los estadounidenses. Las revisiones de la literatura académica en 2000 y 2007 asociaron la fluoración del agua con una reducción significativa de las caries dentales en los niños.A pesar de tales avales y la evidencia de que no hay efectos adversos además de la fluorosis dental en su mayoría benigna, todavía existe oposición por motivos éticos y de seguridad. Los beneficios de la fluoración han disminuido, posiblemente debido a otras fuentes de fluoruro, pero aún se pueden medir en grupos de bajos ingresos. El monofluorofosfato de sodio y, a veces, el fluoruro de sodio o estaño (II) se encuentran a menudo en las pastas dentales con fluoruro, introducidas por primera vez en los EE. UU. en 1955 y ahora omnipresentes en los países desarrollados, junto con enjuagues bucales, geles, espumas y barnices fluorados.
Productos farmaceuticos
El veinte por ciento de los productos farmacéuticos modernos contienen flúor. Uno de ellos, el reductor del colesterol atorvastatina (Lipitor), obtuvo más ingresos que cualquier otro fármaco hasta que se convirtió en genérico en 2011. La combinación de prescripción para el asma Seretide, uno de los diez principales fármacos de ingresos a mediados de la década de 2000, contiene dos ingredientes activos, uno de los cuales, fluticasona, está fluorado. Muchos fármacos están fluorados para retrasar la inactivación y alargar los períodos de dosificación porque el enlace carbono-flúor es muy estable. La fluoración también aumenta la lipofilia porque el enlace es más hidrofóbico que el enlace carbono-hidrógeno, y esto a menudo ayuda en la penetración de la membrana celular y, por lo tanto, en la biodisponibilidad.
Los tricíclicos y otros antidepresivos anteriores a la década de 1980 tenían varios efectos secundarios debido a su interferencia no selectiva con neurotransmisores distintos del objetivo de la serotonina; la fluoxetina fluorada fue selectiva y una de las primeras en evitar este problema. Muchos antidepresivos actuales reciben este mismo tratamiento, incluidos los inhibidores selectivos de la recaptación de serotonina: citalopram, su isómero escitalopram y fluvoxamina y paroxetina. Las quinolonas son antibióticos artificiales de amplio espectro que a menudo se fluoran para potenciar sus efectos. Estos incluyen ciprofloxacina y levofloxacina. El flúor también encuentra uso en los esteroides: la fludrocortisona es un mineralocorticoide que eleva la presión arterial, y la triamcinolona y la dexametasona son glucocorticoides potentes.La mayoría de los anestésicos inhalados están muy fluorados; el halotano prototipo es mucho más inerte y potente que sus contemporáneos. Los compuestos posteriores, como los éteres fluorados sevoflurano y desflurano, son mejores que el halotano y son casi insolubles en la sangre, lo que permite despertarse más rápido.
Escaneo PET
El flúor-18 se encuentra a menudo en trazadores radiactivos para la tomografía por emisión de positrones, ya que su vida media de casi dos horas es lo suficientemente larga como para permitir su transporte desde las instalaciones de producción hasta los centros de imágenes. El trazador más común es la fluorodesoxiglucosa que, después de una inyección intravenosa, es absorbida por tejidos que requieren glucosa, como el cerebro y la mayoría de los tumores malignos; La tomografía asistida por computadora se puede usar para obtener imágenes detalladas.
Transportadores de oxígeno
Los fluorocarbonos líquidos pueden contener grandes volúmenes de oxígeno o dióxido de carbono, más que la sangre, y han llamado la atención por sus posibles usos en la sangre artificial y en la respiración líquida. Debido a que los fluorocarbonos normalmente no se mezclan con agua, deben mezclarse en emulsiones (pequeñas gotas de perfluorocarbono suspendidas en agua) para usarse como sangre. Uno de esos productos, Oxycyte, ha pasado por ensayos clínicos iniciales. Estas sustancias pueden ayudar a los atletas de resistencia y están prohibidas en los deportes; La casi muerte de un ciclista en 1998 provocó una investigación sobre su abuso.Las aplicaciones de la respiración líquida de perfluorocarbono puro (que utiliza líquido de perfluorocarbono puro, no una emulsión de agua) incluyen ayudar a víctimas de quemaduras y bebés prematuros con pulmones deficientes. Se ha considerado el llenado pulmonar parcial y completo, aunque solo el primero ha tenido pruebas significativas en humanos. Un esfuerzo de Alliance Pharmaceuticals llegó a los ensayos clínicos, pero se abandonó porque los resultados no fueron mejores que las terapias normales.
Rol biológico
El flúor no es esencial para los humanos y otros mamíferos, pero se sabe que pequeñas cantidades son beneficiosas para fortalecer el esmalte dental (donde la formación de fluorapatita hace que el esmalte sea más resistente al ataque de los ácidos producidos por la fermentación bacteriana de los azúcares). Pequeñas cantidades de flúor pueden ser beneficiosas para la fortaleza de los huesos, pero esto último no se ha establecido definitivamente. Tanto la OMS como el Instituto de Medicina de las Academias Nacionales de EE. UU. publican la cantidad diaria recomendada (RDA) y la ingesta máxima tolerada de flúor, que varía según la edad y el sexo.
Los organofluorados naturales se han encontrado en microorganismos y plantas, pero no en animales. El más común es el fluoroacetato, que es utilizado como defensa contra los herbívoros por al menos 40 plantas en África, Australia y Brasil. Otros ejemplos incluyen ácidos grasos fluorados terminalmente, fluoroacetona y 2-fluorocitrato. Una enzima que une el flúor al carbono, la adenosil-fluoruro sintasa, se descubrió en bacterias en 2002.
Toxicidad
El flúor elemental es altamente tóxico para los organismos vivos. Sus efectos en humanos comienzan en concentraciones inferiores a las 50 ppm del cianuro de hidrógeno y son similares a las del cloro: por encima de 25 ppm se produce una irritación importante de los ojos y del sistema respiratorio, así como daño hepático y renal, que es el peligro inmediato para la vida y la salud. valor del flúor. Los ojos y la nariz se dañan gravemente a 100 ppm, y la inhalación de 1000 ppm de flúor causará la muerte en minutos, en comparación con las 270 ppm del cianuro de hidrógeno.
Ácido fluorhídrico
El ácido fluorhídrico es el más débil de los ácidos hidrohálicos, con un pKa de 3,2 a 25 °C. Es un líquido volátil debido a la presencia de enlaces de hidrógeno (mientras que los otros ácidos hidrohálicos son gases). Es capaz de atacar vidrio, hormigón, metales, materia orgánica.
El ácido fluorhídrico es un veneno de contacto con mayores peligros que muchos ácidos fuertes como el ácido sulfúrico, aunque es débil: permanece neutral en solución acuosa y, por lo tanto, penetra más rápido en los tejidos, ya sea por inhalación, ingestión o la piel, y al menos nueve trabajadores estadounidenses murieron. en tales accidentes de 1984 a 1994. Reacciona con el calcio y el magnesio en la sangre, lo que provoca hipocalcemia y posible muerte por arritmia cardíaca. La formación de fluoruro de calcio insoluble desencadena un fuerte dolor y las quemaduras de más de 160 cm (25 pulgadas) pueden causar una toxicidad sistémica grave.
La exposición puede no ser evidente durante ocho horas para HF al 50 %, aumentando a 24 horas para concentraciones más bajas, y una quemadura puede ser inicialmente indolora ya que el fluoruro de hidrógeno afecta la función nerviosa. Si la piel ha estado expuesta al HF, el daño puede reducirse enjuagándola bajo un chorro de agua durante 10 a 15 minutos y quitándose la ropa contaminada. El gluconato de calcio a menudo se aplica a continuación, proporcionando iones de calcio para unirse con fluoruro; las quemaduras en la piel se pueden tratar con gel de gluconato de calcio al 2,5% o soluciones de enjuague especiales.La absorción de ácido fluorhídrico requiere tratamiento médico adicional; el gluconato de calcio se puede inyectar o administrar por vía intravenosa. El uso de cloruro de calcio, un reactivo de laboratorio común, en lugar de gluconato de calcio está contraindicado y puede provocar complicaciones graves. Puede ser necesaria la escisión o amputación de las partes afectadas.
Ión fluoruro
Los fluoruros solubles son moderadamente tóxicos: 5 a 10 g de fluoruro de sodio, o 32 a 64 mg de iones de fluoruro por kilogramo de masa corporal, representan una dosis letal para adultos. Una quinta parte de la dosis letal puede causar efectos adversos para la salud, y el consumo excesivo crónico puede provocar fluorosis esquelética, que afecta a millones en Asia y África. El fluoruro ingerido forma ácido fluorhídrico en el estómago que se absorbe fácilmente en los intestinos, donde atraviesa las membranas celulares, se une al calcio e interfiere con varias enzimas antes de la excreción urinaria. Los límites de exposición se determinan mediante análisis de orina de la capacidad del cuerpo para eliminar los iones de fluoruro.
Históricamente, la mayoría de los casos de envenenamiento por fluoruro han sido causados por la ingestión accidental de insecticidas que contienen fluoruros inorgánicos. La mayoría de las llamadas actuales a los centros de control de envenenamiento por posible envenenamiento con fluoruro provienen de la ingestión de pasta de dientes que contiene fluoruro. El mal funcionamiento del equipo de fluoración del agua es otra causa: un incidente en Alaska afectó a casi 300 personas y mató a una persona. Los peligros de la pasta de dientes se agravan para los niños pequeños, y los Centros para el Control y la Prevención de Enfermedades recomiendan supervisar a los niños menores de seis años cepillándose los dientes para que no se traguen la pasta de dientes.Un estudio regional examinó un año de informes de envenenamiento por fluoruro de preadolescentes con un total de 87 casos, incluida una muerte por ingerir insecticida. La mayoría no tenía síntomas, pero alrededor del 30 % tenía dolores de estómago. Un estudio más grande en los EE. UU. tuvo hallazgos similares: el 80 % de los casos involucraron a niños menores de seis años y hubo pocos casos graves.
Preocupaciones ambientales
Atmósfera
El Protocolo de Montreal, firmado en 1987, estableció regulaciones estrictas sobre los clorofluorocarbonos (CFC) y los bromofluorocarbonos debido a su potencial dañino para la capa de ozono (ODP). La alta estabilidad que los adaptaba a sus aplicaciones originales también significaba que no se descomponían hasta que alcanzaban altitudes más altas, donde los átomos de cloro y bromo liberados atacaban las moléculas de ozono. Incluso con la prohibición y los primeros indicios de su eficacia, las predicciones advirtieron que pasarían varias generaciones antes de la recuperación total. Con una décima parte del PAO de los CFC, los hidroclorofluorocarbonos (HCFC) son los reemplazos actuales y están programados para ser sustituidos entre 2030 y 2040 por hidrofluorocarbonos (HFC) sin cloro y cero PAO. En 2007 se adelantó esta fecha a 2020 para los países desarrollados;la Agencia de Protección Ambiental ya había prohibido la producción de un HCFC y limitado la de otros dos en 2003. Los gases de fluorocarbono son generalmente gases de efecto invernadero con un potencial de calentamiento global (GWP) de alrededor de 100 a 10 000; el hexafluoruro de azufre tiene un valor de alrededor de 20.000. Un valor atípico es el HFO-1234yf, que es un nuevo tipo de refrigerante llamado hidrofluoroolefina (HFO) y ha atraído la demanda mundial debido a su GWP de menos de 1 en comparación con 1430 para el refrigerante estándar actual HFC-134a.
Biopersistencia
Los organofluorados exhiben biopersistencia debido a la fuerza del enlace carbono-flúor. Los ácidos perfluoroalquílicos (PFAA), que son poco solubles en agua debido a sus grupos funcionales ácidos, son contaminantes orgánicos persistentes destacados; El ácido perfluorooctanosulfónico (PFOS) y el ácido perfluorooctanoico (PFOA) son los más investigados. Se han encontrado trazas de PFAA en todo el mundo, desde los osos polares hasta los humanos, y se sabe que el PFOS y el PFOA residen en la leche materna y en la sangre de los recién nacidos. Una revisión de 2013 mostró una ligera correlación entre los niveles de PFAA en las aguas subterráneas y el suelo y la actividad humana; no hubo un patrón claro de una sustancia química dominante, y las cantidades más altas de PFOS se correlacionaron con cantidades más altas de PFOA.En el cuerpo, los PFAA se unen a proteínas como la albúmina sérica; tienden a concentrarse dentro de los humanos en el hígado y la sangre antes de excretarse a través de los riñones. El tiempo de permanencia en el cuerpo varía mucho según la especie, con vidas medias de días en roedores y años en humanos. Altas dosis de PFOS y PFOA causan cáncer y muerte en roedores recién nacidos, pero los estudios en humanos no han establecido un efecto en los niveles de exposición actuales.
Contenido relacionado
Decantación
Coloide
Botella de Mariotte