Ficoeritrina
La ficoeritrina (PE) es un complejo proteína-pigmento rojo de la familia de las ficobiliproteínas captadoras de luz, presente en cianobacterias, algas rojas y criptofitas, accesorio de la clorofila principal. pigmentos responsables de la fotosíntesis. El pigmento rojo se debe al grupo protésico, la ficoeritrobilina, que le da a la ficoeritrina su color rojo.
Como todas las ficobiliproteínas, está compuesta por una parte proteica que se une covalentemente a cromóforos llamados ficobilinas. En la familia de las ficoeritrinas, las ficobilinas más conocidas son: la ficoeritrobilina, el cromóforo aceptor típico de ficoeritrina. La ficoeritrobilina es una molécula de tetrapirrol lineal que se encuentra en cianobacterias, algas rojas y criptomonas. Junto con otras bilinas como la ficocianobilina, sirve como pigmento captador de luz en las estructuras fotosintéticas captadoras de luz de las cianobacterias llamadas ficobilisomas. Las ficoeritrinas están compuestas por monómeros (αβ), generalmente organizados en un trímero en forma de disco (αβ)3 o hexámero (αβ)6 (el segundo es la unidad funcional del varillas de antena). Estos complejos típicos también contienen un tercer tipo de subunidad, la cadena γ.
Ficobilisomas

Las ficobiliproteínas son parte de enormes complejos proteicos de antenas captadoras de luz llamados ficobilisomas. En las algas rojas, están anclados al lado estromal de las membranas tilacoides de los cloroplastos, mientras que en las criptofitas, los ficobilisomas están reducidos y (en este caso, moléculas de ficobiliproteína 545 PE545) están densamente empaquetados dentro de la luz de los tilacoides.
Las ficobiliproteínas tienen muchas aplicaciones prácticas, incluidas propiedades imperativas como la actividad hepatoprotectora, antioxidante, antiinflamatoria y antienvejecimiento de las PBP, lo que permite su uso en las industrias alimentaria, cosmética, farmacéutica y biomédica. También se ha observado que las PBP muestran efectos beneficiosos en la terapéutica de algunas enfermedades como el Alzheimer y el cáncer.
La ficoeritrina es un pigmento accesorio de los principales pigmentos de clorofila responsables de la fotosíntesis. La energía luminosa es capturada por la ficoeritrina y luego pasa al par de clorofila del centro de reacción, la mayor parte del tiempo a través de las ficobiliproteínas ficocianina y aloficocianina.
Características estructurales
Las ficoeritrinas, excepto la ficoeritrina 545 (PE545), están compuestas de monómeros (αβ) ensamblados en hexámeros (αβ)6 o (αβ)3 en forma de disco con 32 o 3 simetría y canal central envolvente. En los ficobilisomas (PBS), cada trímero o hexámero contiene al menos una proteína conectora ubicada en el canal central. La B-ficoeritrina (B-PE) y la R-ficoeritrina (R-PE) de las algas rojas, además de las cadenas α y β, tienen una tercera subunidad γ que contribuye tanto a la función enlazadora como a la de captación de luz, porque lleva cromóforos.

4.
La R-ficoeritrina es producida predominantemente por algas rojas. La proteína está formada por al menos tres subunidades diferentes y varía según la especie de alga que la produce. La estructura de subunidad del R-PE más común es (αβ)6γ. La subunidad α tiene dos ficoeritrobilinas (PEB), la subunidad β tiene 2 o 3 PEB y una ficourobilina (PUB), mientras que las diferentes subunidades gamma tienen 3 PEB y 2 PUB (γ1) o 1 o 2 PEB y 1 PUB (γ2). El peso molecular del R-PE es de 250.000 daltons.
Las estructuras cristalinas disponibles en el Protein Data Bank contienen en una unidad asimétrica (αβ)2 o (αβγ)2 de diferentes ficoeritrinas:


| Cromoforo u otro molécula de no proteína | Phycoerythrin | Cadena | |||
|---|---|---|---|---|---|
| PE545 | B-PE | R-PE | otros tipos | ||
| Bilins | 8 | 10 | 10 | 10 | α y β |
| - Phycoerythrobilin (PEB) | 6 | 10 | 0 o 8 | 8 | β (PE545) o α y β |
| - 15,16-dihidrobiliverdina (DBV) | 2 | — | — | — | α (-3 y -2) |
| - Phycocyanobilin (CYC) | — | — | 8 o 7 o 0 | — | α y β |
| - Biliverdine IX alpha (BLA) | — | — | 0 o 1 | — | α |
| - Phycourobilin (PUB) | — | — | 2 | 2 | β |
| 5-hidroxilysine (LYZ) | 1 ó 2 | — | — | — | α (-3 o -3 y -2) |
| N-metil asparagine (MEN) | 2 | 2 | 0 o 2 | 2 | β |
| Sulfate ion SO42 - 2 (SO4) | — | 5 o 1 | 0 o 2 | — | α o α y β |
| Chloride ion Cl− (CL) | 1 | — | — | — | β |
| Magnesio ion Mg2+ (MG) | 2 | — | — | — | α-3 y β |
| inspeccionar archivos PDB | 1XG0 1XF6 1QGW | 3V57 3V58 | 1EYX 1LIA 1B8D | 2VJH | |
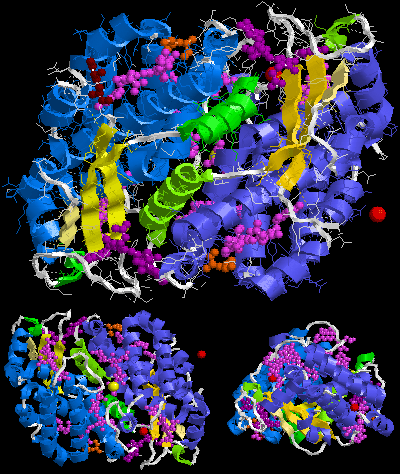
La molécula biológica supuesta de fitoerythrina 545 (PE545) es (αβ)2 o más bien (α)3β)(α2β). Los números 2 y 3 después de las letras α en segunda fórmula son parte de los nombres de cadena aquí, no sus cuentas. El nombre sinónimo criptofitano de α3 cadena es α1 cadena.
El conjunto más grande de B-ficoeritrina (B-PE) es el trímero (αβ)3. Sin embargo, las preparaciones de algas rojas también producen hexámero (αβ)6. En el caso de la R-ficoeritrina (R-PE), la molécula biológica más grande que se supone aquí es (αβγ)6, (αβγ)3( αβ)3 o (αβ)6 dependiendo de la publicación, para otros tipos de ficoeritrina (αβ)6. Estas cadenas γ del Protein Data Bank son muy pequeñas y constan solo de tres o seis aminoácidos reconocibles, mientras que la cadena γ del conector descrita al principio de esta sección es grande (por ejemplo, 277 aminoácidos de largo, 33 kDa en el caso de γ 33 del alga roja Aglaothamnion negligencia). Esto se debe a que la densidad electrónica del polipéptido gamma se promedia en su mayor parte mediante su triple simetría cristalográfica y sólo se pueden modelar unos pocos aminoácidos.
Para (αβγ)6, (αβ)6 o (αβγ)3(αβ) 3 los valores de la tabla deben multiplicarse simplemente por 3, (αβ)3 contiene números intermedios de moléculas no proteicas. (este non sequitur necesita ser corregido)
En la ficoeritrina PE545 anterior, una cadena α (-2 o -3) se une a una molécula de bilina; en otros ejemplos, se une a dos moléculas. La cadena β siempre se une a tres moléculas. La pequeña cadena γ no se une a ninguno.
Dos moléculas de N-metil asparagina están unidas a la cadena β, una de 5-hidroxilisina a α (-3 o -2), una de Mg2+ a α-3 y β, un Cl− a β, 1–2 moléculas de SO a α o β.
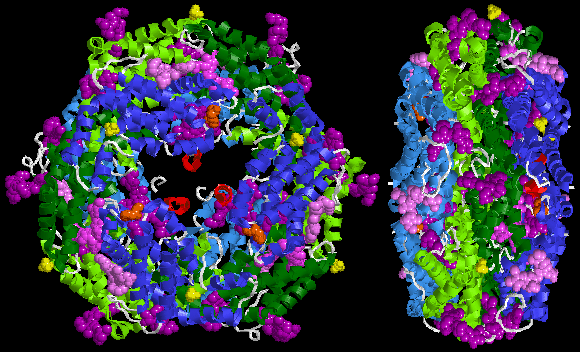
A continuación se muestra una estructura cristalina de muestra de R-ficoeritrina del Protein Data Bank:

Características espectrales
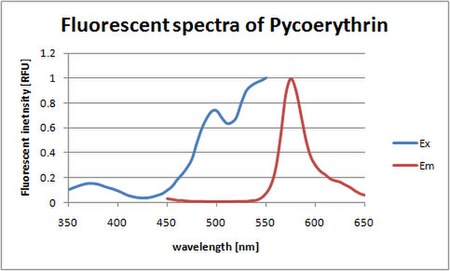
Los picos de absorción en el espectro de luz visible se miden a 495 y 545/566 nm, dependiendo de los cromóforos unidos y del organismo considerado. Existe un fuerte pico de emisión a 575 ± 10 nm. (La ficoeritrina absorbe luz ligeramente azul verdosa/amarillenta y emite luz ligeramente amarilla anaranjada).
| Propiedad | Valor |
|---|---|
| Absorción máxima | 565 nm |
| pico adicional de absorción | 498 nm |
| Máximo de emisión | 573 nm |
| Coeficiente de extinciónε) | 1.96×106 M−1 cm−1 |
| Rendimiento cuántico (QY) | 0.84 |
| Brillo (Brillo)ε × QY) | 1.65×106 M−1 cm−1 |
Las bilinas PEB y DBV en PE545 también absorben en la región espectral verde, con máximos a 545 y 569 nm respectivamente. El máximo de emisión de fluorescencia está a 580 nm.
Variaciones de R-ficoeritrina

Como se mencionó anteriormente, la ficoeritrina se puede encontrar en una variedad de especies de algas. Como tal, puede haber variaciones en la eficiencia de la absorbancia y la emisión de luz necesarias para facilitar la fotosíntesis. Esto podría ser el resultado de la profundidad en la columna de agua en la que normalmente reside un alga específica y la consiguiente necesidad de una mayor o menor eficiencia de los pigmentos accesorios.
Con los avances en la tecnología de imágenes y detección que pueden evitar el fotoblanqueo rápido, los fluoróforos de proteínas se han convertido en una herramienta viable y poderosa para los investigadores en campos como la microscopía, el análisis de microarrays y la transferencia Western. En vista de esto, puede ser beneficioso para los investigadores examinar estas R-ficoeritrinas variables para determinar cuál es la más apropiada para su aplicación particular. Incluso un pequeño aumento en la eficiencia fluorescente podría reducir el ruido de fondo y disminuir la tasa de resultados falsos negativos.
Aplicaciones prácticas
La R-ficoeritrina (también conocida como PE o R-PE) es útil en el laboratorio como indicador basado en fluorescencia para la presencia de cianobacterias y para marcar anticuerpos, más a menudo para citometría de flujo. También se utiliza en ensayos de microarrays, ELISA y otras aplicaciones que requieren alta sensibilidad pero no fotoestabilidad. Su uso está limitado en microscopía de inmunofluorescencia debido a sus características de fotoblanqueo rápido. También existen otros tipos de ficoeritrinas, como la B-ficoeritrina, que tienen propiedades espectrales ligeramente diferentes. La B-ficoeritrina absorbe fuertemente a aproximadamente 545 nm (verde ligeramente amarillento) y emite fuertemente a 572 nm (amarillo) y podría ser más adecuada para algunos instrumentos. La B-ficoeritrina también puede ser menos "pegajosa" que la R-ficoeritrina y contribuye menos a la señal de fondo debido a la unión no específica en ciertas aplicaciones. Sin embargo, R-PE está mucho más comúnmente disponible como conjugado de anticuerpo. Ficoeritrina (PE, λA máx = 540–570 nm; λF máx = 575–590 nm)
La R-ficoeritrina y la B-ficoeritrina se encuentran entre los tintes fluorescentes más brillantes jamás identificados.
Contenido relacionado
Ley de Fick
Miosina
Hexoquinasa
Microfluidos
Katal