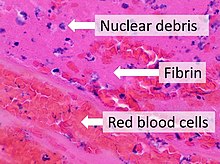
Fibrina

La fibrina (también llamada Factor Ia) es una proteína fibrosa no globular implicada en la coagulación de la sangre. Se forma por la acción de la proteasa trombina sobre el fibrinógeno, lo que provoca su polimerización. La fibrina polimerizada, junto con las plaquetas, forma un tapón hemostático o coágulo sobre el sitio de la herida.
Cuando se rompe el revestimiento de un vaso sanguíneo, las plaquetas son atraídas y se forma un tapón plaquetario. Estas plaquetas tienen receptores de trombina en sus superficies que se unen a las moléculas de trombina sérica, que a su vez convierten el fibrinógeno soluble en el suero en fibrina en el sitio de la herida. La fibrina forma hebras largas de proteína resistente e insoluble que se une a las plaquetas. El factor XIII completa el entrecruzamiento de la fibrina para que se endurezca y se contraiga. La fibrina reticulada forma una malla sobre el tapón de plaquetas que completa el coágulo. La fibrina fue descubierta por Marcello Malpighi en 1666.
Papel en la enfermedad
La generación excesiva de fibrina debido a la activación de la cascada de la coagulación conduce a la trombosis, el bloqueo de un vaso por aglutinación de glóbulos rojos, plaquetas, fibrina polimerizada y otros componentes. La generación ineficaz o la lisis prematura de fibrina aumenta la probabilidad de hemorragia.
La disfunción o enfermedad del hígado puede conducir a una disminución en la producción del precursor inactivo de la fibrina, el fibrinógeno, o a la producción de moléculas de fibrinógeno anormales con actividad reducida (disfibrinogenemia). Las anomalías hereditarias del fibrinógeno (el gen se transporta en el cromosoma 4) son de naturaleza cuantitativa y cualitativa e incluyen afibrinogenemia, hipofibrinogenemia, disfibrinogenemia e hipodisfibrinogenemia.
Es probable que la fibrina reducida, ausente o disfuncional convierta a los pacientes en hemofílicos.
Fisiología
La fibrina de varias fuentes animales diferentes generalmente se glicosila con glicanos unidos a asparagina de tipo complejo biantenario. La variedad se encuentra en el grado de fucosilación del núcleo y en el tipo de unión de ácido siálico y galactosa.
Estructura
La fibrina se forma después de la escisión con trombina del fibrinopéptido A (FPA) de las cadenas alfa del fibrinógeno, lo que inicia la polimerización de la fibrina. Las fibrillas de doble cadena se forman a través de asociaciones de dominio extremo a medio (D:E), y las asociaciones y ramificaciones de fibrillas laterales concomitantes crean una red de coágulos. El ensamblaje de la fibrina facilita la alineación C-terminal antiparalela intermolecular de los pares de cadenas gamma, que luego se "entrecruzan" covalentemente. por el factor XIII ('plasma protransglutaminasa') o XIIIa para formar 'gamma-dímeros'. La imagen de la izquierda es una estructura cristalina del fragmento doble d de fibrina humana con dos ligandos unidos. El método experimental utilizado para obtener la imagen fue la difracción de rayos X, y tiene una resolución de 2,30 Å. La estructura se compone principalmente de hélices alfa simples que se muestran en rojo y láminas beta que se muestran en amarillo. Las dos estructuras azules son los ligandos unidos. Las estructuras químicas de los ligandos son Ca2+ ion, alfa-D-manosa (C6H12O6), y D-glucosamina (C6H13NO5).
Contenido relacionado
Estado de conservación de la ecorregión
ATP sintasa
Naturalista (desambiguación)