Ferroceno
El ferroceno es un compuesto organometálico de fórmula Fe(C5H5)2. La molécula es un complejo que consta de dos anillos de ciclopentadienilo unidos a un átomo de hierro central. Es un sólido anaranjado con olor a alcanfor, que se sublima por encima de la temperatura ambiente y es soluble en la mayoría de los solventes orgánicos. Es notable por su estabilidad: no se ve afectado por el aire, el agua, las bases fuertes y se puede calentar a 400 °C sin descomponerse. En condiciones oxidantes puede reaccionar reversiblemente con ácidos fuertes para formar el catión ferrocenio Fe(C5H5)+2.
El rápido crecimiento de la química organometálica a menudo se atribuye al entusiasmo que generó el descubrimiento del ferroceno y sus muchos análogos, como los metalocenos.
Historia
Descubrimiento
El ferroceno fue descubierto tres veces por accidente. La primera síntesis conocida puede haber sido realizada a fines de la década de 1940 por investigadores desconocidos en Union Carbide, quienes intentaron pasar vapor de ciclopentadieno caliente a través de una tubería de hierro. El vapor reaccionó con la pared de la tubería, creando un "lodo amarillo" que obstruyó la tubería. Años más tarde, E. Brimm obtuvo y analizó una muestra del lodo que se había guardado, poco después de leer el artículo de Kealy y Pauson, y se descubrió que consistía en ferroceno.
La segunda vez fue alrededor de 1950, cuando S. Miller, J. Tebboth y J. Tremaine, investigadores de British Oxygen, intentaban sintetizar aminas a partir de hidrocarburos y nitrógeno en una modificación del proceso de Haber. Cuando intentaron hacer reaccionar ciclopentadieno con nitrógeno a 300 °C, a presión atmosférica, se sintieron decepcionados al ver que el hidrocarburo reaccionaba con alguna fuente de hierro, produciendo ferroceno. Si bien ellos también observaron su notable estabilidad, dejaron de lado la observación y no la publicaron hasta después de que Pauson informara sobre sus hallazgos. De hecho, Kealy y Pauson recibieron una muestra de Miller et al., quienes confirmaron que los productos eran del mismo compuesto.
En 1951, Peter L. Pauson y Thomas J. Kealy en la Universidad de Duquesne intentaron preparar fulvaleno ((C5H4)2) por dimerización oxidativa de ciclopentadieno (C5H6). Con ese fin, hicieron reaccionar el bromuro de ciclopentadienil magnesio compuesto de Grignard en éter dietílico con cloruro férrico como oxidante. Sin embargo, en lugar del fulvaleno esperado, obtuvieron un polvo de color naranja claro de "estabilidad notable", con la fórmula C 10H10Fe.
Determinación de la estructura
Pauson y Kealy conjeturaron que el compuesto tenía dos grupos ciclopentadienilo, cada uno con un enlace covalente simple del átomo de carbono saturado al átomo de hierro. Sin embargo, esa estructura no era consistente con los modelos de enlace existentes en ese momento y no explicaba la estabilidad inesperada del compuesto, y los químicos lucharon por encontrar la estructura correcta.
La estructura fue deducida e informada de forma independiente por tres grupos en 1952:
- Woodward y Wilkinson lo dedujeron observando que el ferroceno sufrió reacciones típicas de compuestos aromáticos como el benceno
- E. Fischer dedujo la estructura (que llamó "doble cono") y también sintetizó otros metallocenes como nickelocene y cobaltocene.
- P. F. Eiland and R. Pepinsky confirmed the structure through X-ray cristallography and later by NMR.
Comprender la estructura
El "sándwich" La estructura del ferroceno era sorprendentemente novedosa y requería una nueva teoría para explicarla. Aplicación de la teoría de orbitales moleculares con la suposición de un centro de Fe2+ entre dos aniones de ciclopentadienuro C5H−5 resultó en el exitoso modelo Dewar-Chatt-Duncanson, permitiendo la predicción correcta de la geometría de la molécula así como explicando su notable estabilidad.
Impacto
El ferroceno no fue el primer compuesto organometálico descubierto. Sal de Zeise K[PtCl3(C2 H4)]·H2O se informó en 1831, el descubrimiento de Mond de Ni(CO)4 ocurrió en 1888, y los compuestos de organolitio se desarrollaron en la década de 1930. Sin embargo, se puede argumentar que fue el descubrimiento del ferroceno lo que inició la química organometálica como un área separada de la química. También condujo a una explosión de interés en los compuestos de metales del bloque d con hidrocarburos.
El descubrimiento se consideró tan importante que Wilkinson y Fischer compartieron el Premio Nobel de Química de 1973 "por su trabajo pionero, realizado de forma independiente, sobre la química de los compuestos organometálicos llamados sándwich".
Estructura y unión
La espectroscopia de Mössbauer indica que al centro de hierro en el ferroceno se le debe asignar el estado de oxidación +2. A cada anillo de ciclopentadienilo (Cp) se le debe asignar una sola carga negativa. Por lo tanto, el ferroceno podría describirse como hierro (II) bis (ciclopentadienuro), Fe2+[C5H−5]2 .
El número de electrones π en cada anillo es seis, lo que lo hace aromático según la regla de Hückel. Estos doce electrones π luego se comparten con el metal a través de un enlace covalente. Dado que Fe2+ tiene seis electrones d, el complejo alcanza una configuración de 18 electrones, lo que explica su estabilidad. En notación moderna, este modelo estructural sándwich de la molécula de ferroceno se denota como Fe(η5-C5H5)2.
Las distancias de enlace carbono-carbono alrededor de cada anillo de cinco miembros son todas de 1,40 Å, y las distancias de enlace Fe-C son todas de 2,04 Å. Desde temperatura ambiente hasta 164K, la cristalografía de rayos X produce el grupo espacial monoclínico; los anillos de ciclopentadienuro tienen una conformación escalonada, lo que da como resultado una molécula centrosimétrica, con grupo de simetría D5d. Sin embargo, por debajo de 110 K, el ferroceno cristaliza en una red cristalina ortorrómbica en la que los anillos Cp están ordenados y eclipsados, de modo que la molécula tiene el grupo de simetría D5h. En la fase gaseosa, la difracción de electrones y los estudios computacionales muestran que los anillos Cp están eclipsados.
Los anillos Cp giran con una barrera baja sobre el eje Cp(centroide)–Fe–Cp(centroide), como se observa mediante mediciones en derivados sustituidos de ferroceno usando Espectroscopía de resonancia magnética nuclear 1H y 13C. Por ejemplo, metilferroceno (CH3C5H4FeC5H5) exhibe un singlete para el anillo C5H5.
En solución, y a temperatura ambiente, se determinó que el ferroceno D5h eclipsado dominaba sobre el confórmero D5d escalonado, según lo sugerido por la espectroscopia infrarroja transformada de Fourier y Cálculos DFT.
Síntesis
Síntesis industrial
Desde el punto de vista industrial, el ferroceno se sintetiza mediante la reacción de etóxido de hierro (II) con ciclopentadieno; el etóxido de hierro (II) necesario se produce por oxidación electroquímica de hierro metálico en etanol anhidro. Dado que la reacción entre el etóxido de hierro (II) y el ciclopentadieno produce etanol como subproducto, el etanol sirve efectivamente como catalizador para la reacción general, siendo la reacción neta Fe + 2C5H6 → H2 + Fe(C5H5)2 (ver también a continuación)
A través del reactivo de Grignard
Las primeras síntesis reportadas de ferroceno fueron casi simultáneas. Pauson y Kealy sintetizaron ferroceno usando cloruro de hierro (III) y un reactivo de Grignard, bromuro de ciclopentadienil magnesio. Se suspende cloruro de hierro (III) en éter dietílico anhidro y se añade al reactivo de Grignard. Se produce una reacción redox, formando el radical ciclopentadienilo y los iones de hierro (II). El dihidrofulvaleno se produce por recombinación radical-radical mientras que el hierro (II) reacciona con el reactivo de Grignard para formar ferroceno. No se produce la oxidación de dihidrofulvaleno a fulvaleno con hierro (III), el resultado buscado por Kealy y Pauson.
Reacción gas-metal
La otra síntesis temprana de ferroceno fue realizada por Miller et al., quienes hicieron reaccionar hierro metálico directamente con ciclopentadieno en fase gaseosa a temperatura elevada. También se informó un enfoque que usa pentacarbonilo de hierro.
- Fe(CO)5 + 2 C5H6g) → Fe(C)5H5)2 + 5 CO(g) + H2g)
Vía ciclopentadienuro alcalino
Los métodos de preparación más eficientes son generalmente una modificación de la secuencia de transmetalación original utilizando ciclopentadienuro de sodio comercialmente disponible o ciclopentadieno recién craqueado desprotonado con hidróxido de potasio y reaccionado con cloruro de hierro (II) anhidro en solventes etéreos.
Se conocen modificaciones modernas del enfoque original de Grignard de Pauson y Kealy:
- Utilizando ciclopentadienide sodio: 2 NaC5H5 + FeCl2 → Fe(C)5H5)2 + 2 NaCl
- Utilizando ciclopentadieno recién agrietado: FeCl2·4H2O + 2 C5H6 + 2 KOH → Fe(C5H5)2 + 2 KCl + 6 H2O
- Usando una sal de hierro(II) con un reactivo Grignard: 2 C5H5MgBr + FeCl2 → Fe(C)5H5)2 + 2 MgBrCl
Incluso se pueden usar algunas bases de amina (como la dietilamina) para la desprotonación, aunque la reacción es más lenta que cuando se usan bases más fuertes:
- 2 C5H6 + 2 (CH)3CH2)2NH + FeCl2 → Fe(C)5H5)2 + 2 (CH)3CH2)2NH2Cl
La transmetalación directa también se puede utilizar para preparar ferroceno a partir de otros metalocenos, como el manganoceno:
- FeCl2 + Mn(C)5H5)2 → MnCl2 + Fe(C)5H5)2
Propiedades
El ferroceno es un sólido naranja estable al aire con un olor a alcanfor. Como se esperaba para una especie simétrica sin carga, el ferroceno es soluble en solventes orgánicos normales, como el benceno, pero es insoluble en agua. Es estable a temperaturas de hasta 400 °C.
El ferroceno se sublima fácilmente, especialmente al calentarlo en el vacío. Su presión de vapor es de aproximadamente 1 Pa a 25 °C, 10 Pa a 50 °C, 100 Pa a 80 °C, 1000 Pa a 116 °C y 10 000 Pa (casi 0,1 atm) a 162 °C.
Reacciones
Con electrófilos
El ferroceno sufre muchas reacciones características de los compuestos aromáticos, lo que permite la preparación de derivados sustituidos. Un experimento universitario común es la reacción de Friedel-Crafts de ferroceno con anhídrido acético (o cloruro de acetilo) en presencia de ácido fosfórico como catalizador. Bajo condiciones para una reacción de Mannich, el ferroceno da N,N-dimetilaminometilferroceno.
La protonación del ferroceno permite el aislamiento de [Cp2FeH]PF6.
En presencia de cloruro de aluminio Me2NPCl2 y ferroceno reaccionan para dar ferrocenil diclorofosfina, mientras que el tratamiento con fenildiclorofosfina en condiciones similares forma P,P-diferrocenil-P-fenilfosfina.
El ferroceno reacciona con el P4S10 y forma un disulfuro de diferrocenil-ditiadifosfetano.
Litiación
El ferroceno reacciona con el butillitio para dar 1,1′-dilitioferroceno, que es un nucleófilo versátil. En combinación con butillitio, el terc-butillitio produce monolitioferroceno.
Química redox
El ferroceno sufre una oxidación de un electrón a alrededor de 0,4 V frente a un electrodo de calomelano saturado (SCE), convirtiéndose en ferrocenio. Esta oxidación reversible se ha utilizado como estándar en electroquímica como Fc+/Fc = 0,64 V frente al electrodo de hidrógeno estándar. Sin embargo, también se han informado otros valores. El tetrafluoroborato de ferrocenio es un reactivo común. El comportamiento de oxidación-reducción notablemente reversible se ha utilizado ampliamente para controlar los procesos de transferencia de electrones en sistemas electroquímicos y fotoquímicos.
Los sustituyentes en los ligandos de ciclopentadienilo alteran el potencial redox de la manera esperada: los grupos atractores de electrones, como un ácido carboxílico, desplazan el potencial en la dirección anódica (es decir, se vuelven más positivos), mientras que los electrones los grupos liberadores, como los grupos metilo, desplazan el potencial en la dirección catódica (más negativa). Por lo tanto, el decametilferroceno se oxida mucho más fácilmente que el ferroceno e incluso se puede oxidar al dicación correspondiente. El ferroceno se usa a menudo como estándar interno para calibrar los potenciales redox en electroquímica no acuosa.
Estereoquímica de ferrocenos sustituidos
Los ferrocenos disustituidos pueden existir como isómeros 1,2, 1,3 o 1,1′, ninguno de los cuales es interconvertible. Los ferrocenos disustituidos asimétricamente en un anillo son quirales, por ejemplo [CpFe(EtC5H3Me)]. Esta quiralidad plana surge a pesar de que ningún átomo individual es un centro estereogénico. Se ha demostrado que el ferroceno sustituido que se muestra a la derecha (un derivado de 4-(dimetilamino)piridina) es efectivo cuando se usa para la resolución cinética de alcoholes secundarios racémicos. Se han desarrollado varios enfoques para funcionalizar asimétricamente en 1,1′ el ferroceno.
Aplicaciones del ferroceno y sus derivados
El ferroceno y sus numerosos derivados no tienen aplicaciones a gran escala, pero tienen muchos nichos de uso que explotan la estructura inusual (armazones de ligandos, candidatos farmacéuticos), robustez (formulaciones antidetonantes, precursores de materiales) y redox (reactivos y estándares redox).
Andamios de ligandos
Las fosfinas de ferrocenilo quirales se emplean como ligandos para reacciones catalizadas por metales de transición. Algunos de ellos han encontrado aplicaciones industriales en la síntesis de productos farmacéuticos y agroquímicos. Por ejemplo, la difosfina 1,1′-bis(difenilfosfino)ferroceno (dppf) es un ligando valioso para las reacciones de acoplamiento de paladio y el ligando Josiphos es útil para la catálisis de hidrogenación. Llevan el nombre del técnico que hizo el primero, Josi Puleo.
Aditivos de combustible
El ferroceno y sus derivados son agentes antidetonantes utilizados en el combustible para motores de gasolina. Son más seguros que el tetraetilo de plomo utilizado anteriormente. Las soluciones de aditivos de gasolina que contienen ferroceno se pueden agregar a la gasolina sin plomo para permitir su uso en automóviles antiguos diseñados para funcionar con gasolina con plomo. Los depósitos que contienen hierro formados a partir del ferroceno pueden formar un revestimiento conductor en las superficies de las bujías. Los copolímeros de poliglicol de ferroceno, preparados al efectuar una reacción de policondensación entre un derivado de ferroceno y un alcohol dihidroxilado sustituido, son prometedores como componente de los propulsores de cohetes. Estos copolímeros proporcionan propulsores de cohetes con estabilidad térmica, sirviendo como aglutinante de propulsor y controlando la velocidad de combustión del propulsor.
Se ha descubierto que el ferroceno es eficaz para reducir el humo y el trióxido de azufre producidos al quemar carbón. La adición por cualquier medio práctico, impregnando el carbón o añadiendo ferroceno a la cámara de combustión, puede reducir significativamente la cantidad de estos subproductos indeseables, incluso con una pequeña cantidad del compuesto de ciclopentadienilo metálico.
Productos farmacéuticos
Los derivados del ferroceno se han investigado como fármacos, con un compuesto de ferrocerona aprobado para su uso en la URSS en la década de 1970, aunque ya no se comercializa en la actualidad. Solo un fármaco ha entrado en ensayos clínicos en los últimos años, la ferroquina (7-cloro-N-(2-((dimetilamino)metil)ferrocenil)quinolin-4-amina), un antipalúdico, que ha alcanzado los ensayos de fase IIb. Se han investigado sistemas de administración de fármacos basados en polímeros que contienen ferroceno.
La actividad anticancerígena de los derivados del ferroceno se investigó por primera vez a fines de la década de 1970, cuando se probaron los derivados con grupos amina o amida contra la leucemia linfocítica. Algunas sales de ferrocenio exhiben actividad anticancerígena, pero ningún compuesto ha sido evaluado en la clínica. Los derivados del ferroceno tienen una fuerte actividad inhibidora contra la línea celular de cáncer de pulmón humano A549, la línea celular de cáncer colorrectal HCT116 y la línea celular de cáncer de mama MCF-7. Se informó sobre un fármaco experimental que es una versión ferrocenil del tamoxifeno. La idea es que el tamoxifeno se una a los sitios de unión de los estrógenos, lo que resulta en citotoxicidad.
Los ferrocifenos son explotados para aplicaciones contra el cáncer por una empresa de biotecnología francesa, Feroscan, fundada por el Pr. Gerard Jaouen.
Propulsor sólido para cohetes
El ferroceno y los derivados relacionados se utilizan como potentes catalizadores de velocidad de combustión en propulsores compuestos de perclorato de amonio.
Derivados y variaciones
Los análogos de ferroceno se pueden preparar con variantes de ciclopentadienilo. Por ejemplo, bisindeniliron y bisfluoreniliron.
Los átomos de carbono pueden ser reemplazados por heteroátomos como se ilustra con Fe(η5-C5Me5)(η5-P5) y Fe(η5-C 5H5)(η5-C4H4 N) ("azaferroceno"). El azaferroceno surge de la descarbonilación de Fe(η5-C5H5)(CO)2 (η1-pirrol) en ciclohexano. Este compuesto al hervir a reflujo en benceno se convierte en ferroceno.
Debido a la facilidad de sustitución, se han preparado muchos derivados de ferroceno estructuralmente inusuales. Por ejemplo, el ligando penta(ferrocenil)ciclopentadienilo presenta un anión ciclopentadienilo derivatizado con cinco sustituyentes ferroceno.
En hexaferrocenilbenceno, C6[(η5-C5 H4)Fe(η5-C5H5)]6, las seis posiciones en una molécula de benceno tienen sustituyentes ferrocenilo (R). El análisis de difracción de rayos X de este compuesto confirma que los ligandos de ciclopentadienilo no son coplanares con el núcleo de benceno sino que tienen ángulos diédricos alternos de +30° y -80°. Debido al apiñamiento estérico, los ferrocenilos están ligeramente doblados con ángulos de 177° y tienen enlaces C-Fe alargados. Los átomos de carbono de ciclopentadienilo cuaternario también están piramidalizados. Además, el núcleo de benceno tiene una conformación de silla con ángulos diédricos de 14° y muestra una alternancia de longitud de enlace entre 142,7 pm y 141,1 pm, ambas indicaciones de apiñamiento estérico de los sustituyentes.
Se ha informado de la síntesis de hexaferrocenilbenceno mediante el acoplamiento de Negishi de hexaiodidobenceno y diferrocenilzinc, utilizando tris(dibencilidenacetona)dipaladio(0) como catalizador, en tetrahidrofurano:
El rendimiento es solo del 4 %, lo que es una prueba más consistente con el apiñamiento estérico sustancial alrededor del núcleo areno.
Química de materiales
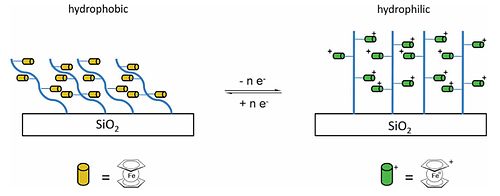
El ferroceno, un precursor de las nanopartículas de hierro, se puede utilizar como catalizador para la producción de nanotubos de carbono. El vinilferroceno se puede hacer mediante una reacción de Wittig del aldehído, una sal de fosfonio e hidróxido de sodio. El vinilferroceno se puede convertir en un polímero (polivinilferroceno, PVFc), una versión ferrocenilo del poliestireno (los grupos fenilo se reemplazan por grupos ferrocenilo). Otro poliferroceno que se puede formar es poli(2-(metacriloiloxi)etilo ferrocenocarboxilato), PFcMA. Además de utilizar estructuras de polímeros orgánicos, estas unidades colgantes de ferroceno se han unido a estructuras inorgánicas como polisiloxanos, polifosfacenos y polifosfinoboranos, (–PH(R)–BH2–)n, y los materiales resultantes exhiben propiedades físicas y electrónicas inusuales relacionadas con el par redox ferroceno/ferrocinio. Tanto PVFc como PFcMA se han unido a obleas de sílice y se ha medido la humectabilidad cuando las cadenas de polímeros están descargadas y cuando los restos de ferroceno se oxidan para producir grupos cargados positivamente. El ángulo de contacto con el agua en las obleas recubiertas con PFcMA fue 70° menor luego de la oxidación, mientras que en el caso de PVFc la disminución fue de 30° y el cambio de humectabilidad es reversible. En el caso de PFcMA, el efecto de alargar las cadenas y, por lo tanto, introducir más grupos ferroceno es una reducción significativamente mayor en el ángulo de contacto tras la oxidación.
Contenido relacionado
Johan August Arfwedson
Agua destilada
Gas mostaza