Fenilpropanoide


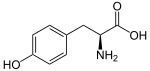
Los fenilpropanoides son una familia diversa de compuestos orgánicos que las plantas biosintetizan a partir de los aminoácidos fenilalanina y tirosina en la vía del ácido shikímico. Su nombre deriva del grupo fenilo aromático de seis carbonos y de la cola de propeno de tres carbonos del ácido cumárico, que es el intermediario central en la biosíntesis de fenilpropanoides. A partir del 4-cumaroil-CoA se origina la biosíntesis de una gran cantidad de productos naturales, entre ellos lignoles (precursores de la lignina y la lignocelulosa), flavonoides, isoflavonoides, cumarinas, auronas, estilbenos, catequina y fenilpropanoides. El componente cumaroil se produce a partir del ácido cinámico.
Los fenilpropanoides se encuentran en todo el reino vegetal, donde sirven como componentes esenciales de varios polímeros estructurales, brindan protección contra la luz ultravioleta, defienden contra herbívoros y patógenos y también median en las interacciones entre plantas y polinizadores como pigmentos florales y compuestos aromáticos.
Ácidos hidroxicinámicos
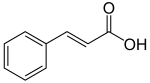
La fenilalanina se convierte primero en ácido cinámico por la acción de la enzima fenilalanina amoniaco-liasa (PAL). Algunas plantas, principalmente las monocotiledóneas, utilizan la tirosina para sintetizar ácido p-cumárico por la acción de la enzima bifuncional fenilalanina/tirosina amoniaco-liasa (PTAL). Una serie de hidroxilaciones y metilaciones enzimáticas conducen al ácido cumárico, ácido cafeico, ácido ferúlico, ácido 5-hidroxiferúlico y ácido sinápico. La conversión de estos ácidos en sus ésteres correspondientes produce algunos de los componentes volátiles de las fragancias de hierbas y flores, que cumplen muchas funciones, como atraer polinizadores. El cinamato de etilo es un ejemplo común.
Aldehídos cinámicos y monolignoles
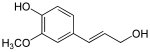
La reducción de los grupos funcionales de ácido carboxílico en los ácidos cinámicos proporciona los aldehídos correspondientes, como el cinamaldehído. Una reducción posterior proporciona monolignoles, entre ellos el alcohol cumarílico, el alcohol coniferílico y el alcohol sinapílico, que varían solo en su grado de metoxilación. Los monolignoles son monómeros que se polimerizan para generar diversas formas de lignina y suberina, que se utilizan como componente estructural de las paredes celulares de las plantas.

Los fenilpropenos, fenilpropanoides cuyo compuesto original es el alilbenceno (3-fenilpropeno), también se derivan de los monolignoles. Algunos ejemplos son el eugenol, el chavicol, el safrol y el estragol. Estos compuestos son los componentes principales de varios aceites esenciales.
Coumarins y flavonoides

La hidroxilación del ácido cinámico en la posición 4 por la trans-cinamato 4-monooxigenasa produce ácido p-cumárico, que puede modificarse posteriormente para formar derivados hidroxilados como la umbeliferona. Otro uso del ácido p-cumárico a través de su tioéster con la coenzima A, es decir, 4-cumaroil-CoA, es la producción de chalconas. Esto se logra con la adición de 3 moléculas de malonil-CoA y su ciclización en un segundo grupo fenilo. Las chalconas son los precursores de todos los flavonoides, una clase diversa de fitoquímicos.
Stilbenoids

Los estilbenoides, como el resveratrol, son derivados hidroxilados del estilbeno. Se forman a través de una ciclización alternativa de cinamoil-CoA o 4-cumaroil-CoA.
Sporopollenin
Los fenilpropanoides y otros compuestos fenólicos forman parte de la composición química de la esporopolenina. Está relacionada con la cutina y la suberina. Esta sustancia poco definida que se encuentra en el polen es inusualmente resistente a la degradación. Los análisis han revelado una mezcla de biopolímeros, que contiene principalmente ácidos grasos hidroxilados, fenilpropanoides, compuestos fenólicos y trazas de carotenoides. Los experimentos con trazadores han demostrado que la fenilalanina es un precursor importante, pero también contribuyen otras fuentes de carbono. Es probable que la esporopolenina se derive de varios precursores que están químicamente reticulados para formar una estructura rígida.
Véase también
- Apiole
- Asarone
- Chavicol
- Dillapiole
- Elemicin
- Estragole
- Eugenol
- Metil eugenol
- Myristicin
- Eleutherosides
Referencias
- ^ Barros J, Serrani-Yarce JC, Chen F, Baxter D, Venables BJ, Dixon RA (2016). "Role of bifunctional ammonia-lyase in grass cell wall biosynthesis". Plantas. 2 (6): 16050. doi:10.1038/nplants.2016.50. PMID 27255834. S2CID 3462127.
{{cite journal}}: CS1 maint: múltiples nombres: lista de autores (link) - ^ a b Vogt, T. (2010). "Phenylpropanoid Biosynthesis". Planta molecular. 3: 2-20. doi:10.1093/mp/ssp106. PMID 20035037.
Enlaces externos
- K Hahlbrock, D Scheel (1989). "Physiology and Molecular Biology of Phenylpropanoid Metabolism". Annual Review of Plant Physiology and Plant Molecular Biology. 40: 347–69. doi:10.1146/annurev.pp.40.060189.002023.