Fenilacetileno
El fenilacetileno es un hidrocarburo alquino que contiene un grupo fenilo. Existe como un líquido viscoso e incoloro. En la investigación, a veces se lo utiliza como análogo del acetileno; al ser un líquido, es más fácil de manipular que el gas acetileno.
Preparación
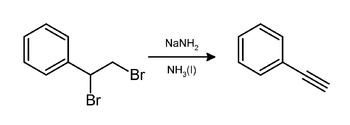
En el laboratorio, el fenilacetileno se puede preparar mediante la eliminación del bromuro de hidrógeno del dibromuro de estireno utilizando amida de sodio en amoníaco:
También se puede preparar mediante la eliminación del bromuro de hidrógeno del bromoestireno utilizando hidróxido de potasio fundido. Otro método consiste en el acoplamiento de Sonogashira del yodobenceno con trimetilsililacetileno, seguido de la eliminación del grupo trimetilsililo utilizando TBAF.
Reacciones
El fenilacetileno es un acetileno terminal prototípico, que experimenta muchas de las reacciones esperadas para ese grupo funcional. Experimenta semihidrogenación sobre un catalizador de Lindlar para dar estireno. En presencia de una base y sales de cobre (II), experimenta acoplamiento oxidativo para dar difenilbutadieno. En presencia de catalizadores metálicos, experimenta oligomerización, trimerización e incluso polimerización.
En presencia de reactivos de oro o mercurio, el fenilacetileno se hidrata para dar acetofenona:
- PhC2H + H2O → PhC(O)CH3
Véase también
- Alkyne
- Trimerización de Alkyne
Referencias
- ^ Bordwell, F.G. (1988). "Equilibrium acidities in dimethyl sulfoxide solution". Acc. Chem. Res. 21: 456–463. doi:10.1021/ar00156a004.
- ^ Streitwieser, A. Jr.; Ruben, D.M.E (1971). "Acididad de hidrocarburos. XXXV. Ácidos de equilibrio de fenilacetileno y ter-butilacetileno en ciclohexilamina". J. Am. Chem. Soc. 93: 1794-1795. doi:10.1021/ja00736a045.
- ^ Kenneth N. Campbell, Barbara K. Campbell (1950). "Phenylacetileno". Sintetías orgánicas. 30: 72. doi:10.15227/orgsyn.030.0072.
- ^ John C. Hessler (1922). "Phenylacetileno". Sintetías orgánicas. 2: 67. doi:10.15227/orgsyn.002.0067.
- ^ Nwokogu, Godson C.; Zemolka, Saskia; Dehme, Florian (2007). "Trimethylsilylacetileno". EROS. doi:10.1002/047084289X.rt288.pub2. ISBN 978-0471936237.
- ^ Campbell, I. D.; Eglinton, G. (1965). "Diphenyldiacetileno". Sintetías orgánicas. 45: 39. doi:10.15227/orgsyn.045.0039.
- ^ Gerhard Hilt; Thomas Vogler; Wilfried Hess; Fabrizio Galbiati (2005). "Un sistema de catalizadores de cobalto simple para la ciclotrimerización eficiente y regioselectiva de las alquinas". Comunicaciones químicas. 2005 11): 1474-1475. doi:10.1039/b417832g. PMID 15756340.
- ^ Ardizzoia, G. A.; Brenna, S.; Cenini, S.; LaMonica, G.; Masciocchi, N.; Maspero, A. (2003). "Oligomerization and Polymerization of Alkynes Catalyzed by Rhodium(I) Pyrazolate Complexes". Journal of Molecular Catalysis A: Chemical204–205: 333–340. doi:10.1016/S1381-1169(03)00315-7.