Farnesil-difosfato farnesiltransferasa
La escualeno sintasa (SQS) o farnesil-difosfato:farnesil-difosfato farnesil transferasa es una enzima localizada en la membrana del retículo endoplasmático. La SQS participa en la vía biosintética de los isoprenoides, catalizando una reacción de dos pasos en la que dos moléculas idénticas de farnesil pirofosfato (FPP) se convierten en escualeno, con el consumo de NADPH. La catálisis por SQS es el primer paso comprometido en la síntesis de esteroles, ya que el escualeno producido se convierte exclusivamente en varios esteroles, como el colesterol, a través de una vía compleja de varios pasos. La SQS pertenece a la familia de proteínas escualeno/fitoeno sintasa.
Diversidad
La escualeno sintasa se ha caracterizado en animales, plantas y levaduras. En términos de estructura y mecánica, la escualeno sintasa se parece mucho a la fitoeno sintasa (PHS), otra preniltransferasa. La PHS cumple una función similar a la SQS en plantas y bacterias, catalizando la síntesis de fitoeno, un precursor de los compuestos carotenoides.
Estructura
La escualeno sintasa (SQS) se localiza exclusivamente en la membrana del retículo endoplasmático (RE). La SQS está anclada a la membrana por un dominio corto que atraviesa la membrana en el extremo C. El dominio catalítico del extremo N de la enzima sobresale hacia el citosol, donde se unen los sustratos solubles. Las formas mamíferas de la SQS tienen aproximadamente 47 kDa y constan de ~416 aminoácidos. La estructura cristalina de la SQS humana se determinó en 2000 y reveló que la proteína estaba compuesta completamente de hélices α. La enzima está plegada en un solo dominio, caracterizado por un gran canal central. Los sitios activos de ambas semirreacciones catalizadas por la SQS se encuentran dentro de este canal. Un extremo del canal está abierto al citosol, mientras que el otro extremo forma un bolsillo hidrofóbico. La SQS contiene dos secuencias conservadas ricas en aspartato, que se cree que participan directamente en el mecanismo catalítico. Estos motivos ricos en aspartato son una de varias características estructurales conservadas en las enzimas biosintéticas de isoprenoides de clase I, aunque estas enzimas no comparten homología de secuencia.

Mecanismo
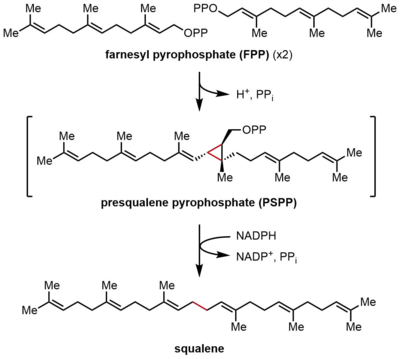
La escualeno sintasa (SQS) cataliza la dimerización reductora del pirofosfato de farnesilo (FPP), en la que dos moléculas idénticas de FPP se convierten en una molécula de escualeno. La reacción se produce en dos pasos, y pasa por el intermediario pirofosfato de prescualeno (PSPP). El FPP es un compuesto alílico soluble que contiene 15 átomos de carbono (C15), mientras que el escualeno es un isoprenoide insoluble de C30. Esta reacción es una síntesis de terpenos de cabeza a cabeza, porque las dos moléculas de FPP están unidas en la posición C4 y forman un enlace 1-1'. Esto contrasta con los enlaces 1'-4 que son mucho más comunes en la biosíntesis de isopreno que los enlaces 4-4'. El mecanismo de reacción del SQS requiere un catión divalente, a menudo Mg2+, para facilitar la unión de los grupos pirofosfato en el FPP.
FPP condensación
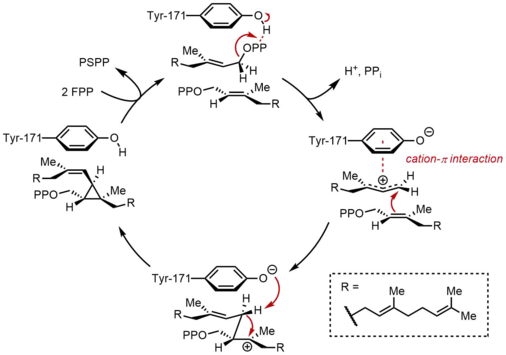
En la primera semirreacción, dos moléculas idénticas de pirofosfato de farnesilo (FPP) se unen a la escualeno sintasa (SQS) de manera secuencial. Las moléculas de FPP se unen a regiones distintas de la enzima y con diferentes afinidades de unión. Comenzando en la parte superior del ciclo catalítico que se encuentra debajo, la reacción comienza con la ionización de FPP para generar un carbocatión alílico. Un residuo de tirosina (Tyr-171) desempeña un papel fundamental en este paso al servir como donante de protones para facilitar la abstracción de pirofosfato. Además, el anión fenolato resultante puede estabilizar el carbocatión resultante a través de interacciones catión-π, que serían particularmente fuertes debido a la naturaleza altamente rica en electrones del anión fenolato. El catión alílico generado es luego atacado por la olefina de una segunda molécula de FPP, lo que produce un carbocatión terciario. El anión fenolato generado previamente sirve entonces como base para extraer un protón de este aducto y formar un producto de ciclopropano, el pirofosfato de prescualeno (PSPP). El PSPP creado permanece asociado con el SQS para la segunda reacción. La importancia de un residuo de tirosina en este proceso se demostró mediante estudios de mutagénesis con SQS de rata (rSQS), y por el hecho de que Tyr-171 se conserva en todos los SQS conocidos (y PHS). En rSQS, Tyr-171 se convirtió en los residuos aromáticos Phe y Trp, así como en el residuo que contiene hidroxilo Ser. Ninguno de estos mutantes fue capaz de convertir FPP en PSPP o escualeno, lo que demuestra que los anillos aromáticos o los alcoholes por sí solos son insuficientes para convertir FPP en PSPP.
Reorganización y reducción del PSPP
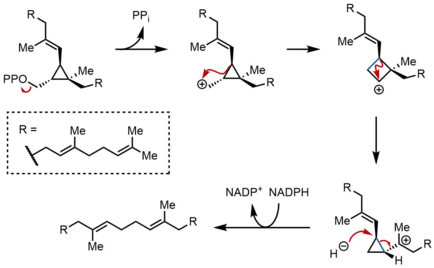
En la segunda semirreacción del SQS, el pirofosfato de prescualeno (PSPP) se desplaza a un segundo sitio de reacción dentro del SQS. Se cree que mantener el PSPP en el canal central del SQS protege al intermediario reactivo de la reacción con el agua. A partir del PSPP, el escualeno se forma mediante una serie de reordenamientos de carbocationes. El proceso comienza con la ionización del pirofosfato, lo que da lugar a un catión ciclopropilcarbinilo. El catión se reordena mediante una migración 1,2 de un enlace C–C de ciclopropano al carbocatión, lo que forma el enlace que se muestra en azul para dar lugar a un carbocatión ciclobutilo. Posteriormente, se produce una segunda migración 1,2 para formar otro catión ciclopropilcarbinilo, con el catión descansando sobre un carbono terciario. El carbocatión resultante es luego abierto por un hidruro liberado por NADPH, lo que da lugar al escualeno, que luego es liberado por SQS en la membrana del retículo endoplásmico.
Si bien los reordenamientos ciclopropilcarbinil-ciclopropilcarbinil pueden realizarse a través de intermediarios discretos de catión ciclobutilo, el supuesto catión ciclobutilo no pudo ser atrapado en los estudios de modelos. Por lo tanto, el catión ciclobutilo puede ser en realidad un estado de transición entre los dos cationes ciclopropilcarbinilo, en lugar de un intermediario discreto. La estereoquímica de los intermediarios y la geometría de la olefina en el producto final está determinada por la naturaleza suprafacial de los desplazamientos 1,2 y los requisitos estereoelectrónicos. Si bien se han propuesto otros mecanismos, el mecanismo que se muestra arriba está respaldado por el aislamiento de rillingol, que es el alcohol formado al atrapar el segundo catión ciclopropilcarbinilo con agua.
Reglamento

El FPP es un intermediario metabólico importante en la vía del mevalonato que representa un punto de ramificación importante en las vías de los terpenoides. El FPP se utiliza para formar varias clases importantes de compuestos además de esteroles (a través del escualeno), incluyendo la ubiquinona y los dolicoles. El SQS cataliza el primer paso comprometido en la biosíntesis de esteroles a partir del FPP y, por lo tanto, es importante para controlar el flujo hacia productos esterol frente a productos no esterol. La actividad del SQS está íntimamente relacionada con la actividad de la HMG-CoA reductasa, que cataliza el paso limitante de la velocidad de la vía del mevalonato. Los altos niveles de colesterol derivado de LDL inhiben significativamente la actividad de la HMG-CoA reductasa, ya que el mevalonato ya no es necesario para la producción de esteroles. Sin embargo, se observa actividad residual de la HMG-CoA reductasa incluso con niveles muy altos de LDL, de modo que el FPP se puede fabricar para formar productos no esterol esenciales para el crecimiento celular. Para evitar que este FPP residual se utilice para la síntesis de esteroles cuando los esteroles son abundantes, la actividad de SQS disminuye significativamente cuando los niveles de LDL son altos. Esta supresión de la actividad de SQS se considera mejor como un mecanismo de control del flujo, en lugar de una forma de regular los niveles de colesterol. Esto se debe a que la HMG-CoA reductasa es el factor de control más importante para regular la síntesis de colesterol (su actividad se inhibe en un 98% cuando los niveles de LDL son altos).
Regulación por esteroles
La regulación de SQS se produce principalmente a nivel de la transcripción del gen SQS. La clase de factores de transcripción de la proteína de unión al elemento regulador de esteroles (SREBP) es fundamental para regular los genes implicados en la homeostasis del colesterol y es importante para controlar los niveles de transcripción de SQS. Cuando los niveles de esteroles son bajos, una forma inactiva de SREBP se escinde para formar el factor de transcripción activo, que se desplaza al núcleo para inducir la transcripción del gen SQS. De los tres factores de transcripción SREBP conocidos, solo SREBP-1a y SREBP-2 activan la transcripción del gen SQS en hígados de ratones transgénicos. En células HepG2 cultivadas, SREBP-1a parece ser más importante que SREBP-2 en el control de la activación del promotor SQS. Sin embargo, se ha demostrado que los promotores SQS responden de forma diferente a SREBP-1a y SREBP-2 en diferentes sistemas experimentales.
Además de los SREBP, se necesitan factores de transcripción accesorios para la activación máxima del promotor SQS. Los estudios del promotor que utilizan ensayos del gen reportero de la luciferasa revelaron que los factores de transcripción Sp1 y NF-Y y/o CREB también son importantes para la activación del promotor SQS. NF-Y y/o CREB son necesarios para que SREBP-1a active completamente el promotor SQS, aunque Sp1 también es necesario para que SREBP-2 lo haga.
Mapa de la ruta interactiva
Haga clic en los genes, proteínas y metabolitos a continuación para acceder a los artículos correspondientes.
- ^ El mapa interactivo se puede editar en WikiPathways: "Statin_Pathway_WP430".
Función biológica
La escualeno sintasa (SQS) es una enzima que participa en la vía de biosíntesis de isoprenoides. La SQS sintasa cataliza el punto de ramificación entre la biosíntesis de esteroles y no esteroles, y destina el pirofosfato de farnesilo (FPP) exclusivamente a la producción de esteroles. Un esterol importante producido por esta vía es el colesterol, que se utiliza en las membranas celulares y para la síntesis de hormonas. La SQS compite con otras enzimas por el uso de FPP, ya que es un precursor de una variedad de terpenoides. Las disminuciones en la actividad de la SQS limitan el flujo de FPP a la vía de los esteroles y aumentan la producción de productos no esteroles. Entre los productos no esteroles importantes se encuentran la ubiquinona, los dolicoles, el hemo A y las proteínas farnesiladas.
El desarrollo de ratones deficientes en escualeno sintasa ha demostrado que la pérdida de esta enzima es letal y que es esencial para el desarrollo del sistema nervioso central.
Relevancia de la enfermedad
La escualeno sintasa es un objetivo para la regulación de los niveles de colesterol. Se ha demostrado que el aumento de la expresión de SQS eleva los niveles de colesterol en ratones. Por lo tanto, los inhibidores de SQS son de gran interés en el tratamiento de la hipercolesterolemia y la prevención de la enfermedad cardíaca coronaria (ECC). También se ha sugerido que las variantes de esta enzima pueden ser parte de una asociación genética con la hipercolesterolemia.
Inhibidores de la sintasis de la escualena
Se ha demostrado que los inhibidores de la escualeno sintasa disminuyen la síntesis de colesterol, así como los niveles plasmáticos de triglicéridos. Los inhibidores de la escualeno sintasa pueden proporcionar una alternativa a los inhibidores de la HMG-CoA reductasa (estatinas), que tienen efectos secundarios problemáticos para algunos pacientes. Los inhibidores de la escualeno sintasa que se han investigado para su uso en la prevención de enfermedades cardiovasculares incluyen lapaquistat (TAK-475), ácido zaragozico y RPR 107393. A pesar de haber alcanzado la fase II de los ensayos clínicos, el lapaquistat se suspendió en 2008.
Actualmente se está investigando la inhibición del homólogo de la escualeno sintasa en Staphylococcus aureus como terapia antibacteriana basada en factores de virulencia.
Referencias
- ^ Ichikawa M, Yokomizo A, Itoh M, Sugita K, Usui H, Shimizu H, Suzuki M, Terayama K, Kanda A (Marzo 2011). "Descubrimiento de una nueva plantilla de 2 aminobenzhydrol para inhibidores de la sintesis de escualene altamente potentes". Bioorg. Med. Chem. 19 (6): 1930–49. doi:10.1016/j.bmc.2011.01.065. PMID 21353782.
- ^ a b c d e f g h Tansey TR, Shechter I (diciembre de 2000). "Strutura y regulación de la sinthasa de escualeno mamífero". Biochim. Biofias. Acta. 1529 ()1 –3): 49 –62. doi:10.1016/S1388-1981(00)00137-2. PMID 11111077.
- ^ Nakashima T, Inoue T, Oka A, Nishino T, Osumi T, Hata S (marzo de 1995). "Cloning, expression, and characterization of cDNAs encoding Arabidopsis thaliana squalene synthase". Proc. Natl. Acad. Sci. USA. 92 (6): 2328 –32. Bibcode:1995PNAS...92.2328N doi:10.1073/pnas.92.6.2328. PMC 42476. PMID 7892265.
- ^ a b Tansey TR, Shechter I (2001). "Squalene synthase: structure and regulation". Prog. Nucleic Acid Res. Mol. Biol. Progress in Nucleic Acid Research and Molecular Biology. 65: 157–95. doi:10.1016/S0079-6603(00)65005-5. ISBN 9780125400657. PMID 11008488.
- ^ a b c d e Pandit J, Danley DE, Schulte GK, Mazzalupo S, Pauly TA, Hayward CM, Hamanaka ES, Thompson JF, Harwood HJ (septiembre de 2000). "Crystal structure of human squalene synthase. Una enzima clave en la biosíntesis de colesterol". J. Biol. Chem. 275 (39): 30610–7. doi:10.1074/jbc.M004132200. PMID 10896663.
- ^ Jennings SM, Tsay YH, Fisch TM, Robinson GW (julio de 1991). "La clonación molecular y la caracterización del gen de levadura para la sintetización del escualeno". Proc. Natl. Acad. Sci. USA. 88 (14): 6038 –42. Bibcode:1991PNAS...88.6038J. doi:10.1073/pnas.88.14.6038. PMC 52017. PMID 2068081.
- ^ a b Gu P, Ishii Y, Spencer TA, Shechter I (mayo de 1998). "Estudios de estructura de la acción e identificación de tres dominios de enzimas involucrados en la actividad catalítica en la sintetiza de escualeno hepática de ratas". J. Biol. Chem. 273 (20): 12515–25. doi:10.1074/jbc.273.20.12515. PMID 9575210.
- ^ Poulter CD (1990). "Biosíntesis de terpenes no cabeza a cola. Formación de enlaces 1'-1 y 1'-3". Accounts of Chemical Research. 23 3): 70–77. doi:10.1021/ar00171a003.
- ^ Lin FY, Liu CI, Liu YL, Zhang Y, Wang K, Jeng WY, Ko TP, Cao R, Wang AH, Oldfield E (diciembre de 2010). "Mecanismo de acción e inhibición de la sintesis de deshidrosqualene". Proc. Natl. Acad. Sci. USA. 107 (50): 21337 –42. Bibcode:2010PNAS..10721337L. doi:10.1073/pnas.1010907107. PMC 3003041. PMID 21098670.
- ^ a b Beytia E, Qureshi AA, Porter JW (marzo de 1973). "Squalene Synthetase. 3. Mecanismo de la reacción". J. Biol. Chem. 248 5): 1856 –67. doi:10.1016/S0021-9258(19)44269-5. PMID 4348553.
- ^ Mookhtiar KA, Kalinowski SS, Zhang D, Poulter CD (abril de 1994). "Sociedad sintosa de escualeno. Un mecanismo de adición de sustratos y activación por NADPH". J. Biol. Chem. 269 (15): 11201 –7. doi:10.1016/S0021-9258(19)78111-3. PMID 8157649.
- ^ Blagg, Brian S. J.; Jarstfer, Michael B.; Rogers, Daniel H.; Poulter, C. Dale (2002-07-04). "Recombinant Squalene Synthase. Mecanismo para el Rearreglo de Difosfato Presqualene a Escualeno". Journal of the American Chemical Society. 124 (30): 8846 –8853. doi:10.1021/ja020411a. PMID 12137537.
- ^ Jarstfer, Michael B.; Blagg, Brian S. J.; Rogers, Daniel H.; Poulter, C. Dale (1996-12-25). "Biosíntesis de escualeno. Evidencia para un Intermediato Cationic Ciclopropilarbinil Tertiary en el Rearrangement of Presqualene Diphosphate to Squalene". Journal of the American Chemical Society. 118 (51): 13089–13090. doi:10.1021/ja963308s.
- ^ Brown, Michael S.; Goldstein, Joseph L. (1980). "Multivalent feedback regulation of HMG CoA reductase, un mecanismo de control que coordina la síntesis isoprenoide y el crecimiento celular". J. Lipid Res. 21 5): 505 –517. doi:10.1016/S0022-2275(20)42221-7. PMID 6995544.
- ^ Olson, Robert E. (1967-01-01). Robert S. Harris; Ira G. Wool; John A. Loraine; G. F. Marrian; Kenneth V. Thimann (eds.). "Biosíntesis de Ubiquinones en Animales*". Vitaminas y hormonas. 24: 551 –574. doi:10.1016/s0083-6729(08)60221-6. ISBN 9780127098241. PMID 5340877.
- ^ Gough, Doreen P.; Hemming, F. W. (1970-06-01). "La caracterización y estereoquímica de la biosíntesis de los dólicos en el hígado de rata". Biochemical Journal. 118 1): 163–166. doi:10.1042/bj1180163. ISSN 0264-6021. PMC 1179092. PMID 4319540.
- ^ a b Faust, Jerry R.; Goldstein, Joseph L.; Brown, Michael S. (1979-01-01). "Sintesis de ubiquinona y colesterol en fibroblastos humanos: Regulación de una vía ramificada". Archivos de Bioquímica y Biofísica. 192 1): 86 –99. doi:10.1016/0003-9861(79)90074-2. PMID 219777.
- ^ Faust, Jerry R.; Goldstein, Joseph L.; Brown, Michael S. (1979-10-01). "Actividad sintetosa de escualeno en fibroblastos humanos: Regulación a través del receptor de lipoproteína de baja densidad". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 76 (10): 5018 –5022. Bibcode:1979PNAS...76.5018F. doi:10.1073/pnas.76.10.5018. ISSN 0027-8424. PMC 413070. PMID 228272.
- ^ Guan, G.; Jiang, G.; Koch, R. L.; Shechter, I. (1995-09-15). "La clonación molecular y el análisis funcional del promotor del gen de la sinthasa de escualeno humano". El Diario de Química Biológica. 270 (37): 21958–21965. doi:10.1074/jbc.270.37.21958. ISSN 0021-9258. PMID 7665618.
- ^ Guan, Guimin; Dai, Pei-Hua; Osborne, Timothy F.; Kim, Jae B.; Shechter, Ishaiahu (1997-04-11). "Multiple Sequence Elements are Involved in the Transcripciónal Regulation of the Human Squalene Synthase Gene". Journal of Biological Chemistry. 272 (15): 10295 –10302. doi:10.1074/jbc.272.15.10295. ISSN 0021-9258. PMID 9092581.
- ^ Guan, G.; Dai, P.; Shechter, I. (1998-05-15). "Regulación transcripcional diferencial del gen de sinthase de escuale humano mediante proteínas reguladoras de elementos esteroles (SREBP) 1a y 2 e implicación de elementos de secuencia de ADN de 5' en la regulación". El Diario de Química Biológica. 273 (20): 12526–12535. doi:10.1074/jbc.273.20.12526. ISSN 0021-9258. PMID 9575211.
- ^ a b Kourounakis AP, Katselou MG, Matralis AN, Ladopoulou EM, Bavavea E (2011). "Inhibidores de la sintasis de la escualena: Una actualización sobre la búsqueda de nuevos agentes antihiperlipímicos y antiaeroscleróticos". Curr. Med. Chem. 18 (29): 4418 –39. doi:10.2174/092986711797287557. PMID 21864285.
- ^ Paradise EM, Kirby J, Chan R, Keasling JD (junio de 2008). "Redirección del flujo a través del punto de la rama FPP en Saccharomyces cerevisiae por la sintetiza de escualeno regulable". Biotechnol. Bioeng. 100 2): 371–8. doi:10.1002/bit.21766. PMID 18175359. S2CID 23878922.
- ^ a b Okazaki H, Tazoe F, Okazaki S, Isoo N, Tsukamoto K, Sekiya M, Yahagi N, Iizuka Y, Ohashi K, Kitamine T, Tozawa R, Inaba T, Yagyu H, Okazaki M, Shimano H, Shibata N, Arai H, Nagai RZ, Kadowaki T, Osuga Jshi "Increased colesterol biosynthesis and hypercholesterolemia in ratones overexpressing squalene synthase in the liver". J. Lipid Res. 47 (9): 1950–8. doi:10.1194/jlr.M600224-JLR200. PMID 16741291.
- ^ Davidson MH (enero de 2007). "Inhibición de la sintesis de la escualena: un nuevo objetivo para la gestión de la dislipidemia". Curr Atheroscler Rep. 9 1): 78 –80. doi:10.1007/BF02693932. PMID 17169251. S2CID 28176904.
- ^ Do R, Kiss RS, Gaudet D, Engert JC (enero de 2009). "Sintase de escualeno: una enzima crítica en la vía de biosíntesis de colesterol". Clin.. 75 1): 19 –29. doi:10.1111/j.1399-0004.2008.01099.x. PMID 19054015. S2CID 205406994.
- ^ Hiyoshi H, Yanagimachi M, Ito M, Saeki T, Yoshida I, Okada T, Ikuta H, Shinmyo D, Tanaka K, Kurusu N, Tanaka H (noviembre de 2001). "Los inhibidores de la sintesis de la escualena reducen la triglicérida plasmática a través de un mecanismo independiente de lipoproteína de baja densidad". Eur. J. Pharmacol. 431 3): 345 –52. doi:10.1016/S0014-2999(01)01450-9. PMID 11730728.
- ^ Seiki S, Frishman WH (2009). "Inhibición neurálgica de la sintesis de escualeno y otras enzimas aguas abajo de la vía de síntesis del colesterol: un nuevo enfoque terapéutico para el tratamiento de la hipercolesterolemia". Cardiol Rev. 17 2): 70–6. doi:10.1097/CRD.0b013e3181885905. PMID 19367148. S2CID 33130333.
- ^ Charlton-Menys V, Durrington PN (2007). "Inhibidores de la sintesis de la escualena: farmacología clínica y potencial de reducción del colesterol". Drogas. 67 1): 11–6. doi:10.2165/00003495-200767010-00002. PMID 17209661. S2CID 45715717.
- ^ Amin D, Rutledge RZ, Needle SN, Galczenski HF, Neuenschwander K, Scotese AC, Maguire MP, Bush RC, Hele DJ, Bilder GE, Perrone MH (mayo de 1997). "RPR 107393, un potente inhibidor de la sinthasa de escualene y agente de reducción de colesterol eficaz oralmente: comparación con inhibidores de la reductasa HMG-CoA". J. Pharmacol. Exp. Ther. 281 2): 746 –52. PMID 9152381.
- ^ Gibbs, Edwina (29 de octubre de 2007). "UPDATE 2-US FDA le dice a Takeda que detenga algunos ensayos TAK-475". Reuters. Retrieved 5 de marzo 2013.
- ^ "Descontinuación del desarrollo de TAK-475, Compound for Treatment of Hypercholesterolemia". Takeda Pharmaceutical Company Limited. 28 marzo 2008. Retrieved 5 de marzo 2013.
- ^ Liu CI, Liu GY, Song Y, Yin F, Hensler ME, Jeng WY, Nizet V, Wang AH, Oldfield E (marzo de 2008). "Un inhibidor de la biosíntesis de colesterol bloquea la virulencia Staphylococcus aureus" (PDF). Ciencia. 319 (5868): 1391–4. Bibcode:2008Sci...319.1391L. doi:10.1126/science.1153018. PMC 2747771. PMID 18276850.
Enlaces externos
- Farnesyl-Diphosphate+Farnesyltransferase en la Biblioteca Nacional de Medicina de los EE.UU.