Fagosoma
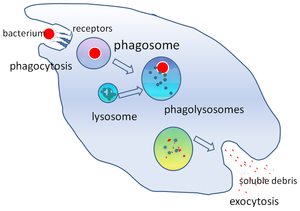
En biología celular, un fagosoma es una vesícula formada alrededor de una partícula engullida por un fagocito mediante fagocitosis. Los fagocitos profesionales incluyen macrófagos, neutrófilos y células dendríticas (DC).
Un fagosoma se forma por la fusión de la membrana celular alrededor de un microorganismo, una célula senescente o una célula apoptótica. Los fagosomas tienen proteínas unidas a membranas para reclutar y fusionar con lisosomas para formar fagolisosomas maduros. Los lisosomas contienen enzimas hidrolíticas y especies reactivas de oxígeno (ROS) que matan y digieren los patógenos. Los fagosomas también se pueden formar en fagocitos no profesionales, pero solo pueden fagocitar una gama más pequeña de partículas y no contienen ROS. Los materiales útiles (por ejemplo, aminoácidos) de las partículas digeridas se trasladan al citosol y los desechos se eliminan mediante exocitosis. La formación de fagosomas es crucial para la homeostasis de los tejidos y la defensa tanto innata como adaptativa del huésped contra los patógenos.
Sin embargo, algunas bacterias pueden aprovechar la fagocitosis como estrategia de invasión. Se reproducen dentro del fagolisosoma (p. ej., Coxiella spp.) o escapan al citoplasma antes de que el fagosoma se fusione con el lisosoma (p. ej., Rickettsia spp. .). Muchas micobacterias, incluidas Mycobacterium tuberculosis y Mycobacterium avium paratuberculosis, pueden manipular los macrófagos del huésped para evitar que los lisosomas se fusionen con los fagosomas y creen fagolisosomas maduros. Esta maduración incompleta del fagosoma mantiene un ambiente favorable para los patógenos en su interior.
Formación
Los fagosomas son lo suficientemente grandes como para degradar bacterias enteras o células apoptóticas y senescentes, que suelen tener >0,5 μm de diámetro. Esto significa que un fagosoma es varios órdenes de magnitud más grande que un endosoma, que se mide en nanómetros.
Los fagosomas se forman cuando patógenos u opsoninas se unen a un receptor transmembrana, que se distribuye aleatoriamente en la superficie de las células fagocitarias. Al encuadernar, "de afuera hacia adentro" la señalización desencadena la polimerización de actina y la formación de pseudópodos, que rodean y se fusionan detrás del microorganismo. La proteína quinasa C, la fosfoinositida 3-quinasa y la fosfolipasa C (PLC) son necesarias para señalar y controlar la internalización de partículas. Más receptores de la superficie celular pueden unirse a la partícula en un mecanismo similar a una cremallera a medida que el patógeno está rodeado, lo que aumenta la avidez de unión. El receptor Fc (FcR), los receptores del complemento (CR), el receptor de manosa y la dectina-1 son receptores fagocíticos, lo que significa que pueden inducir fagocitosis si se expresan en células no fagocíticas como los fibroblastos. Otras proteínas, como los receptores tipo Toll, participan en el reconocimiento de patrones de patógenos y, a menudo, se reclutan en los fagosomas, pero no desencadenan específicamente la fagocitosis en células no fagocíticas, por lo que no se consideran receptores fagocíticos.
Opsonisation
Las opsoninas son etiquetas moleculares, como anticuerpos y complementos, que se adhieren a patógenos y regulan positivamente la fagocitosis. La inmunoglobulina G (IgG) es el principal tipo de anticuerpo presente en el suero. Es parte del sistema inmunológico adaptativo, pero se vincula a la respuesta innata mediante el reclutamiento de macrófagos para fagocitar patógenos. El anticuerpo se une a microbios con el dominio Fab variable y el dominio Fc se une a los receptores Fc (FcR) para inducir la fagocitosis.
La internalización mediada por el complemento tiene protuberancias de membrana mucho menos significativas, pero la señalización descendente de ambas vías converge para activar las Rho GTPasas. Controlan la polimerización de actina, necesaria para que el fagosoma se fusione con endosomas y lisosomas.
Células no fagocíticas
Otros fagocitos no profesionales tienen cierto grado de actividad fagocítica, como las células epiteliales de la tiroides y la vejiga que pueden fagocitar eritrocitos y células epiteliales de la retina que internalizan los bastones de la retina. Sin embargo, los fagocitos no profesionales no expresan receptores fagocíticos específicos como el FcR y tienen una tasa de internalización mucho menor.
Algunas bacterias invasoras también pueden inducir la fagocitosis en células no fagocíticas para mediar la absorción del huésped. Por ejemplo, Shigella puede secretar toxinas que alteran el citoesqueleto del huésped y entran en el lado basolateral de los enterocitos.
Estructura
Como la membrana del fagosoma se forma mediante la fusión de la membrana plasmática, la composición básica de la bicapa de fosfolípidos es la misma. Luego, los endosomas y lisosomas se fusionan con el fagosoma para contribuir a la membrana, especialmente cuando la partícula envuelta es muy grande, como un parásito. También entregan varias proteínas de membrana al fagosoma y modifican la estructura del orgánulo.
Los fágonos pueden engulf cuentas de látex artificial de baja densidad y luego purificados a lo largo de un gradiente de concentración de sucrosa, permitiendo que la estructura y la composición sean estudiados. Al purificar los fagomas en diferentes puntos de tiempo, el proceso de maduración también se puede caracterizar. Los primeros fágonos son caracterizados por Rab5, que la transición a Rab7 mientras la vesícula madura en fágonos tardíos.
Proceso de maduración
El fagosoma naciente no es inherentemente bactericida. A medida que madura, se vuelve más ácido desde un pH de 6,5 a un pH de 4 y adquiere marcadores proteicos característicos y enzimas hidrolíticas. Las diferentes enzimas funcionan a distintos pH óptimos, formando un rango para que cada una trabaje en etapas estrechas del proceso de maduración. La actividad enzimática se puede ajustar modificando el nivel de pH, lo que permite una mayor flexibilidad. El fagosoma se mueve a lo largo de los microtúbulos del citoesqueleto, fusionándose con endosomas y lisosomas secuencialmente en un movimiento dinámico de "besar y correr". manera. Este transporte intracelular depende del tamaño de los fagosomas. Los orgánulos más grandes (con un diámetro de aproximadamente 3 μm) se transportan de manera muy persistente desde la periferia celular hacia la región perinuclear, mientras que los orgánulos más pequeños (con un diámetro de aproximadamente 1 μm) se transportan de manera más bidireccional hacia adelante y hacia atrás entre el centro celular y la periferia celular. Las bombas de protones vacuolares (v-ATPasa) se envían al fagosoma para acidificar el compartimento del orgánulo, creando un ambiente más hostil para los patógenos y facilitando la degradación de proteínas. Las proteínas bacterianas se desnaturalizan a pH bajo y se vuelven más accesibles a las proteasas, que no se ven afectadas por el ambiente ácido. Posteriormente, las enzimas se reciclan del fagolisosoma antes de la egestión para que no se desperdicien. La composición de la membrana de fosfolípidos también cambia a medida que madura el fagosoma.
La fusión puede tardar de minutos a horas dependiendo del contenido del fagosoma; La fusión mediada por FcR o receptor de manosa dura menos de 30 minutos, pero los fagosomas que contienen perlas de látex pueden tardar varias horas en fusionarse con los lisosomas. Se sugiere que la composición de la membrana del fagosoma afecta la tasa de maduración. Mycobacterium tuberculosis tiene una pared celular muy hidrófoba, lo que se supone que previene el reciclaje de la membrana y el reclutamiento de factores de fusión, por lo que el fagosoma no se fusiona con los lisosomas y la bacteria evita la degradación.
Las moléculas luminales más pequeñas se transfieren por fusión más rápidamente que las moléculas más grandes, lo que sugiere que se forma un pequeño canal acuoso entre el fagosoma y otras vesículas durante el proceso de "besar y correr", a través del cual sólo se permite un intercambio limitado. .
Regulación de fusión
Poco después de la internalización, la actina F se despolimeriza del fagosoma recién formado, por lo que se vuelve accesible a los endosomas para la fusión y la entrega de proteínas. El proceso de maduración se divide en etapas tempranas y tardías dependiendo de marcadores proteicos característicos, regulados por pequeñas Rab GTPasas. Rab5 está presente en los fagosomas tempranos y controla la transición a los fagosomas tardíos marcados por Rab7.
Rab5 recluta la quinasa PI-3 y otras proteínas de unión, como Vps34, a la membrana del fagosoma, para que los endosomas puedan entregar proteínas al fagosoma. Rab5 participa parcialmente en la transición a Rab7, a través del complejo CORVET y el complejo LÚPULO en la levadura. La vía de maduración exacta en los mamíferos no se comprende bien, pero se sugiere que el lúpulo puede unirse a Rab7 y desplazar al inhibidor de la disociación de nucleótidos de guanosina (GDI). Rab11 participa en el reciclaje de membranas.
Fagolisosoma
El fagosoma se fusiona con los lisosomas para formar un fagolisosoma, que tiene varias propiedades bactericidas. El fagolisosoma contiene especies reactivas de oxígeno y nitrógeno (ROS y RNS) y enzimas hidrolíticas. El compartimento también es ácido debido a las bombas de protones (v-ATPasas) que transportan H+ a través de la membrana, utilizadas para desnaturalizar las proteínas bacterianas.
Las propiedades exactas de los fagolisosomas varían según el tipo de fagocito. Los de las células dendríticas tienen propiedades bactericidas más débiles que los de los macrófagos y neutrófilos. Además, los macrófagos se dividen en proinflamatorios "asesinos" M1 y "reparación" M2. Los fagolisosomas de M1 pueden metabolizar la arginina en óxido nítrico altamente reactivo, mientras que los M2 usan arginina para producir ornitina para promover la proliferación celular y la reparación de tejidos.
Función
Degradación de patógenos
Los macrófagos y neutrófilos son fagocitos profesionales encargados de la mayor parte de la degradación del patógeno, pero tienen diferentes métodos bactericidas. Los neutrófilos tienen gránulos que se fusionan con el fagosoma. Los gránulos contienen NADPH oxidasa y mieloperoxidasa, que producen oxígeno tóxico y derivados de cloro para matar patógenos en un estallido oxidativo. También se liberan proteasas y péptidos antimicrobianos en el fagolisosoma. Los macrófagos carecen de gránulos y dependen más de la acidificación del fagolisosoma, las glicosidasas y las proteasas para digerir los microbios. Los fagosomas de las células dendríticas son menos ácidos y tienen una actividad hidrolítica mucho más débil, debido a una menor concentración de proteasas lisosomales e incluso a la presencia de inhibidores de proteasas.
Inflamación
La formación de fagosomas está ligada a la inflamación a través de moléculas de señalización comunes. La PI-3 quinasa y la PLC participan tanto en el mecanismo de internalización como en el desencadenamiento de la inflamación. Las dos proteínas, junto con las Rho GTPasas, son componentes importantes de la respuesta inmune innata, ya que inducen la producción de citocinas y activan la cascada de señalización de la MAP quinasa. Se producen citoquinas proinflamatorias que incluyen IL-1β, IL-6, TNFα e IL-12.
El proceso está estrechamente regulado y la respuesta inflamatoria varía según el tipo de partícula dentro del fagosoma. Las células apoptóticas infectadas con patógenos desencadenarán inflamación, pero las células dañadas que se degradan como parte del recambio normal del tejido no lo hacen. La respuesta también difiere según la fagocitosis mediada por opsonina. Las reacciones mediadas por FcR y receptores de manosa producen especies reactivas de oxígeno proinflamatorias y moléculas de ácido araquidónico, pero las reacciones mediadas por CR no dan como resultado esos productos.
Presentación de antígeno
Las células dendríticas (CD) inmaduras pueden fagocitar, pero las CD maduras no pueden hacerlo debido a cambios en las Rho GTPasas involucradas en la remodelación del citoesqueleto. Los fagosomas de las CD son menos hidrolíticos y ácidos que los de los macrófagos y neutrófilos, ya que las CD participan principalmente en la presentación de antígenos más que en la degradación de patógenos. Necesitan retener fragmentos de proteínas de un tamaño adecuado para el reconocimiento bacteriano específico, por lo que los péptidos sólo se degradan parcialmente. Los péptidos de las bacterias se transportan al Complejo Mayor de Histocompatibilidad (MHC). Los antígenos peptídicos se presentan a los linfocitos, donde se unen a los receptores de las células T y activan las células T, cerrando la brecha entre la inmunidad innata y adaptativa. Esto es específico de mamíferos, aves y peces con mandíbulas, ya que los insectos no tienen inmunidad adaptativa.

Nutriente
Los organismos unicelulares antiguos, como la ameba, utilizan la fagocitosis como una forma de adquirir nutrientes, en lugar de una estrategia inmune. Engullen a otros microbios más pequeños y los digieren dentro del fagosoma a aproximadamente una bacteria por minuto, mucho más rápido que los fagocitos profesionales. Para la ameba del suelo Dictyostelium discoideum, su principal fuente de alimento es la bacteria Legionella pneumophila, que causa la enfermedad del legionario en humanos. La maduración de los fagosomas en las amebas es muy similar a la de los macrófagos, por lo que se utilizan como organismo modelo para estudiar el proceso.
Aclaramiento de tejido
Los fagosomas degradan las células senescentes y las células apoptóticas para mantener la homeostasis del tejido. Los eritrocitos tienen una de las tasas de renovación más altas del cuerpo y son fagocitados por macrófagos en el hígado y el bazo. En el embrión, el proceso de eliminación de células muertas no está bien caracterizado, pero no lo realizan macrófagos u otras células derivadas de células madre hematopoyéticas. Sólo en el adulto las células apoptóticas son fagocitadas por fagocitos profesionales. La inflamación solo se desencadena por ciertos patrones moleculares asociados a patógenos o daños (PAMP o DAMP), la eliminación de células senescentes no es inflamatoria.
Autofagosoma
Los autofagosomas se diferencian de los fagosomas en que se utilizan principalmente para degradar selectivamente orgánulos citosólicos dañados, como las mitocondrias (mitofagia). Sin embargo, cuando la célula sufre hambre o estrés, los autofagosomas también pueden degradar orgánulos de forma no selectiva para proporcionar a la célula aminoácidos y otros nutrientes. La autofagia no se limita a los fagocitos profesionales: el biólogo celular Christian de Duve la descubrió por primera vez en hepatocitos de rata. Los autofagosomas tienen una membrana doble, la interna del orgánulo engullido, y se especula que la membrana externa se forma a partir del retículo endoplásmico o el compartimento intermedio ER-Golgi (ERGIC). El autofagosoma también se fusiona con los lisosomas para degradar su contenido. Cuando M. tuberculosis inhibe la acidificación del fagosoma, el interferón gamma puede inducir la autofagia y rescatar el proceso de maduración.
Evasión y manipulación bacteriana
Muchas bacterias han evolucionado para evadir las propiedades bactericidas de los fagosomas o incluso explotar la fagocitosis como estrategia de invasión.
- Mycobacterium tuberculosis meta macrófagos M2 en las partes inferiores de la vía respiratoria, que no producen ROS. M. tuberculosis también puede manipular las vías de señalización mediante la detección de fosfatasas como PtpA y SapM, que interrumpen el reclutamiento de proteínas y bloquean la acidificación de fágonos.
- Legionella pneumophila puede re-modelar la membrana de la fagosa para imitar vesículas en otras partes de la vía secretor, por lo que los lisosomas no reconocen el fagosome y no se fusionan con él. La bacteria secreta toxinas que interfieren con el tráfico de anfitriones, así que Legionella- que contiene vacuola recluta proteínas de membrana generalmente encontradas en el reticulum endoplasmático o el ERGIC. Esto redirige vesículas secretarias al fagotismo modificado y proporciona nutrientes a la bacteria.
- Listeria monocytogenes secreta una proteína que forma poro listeriolysin O para que la bacteria pueda escapar del fagosome en el citosol. Listeriolysin es activado por el ambiente ácido del fego. Además, Listeria dos fosfolipasa Enzimas C que facilitan el escape de la fágosis.