Factor de necrosis tumoral
Factor de necrosis tumoral (TNF, caquexina o caquectina; anteriormente conocido como necrosis tumoral factor alfa o TNF-α) es una adipoquina y una citoquina. TNF es un miembro de la superfamilia TNF, que consta de varias proteínas transmembrana con un dominio TNF homólogo.
Como adipoquina, el TNF promueve la resistencia a la insulina y está asociado con la diabetes tipo 2 inducida por la obesidad. Como citocina, el sistema inmunitario utiliza el TNF para la señalización celular. Si los macrófagos (ciertos glóbulos blancos) detectan una infección, liberan TNF para alertar a otras células del sistema inmunitario como parte de una respuesta inflamatoria.
La señalización de TNF se produce a través de dos receptores: TNFR1 y TNFR2. TNFR1 se expresa de manera constitutiva en la mayoría de los tipos de células, mientras que TNFR2 se restringe principalmente a endoteliales, epiteliales y subconjuntos de células inmunitarias. La señalización de TNFR1 tiende a ser proinflamatoria y apoptótica, mientras que la señalización de TNFR2 es antiinflamatoria y promueve la proliferación celular. La supresión de la señalización de TNFR1 ha sido importante para el tratamiento de enfermedades autoinmunes, mientras que la señalización de TNFR2 promueve la cicatrización de heridas.
TNF-α existe en forma transmembrana (mTNF-α) y en forma soluble (sTNF-α). El sTNF-α resulta de la escisión enzimática de mTNF-α, mediante un proceso denominado presentación de sustrato. El mTNF-α se encuentra principalmente en monocitos/macrófagos donde interactúa con los receptores tisulares por contacto de célula a célula. sTNF-α se une selectivamente a TNFR1, mientras que mTNF-α se une tanto a TNFR1 como a TNFR2. La unión de TNF-α a TNFR1 es irreversible, mientras que la unión a TNFR2 es reversible.
La función principal del TNF es la regulación de las células inmunitarias. El TNF, como pirógeno endógeno, es capaz de inducir fiebre, muerte celular apoptótica, caquexia e inflamación, inhibir la tumorigénesis y la replicación viral, y responder a la sepsis a través de células productoras de IL-1 e IL-6. La desregulación de la producción de TNF se ha implicado en una variedad de enfermedades humanas, incluida la enfermedad de Alzheimer, el cáncer, la depresión mayor, la psoriasis y la enfermedad inflamatoria intestinal (EII). Aunque controvertido, algunos estudios han relacionado la depresión y la EII con niveles elevados de TNF.
Bajo el nombre de tasonermina, el TNF se utiliza como fármaco inmunoestimulante en el tratamiento de determinados tipos de cáncer. Los fármacos que contrarrestan la acción del TNF se utilizan en el tratamiento de diversas enfermedades inflamatorias, por ejemplo, la artritis reumatoide.
Ciertos tipos de cáncer pueden causar una producción excesiva de TNF. El TNF es paralelo a la hormona paratiroidea tanto en causar hipercalcemia secundaria como en los cánceres con los que se asocia una producción excesiva.
Descubrimiento
La teoría de una respuesta antitumoral del sistema inmunitario in vivo fue reconocida por el médico William B. Coley. En 1968, Gale A Granger de la Universidad de California, Irvine, informó sobre un factor citotóxico producido por los linfocitos y lo denominó linfotoxina (LT). El crédito por este descubrimiento lo comparte Nancy H. Ruddle de la Universidad de Yale, quien informó sobre la misma actividad en una serie de artículos consecutivos publicados el mismo mes. Posteriormente, en 1975, Lloyd J. Old del Memorial Sloan-Kettering Cancer Center, Nueva York, informó sobre otro factor citotóxico producido por los macrófagos y lo denominó factor de necrosis tumoral (TNF). Ambos factores se describieron en función de su capacidad para matar células L-929 de fibrosarcoma de ratón. Estos conceptos se extendieron a la enfermedad sistémica en 1981, cuando Ian A. Clark, de la Universidad Nacional de Australia, en colaboración con Elizabeth Carswell en el grupo de Old, trabajando con datos de la era previa a la secuenciación, razonaron que la producción excesiva de TNF causa paludismo y envenenamiento por endotoxinas.
Los ADNc que codifican LT y TNF se clonaron en 1984 y se reveló que eran similares. La unión de TNF a su receptor y su desplazamiento por LT confirmaron la homología funcional entre los dos factores. La homología secuencial y funcional de TNF y LT condujo al cambio de nombre de TNF como TNFα y LT como TNFβ. En 1985, Bruce A. Beutler y Anthony Cerami descubrieron que la caquectina (una hormona que induce la caquexia) era en realidad TNF. Luego identificaron al TNF como un mediador del envenenamiento por endotoxinas letales. Kevin J. Tracey y Cerami descubrieron el papel mediador clave del TNF en el shock séptico letal e identificaron los efectos terapéuticos de los anticuerpos monoclonales anti-TNF.
La investigación en el laboratorio de Mark Mattson ha demostrado que el TNF puede prevenir la muerte/apoptosis de las neuronas mediante un mecanismo que involucra la activación del factor de transcripción NF-κB que induce la expresión de enzimas antioxidantes y Bcl-2.
Gen
El gen TNF humano fue clonado en 1985. Se asigna al cromosoma 6p21.3, abarca unas 3 kilobases y contiene 4 exones. El último exón comparte similitud con la linfotoxina alfa (LTA, una vez denominada TNF-β). Las tres regiones principales no traducidas (3'-UTR) de TNF contienen un elemento rico en AU (ARE).
Estructura
TNF se produce principalmente como una proteína transmembrana tipo II de 233 aminoácidos de longitud dispuesta en homotrímeros estables. A partir de esta forma integrada en la membrana, la citoquina homotrimérica soluble (sTNF) se libera a través de la escisión proteolítica por la enzima convertidora de metaloproteasa TNF alfa (TACE, también llamada ADAM17). El sTNF trimérico de 51 kDa soluble tiende a disociarse en concentraciones por debajo del rango nanomolar, perdiendo así su bioactividad. La forma secretada de TNF humano adquiere una forma de pirámide triangular y pesa alrededor de 17 kDa. Tanto la forma secretada como la unida a la membrana son biológicamente activas, aunque las funciones específicas de cada una son controvertidas. Pero, ambas formas tienen actividades biológicas superpuestas y distintas.
El TNF común de ratón doméstico y el TNF humano son estructuralmente diferentes. Los protómeros de TNF de 17 kilodalton (kDa) (de 185 aminoácidos de longitud) están compuestos por dos láminas plegadas β antiparalelas con hebras β antiparalelas, que forman un 'rollo de gelatina' Estructura β, típica de la familia TNF, pero que también se encuentra en las proteínas de la cápside viral.
Señalización celular
TNF puede unirse a dos receptores, TNFR1 (receptor de TNF tipo 1; CD120a; p55/60) y TNFR2 (receptor de TNF tipo 2; CD120b; p75/80). TNFR1 es de 55 kDa y TNFR2 es de 75 kDa. El TNFR1 se expresa en la mayoría de los tejidos y puede activarse por completo mediante las formas triméricas solubles y unidas a la membrana de TNF, mientras que el TNFR2 se encuentra normalmente en las células del sistema inmunitario y responde a la forma unida a la membrana del homotrímero de TNF. Como la mayor parte de la información sobre la señalización de TNF se deriva de TNFR1, es probable que se subestime el papel de TNFR2. Al menos en parte porque TNFR2 no tiene un dominio de muerte intracelular, muestra propiedades neuroprotectoras.
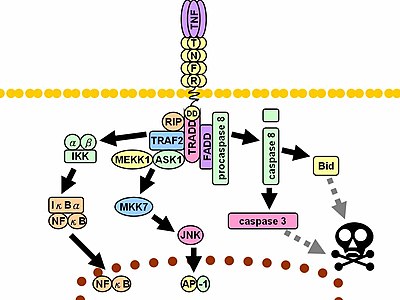
Al entrar en contacto con su ligando, los receptores de TNF también forman trímeros y sus puntas encajan en los surcos formados entre los monómeros de TNF. Esta unión hace que se produzca un cambio conformacional en el receptor, lo que conduce a la disociación de la proteína inhibidora SODD del dominio de muerte intracelular. Esta disociación permite que la proteína adaptadora TRADD se una al dominio de muerte, sirviendo como plataforma para la posterior unión a proteínas. Después de la unión de TRADD, se pueden iniciar tres vías.
- Activación de NF-κB: TRADD recluta TRAF2 y RIP. TRAF2 a su vez recluta la proteína multicomponente Kinase IKK, lo que permite que el serine-threonine kinase RIP lo active. Una proteína inhibidora, IκBα, que normalmente se une a NF-κB e inhibe su translocación, es fosforilada por IKK y posteriormente degradada, liberando NF-κB. NF-κB es un factor de transcripción heterodimérica que transloca al núcleo y media la transcripción de una amplia gama de proteínas implicadas en la supervivencia celular y proliferación inflamatoria.
- Activación de las vías MAPK: De las tres principales cascadas de MAPK, TNF induce una fuerte activación del grupo JNK relacionado con el estrés, evoca una respuesta moderada del p38-MAPK, y es responsable de la activación mínima de los ERKs clásicos. TRAF2/Rac activa las cinasas que inducen JNK de MLK2/MLK3, TAK1, MEKK1 y ASK1 (ya sea directamente o a través de GCKs y Trx, respectivamente). SRC- Vav- El eje Rac activa MLK2/MLK3 y estas cinasas fosforilato MKK7, que luego activa JNK. JNK transloca al núcleo y activa factores de transcripción como c-Jun y ATF2. La vía JNK está involucrada en la diferenciación celular, la proliferación, y es generalmente pro-apoptótica.
- Inducción de la señalización de la muerte: Al igual que todos los miembros de la superfamilia TNFR que contienen restos mortales, TNFR1 está involucrado en la señalización de muerte. Sin embargo, la muerte celular inducida por TNF sólo juega un papel menor en comparación con sus funciones abrumadoras en el proceso inflamatorio. Su capacidad de inducción de la muerte es débil en comparación con otros miembros de la familia (como Fas), y a menudo enmascarado por los efectos antiapoptóticos de NF-κB. Sin embargo, TRADD une FADD, que luego recluta la cisteína proteasa caspase-8. Una alta concentración de caspase-8 induce su activación autoproteolítica y posterior liberación de caspas de efector, que conduce a la apoptosis celular.
La miríada de efectos, a menudo contradictorios, mediados por las vías anteriores indican la existencia de una gran interferencia. Por ejemplo, NF-κB mejora la transcripción de C-FLIP, Bcl-2 y cIAP1/cIAP2, proteínas inhibidoras que interfieren con la señalización de muerte. Por otro lado, las caspasas activadas escinden varios componentes de la vía NF-κB, incluidos RIP, IKK y las subunidades del propio NF-κB. Otros factores, como el tipo de célula, la estimulación concurrente de otras citoquinas o la cantidad de especies reactivas de oxígeno (ROS) pueden cambiar el equilibrio a favor de una vía u otra. Una señalización tan complicada asegura que, cada vez que se libera TNF, varias células con funciones y condiciones muy diversas pueden responder adecuadamente a la inflamación. Ambas moléculas de proteína factor de necrosis tumoral alfa y queratina 17 parecen estar relacionado en caso de fibrosis submucosa oral
En modelos animales, el TNF elimina selectivamente las células T autorreactivas.
También hay pruebas de que la señalización de TNF-α desencadena modificaciones epigenéticas aguas abajo que dan como resultado una mejora duradera de las respuestas proinflamatorias en las células.
Regulación enzimática
Esta proteína puede usar el modelo de morfeína de regulación alostérica.
Importancia clínica
Se pensaba que el TNF lo producían principalmente los macrófagos, pero también lo produce una amplia variedad de tipos de células, incluidas las células linfoides, los mastocitos, las células endoteliales, los miocitos cardíacos, el tejido adiposo, los fibroblastos y las neuronas. Se liberan grandes cantidades de TNF en respuesta a lipopolisacáridos, otros productos bacterianos e interleucina-1 (IL-1). En la piel, los mastocitos parecen ser la fuente predominante de TNF preformado, que puede liberarse ante un estímulo inflamatorio (p. ej., LPS).
Tiene una serie de acciones sobre varios sistemas de órganos, generalmente junto con la IL-1 y la interleucina-6 (IL-6):
- En el hipotálamo:
- Estimulación del eje hipotalámico-pituitario-adrenal estimulando la liberación de la hormona liberadora de corticotropina (CRH)
- Comportamiento del apetito
- Fever
- En el hígado: estimulando la respuesta de fase aguda, dando lugar a un aumento en la proteína C reactiva y varios otros mediadores. También induce la resistencia a la insulina promoviendo la serina-fosforilación del sustrato del receptor de insulina-1 (IRS-1), lo que perjudica la señalización de insulina
- Es un potente químico para neutrófilos, y promueve la expresión de moléculas de adherencia en células endoteliales, ayudando a los neutrófilos a migrar.
- En macrófagos: estimula la fagocitosis, y la producción de oxidantes IL-1 y la prostaglandina lípido inflamatoria E2 (PGE2)
- En otros tejidos: aumento de la resistencia a la insulina. Fósforilatos de TNF residuos de serina receptor de insulina, bloqueando la transducción de señal.
- Sobre el metabolismo y la ingesta de alimentos: regula la percepción del sabor amargo.
Un aumento local en la concentración de TNF hará que se produzcan los signos cardinales de la inflamación: calor, hinchazón, enrojecimiento, dolor y pérdida de función.
Mientras que las altas concentraciones de TNF inducen síntomas similares a los de un shock, la exposición prolongada a bajas concentraciones de TNF puede provocar caquexia, un síndrome de desgaste. Esto se puede encontrar, por ejemplo, en pacientes con cáncer.
Said et al. mostró que el TNF causa una inhibición dependiente de IL-10 de la expansión y función de las células T CD4 mediante la regulación positiva de los niveles de PD-1 en los monocitos, lo que conduce a la producción de IL-10 por parte de los monocitos después de la unión de PD-1 con PD-L.
La investigación de Pedersen et al. indica que el aumento de TNF en respuesta a la sepsis es inhibido por la producción de mioquinas inducida por el ejercicio. Para estudiar si el ejercicio agudo induce una verdadera respuesta antiinflamatoria, se utilizó un modelo de 'inflamación de bajo grado' se estableció en el que se administró una dosis baja de endotoxina de E. coli a voluntarios sanos, que habían sido aleatorizados para descansar o hacer ejercicio antes de la administración de la endotoxina. En sujetos en reposo, la endotoxina indujo un aumento de 2 a 3 veces en los niveles circulantes de TNF. Por el contrario, cuando los sujetos realizaron 3 horas de ciclismo ergómetro y recibieron el bolo de endotoxina a las 2,5 h, la respuesta del TNF fue totalmente atenuada. Este estudio proporciona alguna evidencia de que el ejercicio agudo puede inhibir la producción de TNF.
En el cerebro, el TNF puede proteger contra la excitotoxicidad. TNF fortalece las sinapsis. El TNF en las neuronas promueve su supervivencia, mientras que el TNF en los macrófagos y la microglía produce neurotoxinas que inducen la apoptosis.
Las concentraciones de TNF-α e IL-6 están elevadas en la obesidad. El anticuerpo monoclonal contra TNF-α se asocia con aumentos en lugar de disminuciones en la obesidad, lo que indica que la inflamación es el resultado, más que la causa, de la obesidad. TNF e IL-6 son las citoquinas más prominentes que predicen la gravedad y la muerte de COVID-19.
Farmacología
TNF promueve la respuesta inflamatoria que, a su vez, causa muchos de los problemas clínicos asociados con los trastornos autoinmunitarios, como la artritis reumatoide, la espondilitis anquilosante, la enfermedad inflamatoria intestinal, la psoriasis, la hidradenitis supurativa y el asma refractaria. Estos trastornos a veces se tratan con un inhibidor de TNF. Esta inhibición se puede lograr con un anticuerpo monoclonal como infliximab (Remicade) que se une directamente al TNF, adalimumab (Humira), certolizumab pegol (Cimzia) o con una proteína de fusión del receptor circulante señuelo como etanercept (Enbrel) que se une al TNF con mayor afinidad que el TNFR.
Por otro lado, algunos pacientes tratados con inhibidores del TNF desarrollan un empeoramiento de su enfermedad o una nueva aparición de autoinmunidad. TNF parece tener también una faceta inmunosupresora. Una explicación para un posible mecanismo es esta observación de que el TNF tiene un efecto positivo sobre las células T reguladoras (Tregs), debido a su unión al receptor 2 del factor de necrosis tumoral (TNFR2).
La terapia anti-TNF ha mostrado solo efectos modestos en la terapia del cáncer. El tratamiento del carcinoma de células renales con infliximab resultó en una estabilización prolongada de la enfermedad en ciertos pacientes. Etanercept se probó para el tratamiento de pacientes con cáncer de mama y cáncer de ovario y mostró una estabilización prolongada de la enfermedad en ciertos pacientes a través de la regulación a la baja de IL-6 y CCL2. Por otro lado, la adición de infliximab o etanercept a la gemcitabina para el tratamiento de pacientes con cáncer de páncreas avanzado no se asoció con diferencias en la eficacia en comparación con el placebo.
Interacciones
Se ha demostrado que TNF interactúa con TNFRSF1A.
Nomenclatura
Debido a que LTα ya no se conoce como TNFβ, TNFα, como el símbolo del gen anterior, ahora se llama simplemente TNF, como se muestra en la base de datos HGNC (Comité de nomenclatura genética de HUGO).
Contenido relacionado
Ladan y Laleh Bijani
Úlcera bucal
Estatina