Extracción de fluidos supercríticos
La extracción con fluidos supercríticos (SFE) es el proceso de separar un componente (el extractante) de otro (la matriz) utilizando fluidos supercríticos como disolvente de extracción. La extracción suele realizarse a partir de una matriz sólida, pero también puede realizarse a partir de líquidos. SFE se puede utilizar como paso de preparación de muestras con fines analíticos o a mayor escala para extraer material no deseado de un producto (por ejemplo, descafeinado) o recolectar un producto deseado (por ejemplo, aceites esenciales). Estos aceites esenciales pueden incluir limoneno y otros disolventes puros. El dióxido de carbono (CO2) es el fluido supercrítico más utilizado, en ocasiones modificado por codisolventes como el etanol o el metanol. Las condiciones de extracción de dióxido de carbono supercrítico se encuentran por encima de la temperatura crítica de 31 °C y la presión crítica de 74 bar. La adición de modificadores puede alterar ligeramente esto. La discusión a continuación se referirá principalmente a la extracción con CO2, excepto donde se especifique.
Ventajas
Selectividad
Las propiedades del fluido supercrítico se pueden alterar variando la presión y la temperatura, permitiendo una extracción selectiva. Por ejemplo, los aceites volátiles se pueden extraer de una planta con bajas presiones (100 bar), mientras que la extracción líquida también eliminaría los lípidos. Los lípidos se pueden eliminar usando CO2 puro a presiones más altas, y luego los fosfolípidos se pueden eliminar agregando etanol al solvente. El mismo principio se puede utilizar para extraer polifenoles y ácidos grasos insaturados por separado de los residuos del vino.
Velocidad
La extracción es un proceso basado en difusión, en el que se requiere que el solvente se difunda dentro de la matriz y que el material extraído se difunda fuera de la matriz hacia el solvente. Las difusividades son mucho más rápidas en los fluidos supercríticos que en los líquidos y, por lo tanto, la extracción puede ocurrir más rápidamente. Además, debido a la falta de tensión superficial y viscosidades insignificantes en comparación con los líquidos, el disolvente puede penetrar más en la matriz inaccesible a los líquidos. Una extracción con un líquido orgánico puede tardar varias horas, mientras que la extracción con fluido supercrítico puede completarse en 10 a 60 minutos.
Limitaciones
El requisito de altas presiones aumenta el costo en comparación con la extracción líquida convencional, por lo que SFE solo se utilizará cuando existan ventajas significativas. El dióxido de carbono en sí no es polar y tiene un poder de disolución algo limitado, por lo que no siempre se puede utilizar como disolvente por sí solo, especialmente para solutos polares. El uso de modificadores aumenta la gama de materiales que se pueden extraer. A menudo se pueden utilizar modificadores de calidad alimentaria, como el etanol, que también pueden ayudar en la recogida del material extraído, pero reducen algunos de los beneficios del uso de un disolvente que es gaseoso a temperatura ambiente.
Procedimiento
El sistema debe contener una bomba para el CO2, una celda de presión para contener la muestra, un medio para mantener la presión en el sistema y un recipiente colector. El líquido se bombea a una zona de calentamiento, donde se calienta hasta condiciones supercríticas. Luego pasa al recipiente de extracción, donde se difunde rápidamente en la matriz sólida y disuelve el material a extraer. El material disuelto se barre desde la celda de extracción a un separador a menor presión y el material extraído se sedimenta. Luego, el CO2 puede enfriarse, recomprimirse y reciclarse, o descargarse a la atmósfera.

Bombas
El dióxido de carbono (CO2) generalmente se bombea en forma líquida, generalmente por debajo de los 5 °C (41 °F). ) y una presión de unos 50 bar. El disolvente se bombea como líquido, ya que entonces es casi incompresible; si se bombeara como fluido supercrítico, gran parte de la carrera de la bomba se “agotaría”; en comprimir el fluido, en lugar de bombearlo. Para extracciones a pequeña escala (hasta unos pocos gramos/minuto), se suelen utilizar bombas de CO2 o bombas de jeringa. Para extracciones a mayor escala, las bombas de diafragma son las más comunes. Los cabezales de la bomba generalmente requerirán enfriamiento y el CO2 también se enfriará antes de ingresar a la bomba.
Recipientes a presión
Los recipientes a presión pueden variar desde tubos simples hasta recipientes más sofisticados construidos específicamente con accesorios de liberación rápida. La presión requerida es de al menos 74 bar y la mayoría de las extracciones se realizan por debajo de 350 bar. Sin embargo, a veces se necesitarán presiones más altas, como en la extracción de aceites vegetales, donde a veces se requieren presiones de 800 bar para una miscibilidad completa de las dos fases.
El buque debe estar equipado con un medio de calefacción. Se puede colocar dentro de un horno para recipientes pequeños, o en una camisa calentada por aceite o eléctricamente para recipientes más grandes. Se debe tener cuidado si se utilizan sellos de caucho en el recipiente, ya que el dióxido de carbono supercrítico puede disolverse en el caucho, causando hinchazón y el caucho se romperá al despresurizarse.
Mantenimiento de presión
La presión en el sistema debe mantenerse desde la bomba hasta el recipiente de presión. En sistemas más pequeños (hasta aproximadamente 10 ml/min) se puede utilizar un restrictor simple. Puede ser un tubo capilar cortado a la medida o una válvula de aguja que se puede ajustar para mantener la presión a diferentes caudales. En sistemas más grandes se utilizará un regulador de contrapresión, que mantiene la presión aguas arriba del regulador mediante un resorte, aire comprimido o una válvula accionada electrónicamente. Sea cual sea el uso, es necesario suministrar calefacción, ya que la expansión adiabática del CO2 produce un enfriamiento significativo. Esto es problemático si hay agua u otro material extraído en la muestra, ya que puede congelarse en el restrictor o válvula y provocar obstrucciones.
Colección
El disolvente supercrítico se pasa a un recipiente a menor presión que el recipiente de extracción. La densidad, y por lo tanto el poder de disolución, de los fluidos supercríticos varía marcadamente con la presión y, por lo tanto, la solubilidad en el CO2 de menor densidad es mucho menor y el material precipita para su recolección. Es posible fraccionar el material disuelto utilizando una serie de recipientes a presión reducida. El CO2 puede reciclarse o despresurizarse a presión atmosférica y ventilarse. Para el SFE analítico, la presión generalmente se reduce a la atmosférica y el dióxido de carbono ahora gaseoso se burbujea a través de un solvente para atrapar los componentes precipitados.
Calefacción y refrigeración
Este es un aspecto importante. El fluido se enfría antes de bombear para mantener las condiciones del líquido y luego se calienta después de la presurización. A medida que el fluido se expande dentro del separador, se debe proporcionar calor para evitar un enfriamiento excesivo. Para extracciones a pequeña escala, como por ejemplo con fines analíticos, suele ser suficiente precalentar el fluido en un tramo de tubo dentro del horno que contiene la celda de extracción. El restrictor se puede calentar eléctricamente o incluso con un secador de pelo. Para sistemas más grandes, la energía requerida durante cada etapa del proceso se puede calcular utilizando las propiedades termodinámicas del fluido supercrítico.
Modelo simple de SFE

Hay dos pasos esenciales para la SFE, el transporte (por difusión o de otro modo) de las partículas sólidas a la superficie y la disolución en el fluido supercrítico. Otros factores, como la difusión dentro de la partícula por el SF y la liberación reversible, como la desorción de un sitio activo, a veces son importantes, pero no se tratan en detalle aquí. La Figura 2 muestra las etapas durante la extracción de una partícula esférica donde al inicio de la extracción el nivel de extractante es igual en toda la esfera (Fig. 2a). Cuando comienza la extracción, el material se extrae inicialmente del borde de la esfera y la concentración en el centro no cambia (Fig. 2b). A medida que avanza la extracción, la concentración en el centro de la esfera disminuye a medida que el extractante se difunde hacia el borde de la esfera (Figura 2c).
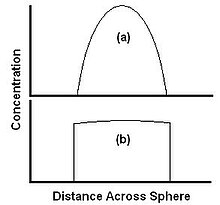
Las velocidades relativas de difusión y disolución se ilustran mediante dos casos extremos en la Figura 3. La Figura 3a muestra un caso en el que la disolución es rápida en relación con la difusión. El material se aleja del borde más rápido de lo que puede difundirse desde el centro, por lo que la concentración en el borde cae a cero. El material es arrastrado tan rápido como llega a la superficie y la extracción está completamente limitada por difusión. Aquí la velocidad de extracción se puede aumentar aumentando la velocidad de difusión, por ejemplo elevando la temperatura, pero no aumentando la velocidad de flujo del disolvente. La Figura 3b muestra un caso en el que la solubilidad es baja en relación con la difusión. El extractante es capaz de difundirse hasta el borde más rápido de lo que puede ser arrastrado por el disolvente y el perfil de concentración es plano. En este caso, la velocidad de extracción se puede aumentar aumentando la velocidad de disolución, por ejemplo aumentando la velocidad de flujo del disolvente.

La curva de extracción del % de recuperación frente al tiempo se puede utilizar para dilucidar el tipo de extracción que se produce. La Figura 4 (a) muestra una curva típica de difusión controlada. La extracción es inicialmente rápida, hasta que la concentración en la superficie cae a cero, y luego la velocidad se vuelve mucho más lenta. El porcentaje extraído finalmente se acerca al 100%. La Figura 4(b) muestra una curva para una extracción de solubilidad limitada. La tasa de extracción es casi constante y sólo se estabiliza hacia el final de la extracción. La Figura 4 (c) muestra una curva donde hay efectos significativos de la matriz, donde hay algún tipo de interacción reversible con la matriz, como la desorción de un sitio activo. La recuperación se estabiliza, y si no se conoce el valor del 100%, entonces es difícil decir que la extracción no está completa.
Optimización
El óptimo dependerá del propósito de la extracción. Para que una extracción analítica determine, digamos, el contenido de antioxidantes de un polímero, los factores esenciales son la extracción completa en el menor tiempo. Sin embargo, para la producción de un extracto de aceite esencial de una planta, la cantidad de CO2 utilizada será un costo significativo y la producción "completa" no se requiere extracción, un rendimiento del 70 - 80% tal vez sea suficiente para proporcionar beneficios económicos. En otro caso, la selectividad puede ser más importante y será preferible una tasa de extracción reducida si proporciona una mayor discriminación. Por lo tanto, se pueden hacer pocos comentarios que sean universalmente aplicables. Sin embargo, a continuación se describen algunos principios generales.
Maximizar la difusión
Esto se puede lograr aumentando la temperatura, hinchando la matriz o reduciendo el tamaño de las partículas. A veces se puede aumentar el hinchamiento de la matriz aumentando la presión del disolvente y añadiendo modificadores al disolvente. Algunos polímeros y elastómeros en particular se hinchan dramáticamente con el CO2, aumentando la difusión en algunos casos en varios órdenes de magnitud.
Maximizar la solubilidad
Generalmente, una presión más alta aumentará la solubilidad. El efecto de la temperatura es menos seguro, ya que cerca del punto crítico, el aumento de la temperatura provoca una disminución de la densidad y, por tanto, del poder de disolución. A presiones muy por encima de la presión crítica, es probable que la solubilidad aumente con la temperatura. La adición de niveles bajos de modificadores (a veces llamados arrastradores), como metanol y etanol, también puede aumentar significativamente la solubilidad, particularmente de compuestos más polares.
Optimización del caudal
El caudal de dióxido de carbono supercrítico debe medirse en términos de flujo másico en lugar de volumen porque la densidad del CO2 cambia según la temperatura tanto antes de entrar en los cabezales de la bomba como durante la compresión. Los medidores de flujo Coriolis se utilizan mejor para lograr dicha confirmación de flujo. Para maximizar la tasa de extracción, la tasa de flujo debe ser lo suficientemente alta como para que la extracción esté completamente limitada por la difusión (pero esto supondrá un gran desperdicio de disolvente). Sin embargo, para minimizar la cantidad de disolvente utilizado, la extracción debe limitarse completamente en cuanto a solubilidad (lo que llevará mucho tiempo). Por lo tanto, el caudal debe determinarse dependiendo de los factores competitivos de tiempo y costos de solventes, y también los costos de capital de bombas, calentadores e intercambiadores de calor. El caudal óptimo probablemente estará en algún lugar de la región donde tanto la solubilidad como la difusión sean factores importantes.