Etóxido de sodio
El etóxido de sodio, también conocido como etanolato de sodio, es el compuesto orgánico iónico con la fórmula CH3CH2ONa, C2H5ONa, o NaOEt (Et = etilo). Es un sólido blanco, aunque las muestras impuras aparecen de color amarillo o marrón. Se disuelve en disolventes polares como el etanol. Se utiliza comúnmente como base fuerte.
Preparación
Se han informado pocos procedimientos para preparar el sólido anhidro. En cambio, el material normalmente se prepara en una solución con etanol. Está disponible comercialmente y como solución en etanol. Se prepara fácilmente en el laboratorio tratando sodio metálico con etanol absoluto:
- 2 CH3CH2OH + 2 Na → 2 CH3CH2ONa + H2
La reacción del hidróxido de sodio con etanol anhidro sufre una conversión incompleta al etóxido.
Estructura
La estructura cristalina del etóxido de sodio se ha determinado mediante cristalografía de rayos X. Consta de capas de Na+ y O- centros con grupos etilo desordenados que cubren la parte superior e inferior de cada capa. Las capas de etilo se empaquetan espalda con espalda dando como resultado una estructura laminar. La reacción del sodio y el etanol a veces forma otros productos como el disolvato CH3CH2ONa·2CH3CH2OH. Su estructura cristalina ha sido determinada, aunque la estructura de otras fases del CH3CH2ONa/CH3CH2OH sigue siendo desconocido.
 | 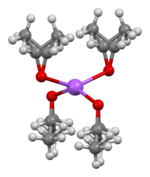 |  |
| modelo de apilación de capas en la estructura cristalina CH3CH2ONa | geometría de coordinación en Na | geometría de coordinación en O |
Reacciones
El etóxido de sodio se usa comúnmente como base en la condensación de Claisen y la síntesis de éster malónico. El etóxido de sodio puede desprotonar la posición α de una molécula de éster, formando un enolato, o la molécula de éster puede sufrir una sustitución nucleofílica llamada transesterificación. Si el material de partida es un éster etílico, la transesterificación es irrelevante ya que el producto es idéntico al material de partida. En la práctica, la mezcla solvatante de alcohol/alcóxido debe coincidir con los componentes alcoxi de los ésteres que reaccionan para minimizar el número de productos diferentes.
Muchos alcóxidos se preparan mediante metátesis de sales a partir de etóxido de sodio.
Estabilidad
El etóxido de sodio es propenso a reaccionar tanto con el agua como con el dióxido de carbono del aire. Esto conduce a la degradación de las muestras almacenadas con el tiempo, incluso en forma sólida. La apariencia física de las muestras degradadas puede no ser obvia, pero las muestras de etóxido de sodio se oscurecen gradualmente durante el almacenamiento. Se ha informado que incluso los lotes comerciales de etóxido de sodio recién obtenidos muestran niveles variables de degradación y son responsables como una fuente importante de irreproducibilidad cuando se usan en reacciones de Suzuki.
- Nueva botella de óxido de sodio de Sigma-Aldrich
- Recién abierto contenedor de etóxido de sodio que muestra decoloración causada por la degradación cuando se almacena sobre oxígeno y dióxido de carbono.
En aire húmedo, CH3CH2ONa se hidroliza rápidamente a hidróxido de sodio (NaOH). La conversión no es obvia y son muestras típicas de CH3CH2 ONa están contaminados con NaOH.
En aire libre de humedad, el etóxido de sodio sólido puede formar etilcarbonato de sodio a partir de la fijación del dióxido de carbono del aire. Otras reacciones conducen a la degradación en una variedad de otras sales de sodio y éter dietílico.
Esta inestabilidad se puede prevenir almacenando etóxido de sodio bajo una atmósfera inerte (por ejemplo, N2).
Seguridad
El etóxido de sodio es una base fuerte y, por lo tanto, es corrosivo.

