Etano
Etano (ETH-ayn, EE-thayn) es un compuesto químico orgánico con fórmula química C
2 H
6. A temperatura y presión estándar, el etano es un gas incoloro e inodoro. Como muchos hidrocarburos, el etano se aísla a escala industrial del gas natural y como subproducto petroquímico de la refinación del petróleo. Su uso principal es como materia prima para la producción de etileno.
Los compuestos relacionados se pueden formar reemplazando un átomo de hidrógeno con otro grupo funcional; el resto etano se llama grupo etilo. Por ejemplo, un grupo etilo unido a un grupo hidroxilo produce etanol, el alcohol de las bebidas.
Historia
El etano fue sintetizado por primera vez en 1834 por Michael Faraday, aplicando la electrólisis de una solución de acetato de potasio. Confundió el hidrocarburo producto de esta reacción con el metano y no lo investigó más.
Durante el período 1847-1849, en un esfuerzo por reivindicar la teoría radical de la química orgánica, Hermann Kolbe y Edward Frankland produjeron etano mediante la reducción de propionitrilo (cianuro de etilo) y yoduro de etilo con potasio metálico y, al igual que Faraday, por la electrólisis de acetatos acuosos. Confundieron el producto de estas reacciones con el radical metilo (CH3), del cual el etano (C2H6) es un dímero.
Este error fue corregido en 1864 por Carl Schorlemmer, quien demostró que el producto de todas estas reacciones era, de hecho, etano. El etano fue descubierto disuelto en petróleo crudo ligero de Pensilvania por Edmund Ronalds en 1864.
Propiedades
A temperatura y presión estándar, el etano es un gas incoloro e inodoro. Tiene un punto de ebullición de -88,5 °C (-127,3 °F) y un punto de fusión de -182,8 °C (-297,0 °F). El etano sólido existe en varias modificaciones. Al enfriarse a presión normal, la primera modificación que aparece es un cristal plástico, que cristaliza en el sistema cúbico. De esta forma, las posiciones de los átomos de hidrógeno no son fijas; las moléculas pueden girar libremente alrededor del eje largo. Enfriando este etano por debajo de ca. 89,9 K (−183,2 °C; −297,8 °F) lo cambia a etano metaestable monoclínico II (grupo espacial P 21/n). El etano es muy poco soluble en agua.
Los parámetros de enlace del etano se han medido con alta precisión mediante espectroscopia de microondas y difracción de electrones: rC−C = 1,528(3) Å, r C−H = 1,088(5) Å, y ∠CCH = 111,6(5)° por microondas y rC−C = 1,524(3) Å, rC−H = 1,089(5) Å, y ∠CCH = 111,9(5)° por difracción de electrones (los números entre paréntesis representa las incertidumbres en los dígitos finales).
Atmosféricos y extraterrestres
El etano se encuentra como un gas traza en la atmósfera de la Tierra, actualmente tiene una concentración al nivel del mar de 0,5 ppb, aunque es probable que su concentración preindustrial haya sido de solo alrededor de 0,25 partes por mil millones, ya que una proporción significativa de la el etano en la atmósfera actual puede haberse originado como combustibles fósiles. Las cantidades globales de etano han variado con el tiempo, probablemente debido a la quema en los campos de gas natural. Las tasas globales de emisión de etano disminuyeron de 1984 a 2010, aunque el aumento de la producción de gas de esquisto en la Formación Bakken en los EE. UU. detuvo la disminución a la mitad.
Aunque el etano es un gas de efecto invernadero, es mucho menos abundante que el metano, tiene una vida útil de solo unos pocos meses en comparación con más de una década y también es menos eficiente en la absorción de radiación en relación con la masa. De hecho, el potencial de calentamiento global del etano se debe en gran medida a su conversión en metano en la atmósfera. Se ha detectado como un componente traza en las atmósferas de los cuatro planetas gigantes y en la atmósfera de la luna de Saturno, Titán.
El etano atmosférico resulta de la acción fotoquímica del Sol sobre el gas metano, también presente en estas atmósferas: los fotones ultravioleta de longitudes de onda más cortas que 160 nm pueden fotodisociar la molécula de metano en un radical metilo y un átomo de hidrógeno. Cuando dos radicales metilo se recombinan, el resultado es etano:
- CH4 → CH3• + •H
- CH3• + •3 → C2H6
En la atmósfera de la Tierra, los radicales hidroxilo convierten el etano en vapor de metanol con una vida media de alrededor de tres meses.
Se sospecha que el etano producido de esta manera en Titán vuelve a llover sobre la superficie de la luna y, con el tiempo, se ha acumulado en mares de hidrocarburos que cubren gran parte de las regiones polares de la luna. En diciembre de 2007, la sonda Cassini encontró al menos un lago en el polo sur de Titán, ahora llamado Ontario Lacus debido al área similar del lago al lago Ontario en la Tierra (aproximadamente 20 000 km2). Un análisis adicional de los datos espectroscópicos infrarrojos presentados en julio de 2008 proporcionó evidencia adicional de la presencia de etano líquido en Ontario Lacus. Varios lagos de hidrocarburos significativamente más grandes, Ligeia Mare y Kraken Mare siendo los dos más grandes, fueron descubiertos cerca del polo norte de Titán utilizando datos de radar recopilados por Cassini. Se cree que estos lagos se llenan principalmente con una mezcla de etano y metano líquidos.
En 1996, se detectó etano en el cometa Hyakutake y, desde entonces, se ha detectado en otros cometas. La existencia de etano en estos cuerpos distantes del sistema solar puede implicar al etano como un componente primordial de la nebulosa solar a partir de la cual se cree que se formaron el sol y los planetas.
En 2006, Dale Cruikshank de la NASA/Ames Research Center (co-investigador de New Horizons) y sus colegas anunciaron el descubrimiento espectroscópico de etano en la superficie de Plutón.
Química
El etano puede verse como dos grupos metilo unidos, es decir, un dímero de grupos metilo. En el laboratorio, el etano se puede sintetizar convenientemente mediante electrólisis de Kolbe. En esta técnica, se electroliza una solución acuosa de una sal de acetato. En el ánodo, el acetato se oxida para producir dióxido de carbono y radicales metilo, y los radicales metilo altamente reactivos se combinan para producir etano:
- CH3COO - → CH3• + CO2 + e
- CH3• + •3 → C2H6
La síntesis por oxidación del anhídrido acético por peróxidos, es conceptualmente similar.
La química del etano involucra principalmente reacciones de radicales libres. El etano puede reaccionar con los halógenos, especialmente el cloro y el bromo, mediante halogenación por radicales libres. Esta reacción procede a través de la propagación del radical etilo:
- C2H5• + Cl2 → C2H5Cl + Cl•
- Cl• + C2H6 → C2H5• + HCl
Debido a que los etanos halogenados pueden sufrir más halogenación por radicales libres, este proceso da como resultado una mezcla de varios productos halogenados. En la industria química, se utilizan reacciones químicas más selectivas para la producción de cualquier haloalcano de dos carbonos en particular.
Combustión
La combustión completa del etano libera 1559,7 kJ/mol, o 51,9 kJ/g, de calor y produce dióxido de carbono y agua según la ecuación química:
- 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O + 3120 kJ
La combustión también puede ocurrir sin un exceso de oxígeno, formando una mezcla de carbono amorfo y monóxido de carbono.
- 2 C2H6 + 3 O2 → 4 C + 6 H2O + energía
- 2 C2H6 + 5 O2 → 4 CO + 6 H2O + energía
- 2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energía etc.
La combustión ocurre por una serie compleja de reacciones de radicales libres. Las simulaciones por computadora de la cinética química de la combustión del etano han incluido cientos de reacciones. Una serie importante de reacciones en la combustión del etano es la combinación de un radical etilo con oxígeno y la subsiguiente ruptura del peróxido resultante en radicales etoxilo e hidroxilo.
- C2H5• + O2 → C2H5OO•
- C2H5OO• + HR → C2H5OOH + •R
- C2H5OOH → C2H5O• + •OH
Los principales productos que contienen carbono de la combustión incompleta del etano son compuestos de un solo carbono, como el monóxido de carbono y el formaldehído. Una ruta importante por la cual se rompe el enlace carbono-carbono en el etano, para producir estos productos de un solo carbono, es la descomposición del radical etoxi en un radical metilo y formaldehído, que a su vez puede sufrir una oxidación adicional.
- C2H5O• → CH3• + CH2O
Algunos productos menores en la combustión incompleta del etano incluyen acetaldehído, metano, metanol y etanol. A temperaturas más altas, especialmente en el rango de 600 a 900 °C (1112 a 1652 °F), el etileno es un producto importante. Surge a través de reacciones como esta:
- C2H5• + O2 → C2H4 + •OH
Reacciones similares (con agentes distintos al oxígeno como extractor de hidrógeno) están involucradas en la producción de etileno a partir de etano en el craqueo al vapor.
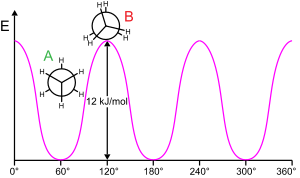
Barrera
La rotación de una subestructura molecular alrededor de un enlace giratorio generalmente requiere energía. La energía mínima para producir una rotación de enlace de 360° se llama barrera rotacional.
Ethane brinda un ejemplo clásico y simple de una barrera rotacional de este tipo, a veces llamada "barrera de etano". Entre las primeras evidencias experimentales de esta barrera (ver diagrama a la izquierda) se obtuvo modelando la entropía del etano. Los tres hidrógenos en cada extremo son libres de girar alrededor del enlace central carbono-carbono cuando se les proporciona suficiente energía para superar la barrera. El origen físico de la barrera aún no está completamente resuelto, aunque la repulsión de superposición (intercambio) entre los átomos de hidrógeno en los extremos opuestos de la molécula es quizás el candidato más fuerte, con el efecto estabilizador de la hiperconjugación en la conformación escalonada que contribuye al fenómeno. Los métodos teóricos que utilizan un punto de partida apropiado (orbitales ortogonales) encuentran que la hiperconjugación es el factor más importante en el origen de la barrera de rotación del etano.
Ya entre 1890 y 1891, los químicos sugirieron que las moléculas de etano preferían la conformación escalonada con los dos extremos de la molécula torcidos entre sí.
Producción
Después del metano, el etano es el segundo componente más grande del gas natural. El gas natural de diferentes yacimientos de gas varía en contenido de etano de menos del 1% a más del 6% por volumen. Antes de la década de 1960, el etano y las moléculas más grandes generalmente no se separaban del componente de metano del gas natural, sino que simplemente se quemaban junto con el metano como combustible. Hoy en día, el etano es una importante materia prima petroquímica y se separa de los otros componentes del gas natural en la mayoría de los campos de gas bien desarrollados. El etano también se puede separar del gas de petróleo, una mezcla de hidrocarburos gaseosos producidos como subproducto de la refinación del petróleo.
La forma más eficiente de separar el etano del metano es licuarlo a temperaturas criogénicas. Existen varias estrategias de refrigeración: el proceso más económico actualmente en uso generalizado emplea un turboexpansor y puede recuperar más del 90% del etano en el gas natural. En este proceso, el gas enfriado se expande a través de una turbina, lo que reduce la temperatura a aproximadamente -100 °C (-148 °F). A esta baja temperatura, el metano gaseoso se puede separar del etano licuado y de los hidrocarburos más pesados por destilación. Luego, la destilación adicional separa el etano del propano y los hidrocarburos más pesados.
Uso
El uso principal del etano es la producción de etileno (eteno) mediante craqueo al vapor. Cuando se diluye con vapor y se calienta brevemente a temperaturas muy altas (900 °C o más), los hidrocarburos pesados se descomponen en hidrocarburos más livianos y los hidrocarburos saturados se vuelven insaturados. El etano se favorece para la producción de etileno porque el craqueo con vapor de etano es bastante selectivo para el etileno, mientras que el craqueo con vapor de hidrocarburos más pesados produce una mezcla de productos más pobre en etileno y más rica en alquenos (olefinas) más pesados, como propeno (propileno) y butadieno. y en hidrocarburos aromáticos.
Experimentalmente, el etano está bajo investigación como materia prima para otros productos químicos básicos. Durante mucho tiempo, la cloración oxidativa del etano parece ser una ruta potencialmente más económica hacia el cloruro de vinilo que la cloración del etileno. Se han patentado muchos procesos para producir esta reacción, pero la escasa selectividad por el cloruro de vinilo y las condiciones de reacción corrosivas (en concreto, una mezcla de reacción que contiene ácido clorhídrico a temperaturas superiores a 500 °C) han desalentado la comercialización de la mayoría de ellos. Actualmente, INEOS opera una planta piloto de etano a cloruro de vinilo de 1000 t/a (toneladas por año) en Wilhelmshaven, Alemania.
Del mismo modo, la firma de Arabia Saudí SABIC ha anunciado la construcción de una planta de 30.000 t/a para producir ácido acético por oxidación de etano en Yanbu. La viabilidad económica de este proceso puede depender del bajo costo del etano cerca de los campos petrolíferos saudíes y puede que no sea competitivo con la carbonilación de metanol en otras partes del mundo.
El etano se puede utilizar como refrigerante en sistemas de refrigeración criogénicos. En una escala mucho más pequeña, en la investigación científica, el etano líquido se usa para vitrificar muestras ricas en agua para microscopía crioelectrónica. Una película delgada de agua sumergida rápidamente en etano líquido a -150 °C o menos se congela demasiado rápido para que el agua se cristalice. Los métodos de congelación más lentos pueden generar cristales de hielo cúbicos, que pueden alterar las estructuras blandas al dañar las muestras y reducir la calidad de la imagen al dispersar el haz de electrones antes de que alcance el detector.
Salud y seguridad
A temperatura ambiente, el etano es un gas extremadamente inflamable. Cuando se mezcla con aire al 3,0%–12,5% por volumen, forma una mezcla explosiva.
Algunas precauciones adicionales son necesarias cuando el etano se almacena como líquido criogénico. El contacto directo con etano líquido puede resultar en congelación severa. Hasta que alcanzan la temperatura ambiente, los vapores del etano líquido son más pesados que el aire y pueden fluir por el piso o suelo, reuniéndose en lugares bajos; si los vapores encuentran una fuente de ignición, la reacción química puede volver a la fuente de etano de donde se evaporaron.
El etano puede desplazar al oxígeno y convertirse en un peligro de asfixia. El etano no presenta ningún riesgo toxicológico agudo o crónico conocido. No es cancerígeno.
Contenido relacionado
Galvanismo
Leyes de los gases
Citocromo