Estructura cristalina
En cristalografía, estructura cristalina es una descripción de la disposición ordenada de átomos, iones o moléculas en un material cristalino. Las estructuras ordenadas surgen de la naturaleza intrínseca de las partículas constituyentes para formar patrones simétricos que se repiten a lo largo de las direcciones principales del espacio tridimensional en la materia.
El grupo más pequeño de partículas en el material que constituye este patrón repetitivo es la celda unitaria de la estructura. La celda unitaria refleja completamente la simetría y la estructura de todo el cristal, que se construye mediante la traslación repetitiva de la celda unitaria a lo largo de sus ejes principales. Los vectores de traslación definen los nodos de la red de Bravais.
Las longitudes de los ejes principales, o aristas, de la celda unitaria y los ángulos entre ellos son las constantes de red, también llamadas parámetros de red o parámetros de celda. Las propiedades de simetría del cristal se describen mediante el concepto de grupos espaciales. Todos los posibles arreglos simétricos de partículas en el espacio tridimensional pueden ser descritos por los 230 grupos espaciales.
La estructura cristalina y la simetría juegan un papel fundamental en la determinación de muchas propiedades físicas, como la división, la estructura de la banda electrónica y la transparencia óptica.
Célula unitaria
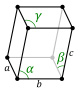
La estructura cristalina se describe en términos de la geometría de disposición de las partículas en las celdas unitarias. La celda unitaria se define como la unidad repetitiva más pequeña que tiene la simetría completa de la estructura cristalina. La geometría de la celda unitaria se define como un paralelepípedo, proporcionando seis parámetros de red tomados como las longitudes de los bordes de la celda (a, b, c) y los ángulos entre ellos (α, β, γ). Las posiciones de las partículas dentro de la celda unitaria se describen mediante las coordenadas fraccionarias (xi, yi, zi) a lo largo de los bordes de la celda, medido desde un punto de referencia. Por lo tanto, solo es necesario informar las coordenadas de un subconjunto asimétrico más pequeño de partículas. Este grupo de partículas se puede elegir de manera que ocupe el menor espacio físico, lo que significa que no todas las partículas deben estar ubicadas físicamente dentro de los límites dados por los parámetros de la red. Todas las demás partículas de la celda unitaria son generadas por las operaciones de simetría que caracterizan la simetría de la celda unitaria. El conjunto de operaciones de simetría de la celda unitaria se expresa formalmente como el grupo espacial de la estructura cristalina.
Índices de Miller
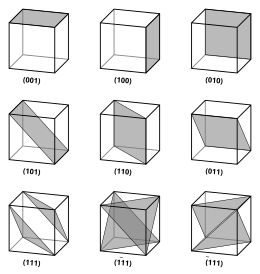
Los vectores y planos en una red cristalina se describen mediante la notación de índice de Miller de tres valores. Esta sintaxis utiliza los índices h, k y ℓ como parámetros direccionales.
Por definición, la sintaxis (hkℓ) denota un plano que intercepta los tres puntos a1/h, a2/k y a3/ℓ , o algún múltiplo del mismo. Es decir, los índices de Miller son proporcionales a las inversas de las intersecciones del plano con la celda unitaria (en base a los vectores de red). Si uno o más de los índices es cero, significa que los planos no se cruzan con ese eje (es decir, la intersección es 'en el infinito'). Un plano que contiene un eje de coordenadas se traslada para que ya no contenga ese eje antes de que se determinen sus índices de Miller. Los índices de Miller para un plano son números enteros sin factores comunes. Los índices negativos se indican con barras horizontales, como en (123). En un sistema de coordenadas ortogonales para una celda cúbica, los índices de Miller de un plano son los componentes cartesianos de un vector normal al plano.
Considerando solo (hkℓ) planos que intersecan uno o más puntos de celosía (los planos de celosía), la distancia d entre planos de celosía adyacentes es relacionado con el vector de red recíproco (más corto) ortogonal a los planos por la fórmula
- d=2π π Silencioghkl l Silencio{displaystyle d={frac {2pi}{ Anteriormathbf {g} ¿Qué?
Planos y direcciones
Las direcciones cristalográficas son líneas geométricas que unen los nodos (átomos, iones o moléculas) de un cristal. Asimismo, los planos cristalográficos son planos geométricos nodos de enlace. Algunas direcciones y planos tienen una mayor densidad de nodos. Estos planos de alta densidad tienen una influencia en el comportamiento del cristal de la siguiente manera:
- Propiedades ópticas: El índice refractivo está directamente relacionado con la densidad (o fluctuaciones de densidad periódica).
- Adsorción y reactividad: La adsorción física y las reacciones químicas ocurren en átomos o moléculas superficiales o cercanas. Estos fenómenos son sensibles a la densidad de los nodos.
- Tensión superficial: La condensación de un material significa que los átomos, iones o moléculas son más estables si están rodeados de otras especies similares. La tensión superficial de una interfaz varía según la densidad de la superficie.
- Defectos microestructurales: Poros y cristales tienden a tener límites de grano rectos siguiendo planos de mayor densidad.
- Cleavage: Esto ocurre típicamente paralela a planos de mayor densidad.
- Deformación plástica: El deslizamiento se produce preferentemente paralelo a los planos de mayor densidad. La perturbación por la dislocación (vector de los cirujanos) está a lo largo de una dirección densa. El cambio de un nodo en una dirección más densa requiere una distorsión menor de la celosía cristalina.
Algunas direcciones y planos están definidos por la simetría del sistema cristalino. En los sistemas monoclínicos, romboédricos, tetragonales y trigonales/hexagonales, existe un único eje (a veces denominado eje principal) que tiene una simetría de rotación mayor que los otros dos ejes. El plano basal es el plano perpendicular al eje principal en estos sistemas cristalinos. Para los sistemas cristalinos triclínicos, ortorrómbicos y cúbicos, la designación del eje es arbitraria y no hay un eje principal.
Estructuras cúbicas
Para el caso especial de los cristales cúbicos simples, los vectores de red son ortogonales y de igual longitud (normalmente denominados a); de manera similar para la red recíproca. Entonces, en este caso común, los índices de Miller (ℓmn) y [ℓmn] simplemente denotan normales/direcciones en coordenadas cartesianas. Para cristales cúbicos con constante de red a, el espacio d entre planos de red adyacentes (ℓmn) es (desde arriba):
- dl l mn=al l 2+m2+n2{displaystyle ♪♪ ¿Qué?.
Debido a la simetría de los cristales cúbicos, es posible cambiar el lugar y el signo de los números enteros y tener direcciones y planos equivalentes:
- Coordenadas en corchetes de ángulo tales como familia de direcciones que son equivalentes debido a operaciones de simetría, como [100], [010], [001] o el negativo de cualquiera de esas direcciones.
- Coordenadas en corchetes o sujetadores como {100} denota una familia de normales de avión que son equivalentes debido a operaciones de simetría, mucho la forma en que los corchetes de ángulo denotan una familia de direcciones.
Para redes cúbicas centradas en las caras (fcc) y cúbicas centradas en el cuerpo (bcc), los vectores de red primitivos no son ortogonales. Sin embargo, en estos casos, los índices de Miller se definen convencionalmente en relación con los vectores de red de la supercélula cúbica y, por lo tanto, son simplemente las direcciones cartesianas.
Espaciado entre planos
El espaciado d entre planos reticulares adyacentes (hkℓ) viene dado por:
- Cubic:
- 1d2=h2+k2+l l 2a2{fnMicroc} {1}{2}={frac} {h^{2}+k^{2}+ell.
- Tetragonal:
- 1d2=h2+k2a2+l l 2c2{fnMicroc} {1}{2}={frac} {h^{2}+k^{2}{a^{2}}}+{frac} {f} {f}} {f}} {f}}} {f}}} {f}}}}} {f}}}} {ell ^{2}{c^{2}}}
- Hexagonal:
- 1d2=43()h2+hk+k2a2)+l l 2c2{displaystyle {frac}{2}}={frac} {4}{2}{2}}}derecha)+{frac}{2}{a^{2}}}}derecha)+{frac {ell ^{2}{c^{2}}}
- Rhombohedral:
- 1d2=()h2+k2+l l 2)pecado2 α α +2()hk+kl l +hl l )()#2 α α − − # α α )a2()1− − 3#2 α α +2#3 α α ){fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif} {fnMicrosoft Sans Serif}} {2}fn}fn}fnMicros} {2}fnMicrosoft} {2}f} {2}f}f}fnMicros} {2}fnMicros}}} {2}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}f}fnun}f}fnun}fnun}f}fnun}f}f}f}f}fnun}fnun}fnun}fnun}f}fnun}f}}fn
- Orthorhombic:
- 1d2=h2a2+k2b2+l l 2c2{fnMicroc} {1}{2}={frac} {fnK} {fnK}} {fnMicroc}} {fnK}}} {f}} {f}}} {fn}}} {f}}}}} {fnfnf}}}}}} {fnf}}}}} {fnfnf}}}}} {f}}}}}}}}}}}}}}}}}}}}\\\\\\\\\\\\\fn\\\fnMicrocf}}}}}}}}}}}}}}}}}}}}}}}}\\\fn}}}}}}\\\\\\fn}}}}}}}}}}}}}}}\\\\\\\\\fn}}}}}}} {k^{2}{b^{2}}}+{frac} {ell ^{2}{c^{2}}}
- Monoclinic:
- 1d2=()h2a2+k2pecado2 β β b2+l l 2c2− − 2hl l # β β ac)csc2 β β {displaystyle {frac {1}{2}}=left({frac} {fnK} {fnK}}}}=m} {fnK} {fnK}} {fnMicroc}} {fnK}}} {f}} {f}}} {fn}}} {f}}}}} {fnfnf}}}}} {f}} {f}}}} {fnfnf}}}}}} {f}}}}}}}}} {f}}}}}}}}}}}}}}}}}}}}}}} {\\\ {k^{2}sin ^{2}beta - ¿Qué? # ¿Qué? {2hell cos beta Bueno... }
- Triclinic:
- 1d2=h2a2pecado2 α α +k2b2pecado2 β β +l l 2c2pecado2 γ γ +2kl l bc()# β β # γ γ − − # α α )+2hl l ac()# γ γ # α α − − # β β )+2hkab()# α α # β β − − # γ γ )1− − #2 α α − − #2 β β − − #2 γ γ +2# α α # β β # γ γ {displaystyle {frac {}{2}}={frac {frac {f} {f} {f} {f}} {fn}}}}fn}}fn}}fn}}} ^{2}alpha +{frac {k^{2} {b^{2}}sin ^{2}beta +{frac # ^{2} {c^{2}}sin ^{2}gamma {2kell } {cos beta cos gamma -cos alpha)+{frac {2hell }{ac}} {cos gamma cos alpha -cos beta)+{ab} {ab} {cos alpha cos beta - ¿Por qué? - 'cos ^{2}beta - 'cos ^{2}gamma +2cos alpha cos beta cos gamma }
Clasificación por simetría
La propiedad que define a un cristal es su simetría inherente. Realizar ciertas operaciones de simetría en la red cristalina la deja sin cambios. Todos los cristales tienen simetría de traslación en tres direcciones, pero algunos también tienen otros elementos de simetría. Por ejemplo, rotar el cristal 180° alrededor de cierto eje puede resultar en una configuración atómica idéntica a la configuración original; el cristal tiene doble simetría rotacional alrededor de este eje. Además de la simetría rotacional, un cristal puede tener simetría en forma de planos especulares, y también las llamadas simetrías compuestas, que son una combinación de traslación y rotación o simetrías especulares. Se logra una clasificación completa de un cristal cuando se identifican todas las simetrías inherentes del cristal.
Sistemas de celosía
Los sistemas de celosía son una agrupación de estructuras cristalinas según el sistema axial utilizado para describir su celosía. Cada sistema de celosía consta de un conjunto de tres ejes en una disposición geométrica particular. Todos los cristales caen en uno de los siete sistemas de celosía. Son similares, pero no exactamente iguales, a los siete sistemas de cristal.
El más simple y simétrico, el sistema cúbico o isométrico, tiene la simetría de un cubo, es decir, exhibe cuatro ejes de rotación triples orientados a 109,5° (el ángulo tetraédrico) entre sí. Estos ejes triples se encuentran a lo largo de las diagonales del cuerpo del cubo. Los otros seis sistemas de celosía son hexagonales, tetragonales, romboédricos (a menudo confundidos con el sistema cristalino trigonal), ortorrómbico, monoclínico y triclínico.
Retículas de Bravais
Las redes de Bravais, también conocidas como redes espaciales, describen la disposición geométrica de los puntos de la red y, por lo tanto, la simetría de traslación del cristal. Las tres dimensiones del espacio proporcionan 14 celosías de Bravais distintas que describen la simetría traslacional. Todos los materiales cristalinos reconocidos hoy, sin incluir los cuasicristales, encajan en uno de estos arreglos. Las catorce redes tridimensionales, clasificadas por sistema de red, se muestran arriba.
La estructura cristalina consta del mismo grupo de átomos, la base, colocados alrededor de todos y cada uno de los puntos de la red. Este grupo de átomos, por tanto, se repite indefinidamente en tres dimensiones según la disposición de una de las redes de Bravais. Las simetrías características de rotación y espejo de la celda unitaria se describen mediante su grupo de puntos cristalográficos.
Sistemas de cristal
Un sistema cristalino es un conjunto de grupos de puntos en los que los propios grupos de puntos y sus grupos espaciales correspondientes se asignan a un sistema de celosía. De los 32 grupos de puntos que existen en tres dimensiones, la mayoría están asignados a un solo sistema de celosía, en cuyo caso el sistema cristalino y el sistema de celosía tienen el mismo nombre. Sin embargo, se asignan cinco grupos de puntos a dos sistemas de celosía, romboédrico y hexagonal, porque ambos sistemas de celosía exhiben simetría rotacional triple. Estos grupos de puntos se asignan al sistema cristalino trigonal.
| Familia de cristal | Sistema de cristal | Grupo de puntos / Clase de cristal | Schönflies | Simetría de puntos | Orden | Grupo abstracto |
|---|---|---|---|---|---|---|
| Triclinic | pedial | C1 | polar enantiomorfo | 1 | trivial Z1{displaystyle mathbb {Z} _{1} | |
| pinacoidal | Ci (S2) | centros simétricos | 2 | ciclismo Z2{displaystyle mathbb {Z} _{2} | ||
| monoclínico | sphenoidal | C2 | polar enantiomorfo | 2 | ciclismo Z2{displaystyle mathbb {Z} _{2} | |
| domatic | Cs (C)1h) | polar | 2 | ciclismo Z2{displaystyle mathbb {Z} _{2} | ||
| prismática | C2h | centros simétricos | 4 | Klein cuatro V=Z2× × Z2{displaystyle mathbb {V} = 'Mathbb {Z} _{2}times mathbb {Z} _{2} | ||
| orthorhombic | rhombic-disphenoidal | D2 (V) | enantiomorfo | 4 | Klein cuatro V=Z2× × Z2{displaystyle mathbb {V} = 'Mathbb {Z} _{2}times mathbb {Z} _{2} | |
| rhombic-pyramidal | C2v | polar | 4 | Klein cuatro V=Z2× × Z2{displaystyle mathbb {V} = 'Mathbb {Z} _{2}times mathbb {Z} _{2} | ||
| rhombic-dipyramidal | D2h (V)h) | centros simétricos | 8 | V× × Z2{displaystyle mathbb {V} times mathbb {Z} _{2} | ||
| tetragonal | tetragonal-pyramidal | C4 | polar enantiomorfo | 4 | ciclismo Z4{displaystyle mathbb {Z} _{4} | |
| tetragonal-disphenoidal | S4 | non-centrosymmetric | 4 | ciclismo Z4{displaystyle mathbb {Z} _{4} | ||
| tetragonal-dipyramidal | C4h | centros simétricos | 8 | Z4× × Z2{displaystyle mathbb {Z} _{4}times mathbb {Z} _{2} | ||
| tetragonal-trapezohedral | D4 | enantiomorfo | 8 | dihedral D8=Z4⋊ ⋊ Z2{displaystyle mathbb {fnMicrosoft Sans Serif} {Z} _{4}rtimes mathbb {Z} _{2} | ||
| ditetragonal-pyramidal | C4v | polar | 8 | dihedral D8=Z4⋊ ⋊ Z2{displaystyle mathbb {fnMicrosoft Sans Serif} {Z} _{4}rtimes mathbb {Z} _{2} | ||
| tetragonal-scalenohedral | D2d (V)d) | non-centrosymmetric | 8 | dihedral D8=Z4⋊ ⋊ Z2{displaystyle mathbb {fnMicrosoft Sans Serif} {Z} _{4}rtimes mathbb {Z} _{2} | ||
| ditetragonal-dipyramidal | D4h | centros simétricos | 16 | D8× × Z2{displaystyle mathbb {D} _{8}times mathbb {Z} _{2} | ||
| hexagonal | trigonal | trigonal-piramidal | C3 | polar enantiomorfo | 3 | ciclismo Z3{displaystyle mathbb {Z} _{3} |
| rhombohedral | C3i (S6) | centros simétricos | 6 | ciclismo Z6=Z3× × Z2{displaystyle mathbb {Z} _{6}=mathbb {Z} _{3}times mathbb {Z} _{2} | ||
| trigonal-trapezohedral | D3 | enantiomorfo | 6 | dihedral D6=Z3⋊ ⋊ Z2{displaystyle mathbb {fnh}=mh} {Z} _{3}rtimes mathbb {Z} _{2} | ||
| ditrigonal-pyramidal | C3v | polar | 6 | dihedral D6=Z3⋊ ⋊ Z2{displaystyle mathbb {fnh}=mh} {Z} _{3}rtimes mathbb {Z} _{2} | ||
| ditrigonal-scalenohedral | D3d | centros simétricos | 12 | dihedral D12=Z6⋊ ⋊ Z2{displaystyle mathbb {fnMicrosoft Sans Serif} {Z} _{6}rtimes mathbb {Z} _{2} | ||
| hexagonal | hexagonal-pyramidal | C6 | polar enantiomorfo | 6 | ciclismo Z6=Z3× × Z2{displaystyle mathbb {Z} _{6}=mathbb {Z} _{3}times mathbb {Z} _{2} | |
| trigonal-dipyramidal | C3h | non-centrosymmetric | 6 | ciclismo Z6=Z3× × Z2{displaystyle mathbb {Z} _{6}=mathbb {Z} _{3}times mathbb {Z} _{2} | ||
| hexagonal-dipyramidal | C6h | centros simétricos | 12 | Z6× × Z2{displaystyle mathbb {Z} _{6}times mathbb {Z} _{2} | ||
| hexagonal-trapezohedral | D6 | enantiomorfo | 12 | dihedral D12=Z6⋊ ⋊ Z2{displaystyle mathbb {fnMicrosoft Sans Serif} {Z} _{6}rtimes mathbb {Z} _{2} | ||
| dihexagonal-pyramidal | C6v | polar | 12 | dihedral D12=Z6⋊ ⋊ Z2{displaystyle mathbb {fnMicrosoft Sans Serif} {Z} _{6}rtimes mathbb {Z} _{2} | ||
| ditrigonal-dipyramidal | D3h | non-centrosymmetric | 12 | dihedral D12=Z6⋊ ⋊ Z2{displaystyle mathbb {fnMicrosoft Sans Serif} {Z} _{6}rtimes mathbb {Z} _{2} | ||
| dihexagonal-dipyramidal | D6h | centros simétricos | 24 | D12× × Z2{displaystyle mathbb {D} _{12}times mathbb {Z} _{2} | ||
| cúbico | tetartoidal | T | enantiomorfo | 12 | alternando A4{displaystyle mathbb {A} {4}} | |
| diploidal | Th | centros simétricos | 24 | A4× × Z2{displaystyle mathbb {A} _{4}times mathbb {Z} _{2} | ||
| gyroidal | O | enantiomorfo | 24 | simétrica S4{displaystyle mathbb {fnK} | ||
| hextetrahedral | Td | non-centrosymmetric | 24 | simétrica S4{displaystyle mathbb {fnK} | ||
| hexoctadral | Oh | centros simétricos | 48 | S4× × Z2{displaystyle mathbb {S} _{4}times mathbb {Z} _{2} | ||
En total hay siete sistemas cristalinos: triclínico, monoclínico, ortorrómbico, tetragonal, trigonal, hexagonal y cúbico.
Grupos de puntos
El grupo de puntos cristalográficos o clase cristalina es el grupo matemático que comprende las operaciones de simetría que dejan al menos un punto inmóvil y que dejan sin cambios la apariencia de la estructura cristalina. Estas operaciones de simetría incluyen
- Reflexión, que refleja la estructura a través de plano de reflexión
- Rotación, que gira la estructura una porción especifica de un círculo sobre un eje de rotación
- Inversión, que cambia el signo de la coordenadas de cada punto con respecto a centro de simetría o punto de inversión
- Rotación inadecuada, que consiste en una rotación sobre un eje seguido de una inversión.
Los ejes de rotación (propios e impropios), los planos de reflexión y los centros de simetría se denominan colectivamente elementos de simetría. Hay 32 clases de cristales posibles. Cada uno se puede clasificar en uno de los siete sistemas de cristal.
Grupos espaciales
Además de las operaciones del grupo puntual, el grupo espacial de la estructura cristalina contiene operaciones de simetría traslacional. Éstas incluyen:
- Puro traducciones, que mueve un punto a lo largo de un vector
- Zapatos de mierda, que giran un punto alrededor de un eje mientras traducían paralelo al eje.
- Aviones Glide, que reflejan un punto a través de un avión al traducirlo paralelo al plano.
Hay 230 grupos espaciales distintos.
Coordinación atómica
Al considerar la disposición de los átomos entre sí, sus números de coordinación, distancias interatómicas, tipos de enlace, etc., es posible formarse una visión general de las estructuras y formas alternativas de visualizarlas.
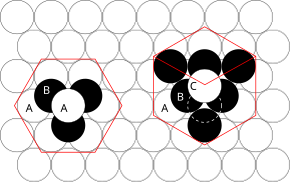
Cerrar embalaje
Los principios involucrados pueden entenderse considerando la forma más eficiente de empaquetar esferas de igual tamaño y apilar planos atómicos compactos en tres dimensiones. Por ejemplo, si el plano A se encuentra debajo del plano B, hay dos formas posibles de colocar un átomo adicional encima de la capa B. Si se colocara una capa adicional directamente sobre el plano A, esto daría lugar a la siguiente serie:
- ...ABABABABAB...
Esta disposición de los átomos en una estructura cristalina se conoce como empaque cerrado hexagonal (hcp).
Sin embargo, si los tres planos están escalonados entre sí y no es hasta que la cuarta capa se coloca directamente sobre el plano A que se repite la secuencia, entonces surge la siguiente secuencia:
- ...ABCABCABC...
Este tipo de disposición estructural se conoce como empaquetamiento cerrado cúbico (ccp).
La celda unitaria de un arreglo de átomos ccp es la celda unitaria cúbica centrada en las caras (fcc). Esto no es inmediatamente obvio ya que las capas muy juntas son paralelas a los planos {111} de la celda unitaria fcc. Hay cuatro orientaciones diferentes de las capas compactas.
APF y CN
Una característica importante de una estructura cristalina es su factor de empaquetamiento atómico (APF). Esto se calcula suponiendo que todos los átomos son esferas idénticas, con un radio lo suficientemente grande como para que cada esfera colinda con la siguiente. El factor de empaquetamiento atómico es la proporción de espacio ocupado por estas esferas que se puede calcular calculando el volumen total de las esferas y dividiendo por el volumen de la celda de la siguiente manera:
- APF=NparticleVparticleVcélula{displaystyle mathrm {APF} ={frac {N_{mathrm} {particle}V_{mathrm {particle} } {V_{text{unit cell}}}} {f}}} {f}} {f}}} {f}}} {f}}}}}}} {f}}}} {f}}}}}}}}} {
Otra característica importante de una estructura cristalina es su número de coordinación (CN). Este es el número de vecinos más cercanos de un átomo central en la estructura.
Los APF y CN de las estructuras cristalinas más comunes se muestran a continuación:
| Estructura de cristal | Factor de embalaje atómico | Número de coordinación (Geometría) |
|---|---|---|
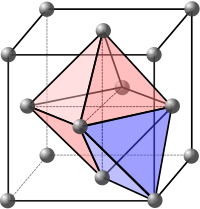
| Diamante cúbico | 0.34 | 4 (Tetraedro) |
| Simple cúbico | 0,522 | 6 (Octaedro) |
| Cobijo centrado en el cuerpo (BCC) | 0,688 | 8 (Cube) |
| Cobijo centrado en la cara (FCC) | 0,74 | 12 (Cuboctahedron) |
| Hexagonal close-packed (HCP) | 0,74 | 12 (Triangular orthobicupola) |
La eficiencia de empaquetamiento del 74 % de FCC y HCP es la densidad máxima posible en celdas unitarias construidas con esferas de un solo tamaño.
Sitios intersticiales
Los sitios intersticiales se refieren a los espacios vacíos entre los átomos en la red cristalina. Estos espacios pueden llenarse con iones de carga opuesta para formar estructuras de elementos múltiples. También pueden llenarse con átomos de impurezas o autointersticiales para formar defectos intersticiales.
Defectos e impurezas
Los cristales reales presentan defectos o irregularidades en los arreglos ideales descritos anteriormente y son estos defectos los que determinan de manera crítica muchas de las propiedades eléctricas y mecánicas de los materiales reales.
Impurezas
Cuando un átomo sustituye a uno de los componentes atómicos principales dentro de la estructura cristalina, pueden producirse alteraciones en las propiedades eléctricas y térmicas del material. Las impurezas también pueden manifestarse como impurezas de espín de electrones en ciertos materiales. La investigación sobre las impurezas magnéticas demuestra que la alteración sustancial de ciertas propiedades, como el calor específico, puede verse afectada por pequeñas concentraciones de una impureza, como por ejemplo, las impurezas en las aleaciones ferromagnéticas semiconductoras pueden dar lugar a diferentes propiedades, como se predijo por primera vez a fines de la década de 1960.
Dislocaciones
Las dislocaciones en una red cristalina son defectos lineales asociados con campos de tensión locales. Las dislocaciones permiten el cizallamiento a una tensión menor que la necesaria para una estructura cristalina perfecta. Los campos de tensión locales dan como resultado interacciones entre las dislocaciones que luego dan como resultado el endurecimiento por deformación o el trabajo en frío.
Límites de grano
Los límites de grano son interfaces donde se encuentran cristales de diferentes orientaciones. Un límite de grano es una interfaz monofásica, con cristales en cada lado del límite que son idénticos excepto en la orientación. El término "límite de cristalita" a veces, aunque rara vez, se usa. Las áreas de límite de grano contienen aquellos átomos que han sido perturbados de sus sitios de red originales, dislocaciones e impurezas que han migrado al límite de grano de menor energía.
Al tratar un límite de grano geométricamente como una interfaz de un solo cristal cortado en dos partes, una de las cuales gira, vemos que se requieren cinco variables para definir un límite de grano. Los primeros dos números provienen del vector unitario que especifica un eje de rotación. El tercer número designa el ángulo de rotación del grano. Los dos números finales especifican el plano del límite de grano (o un vector unitario que es normal a este plano).
Los límites de grano interrumpen el movimiento de las dislocaciones a través de un material, por lo que reducir el tamaño de los cristalitos es una forma común de mejorar la resistencia, como se describe en la relación Hall-Petch. Dado que los límites de grano son defectos en la estructura cristalina, tienden a disminuir la conductividad eléctrica y térmica del material. La alta energía interfacial y la unión relativamente débil en la mayoría de los límites de grano a menudo los convierte en sitios preferidos para el inicio de la corrosión y para la precipitación de nuevas fases del sólido. También son importantes para muchos de los mecanismos de fluencia.
Los límites de grano son, en general, de unos pocos nanómetros de ancho. En los materiales comunes, los cristalitos son lo suficientemente grandes como para que los límites de grano representen una pequeña fracción del material. Sin embargo, se pueden lograr tamaños de grano muy pequeños. En los sólidos nanocristalinos, los límites de grano se convierten en una fracción de volumen significativa del material, con profundos efectos en propiedades como la difusión y la plasticidad. En el límite de los pequeños cristalitos, a medida que la fracción volumétrica de los límites de grano se acerca al 100%, el material deja de tener cualquier carácter cristalino y, por lo tanto, se convierte en un sólido amorfo.
Predicción de estructura
La dificultad de predecir estructuras cristalinas estables basándose únicamente en el conocimiento de la composición química ha sido durante mucho tiempo un obstáculo en el camino hacia el diseño de materiales completamente computacional. Ahora, con algoritmos más potentes y computación de alto rendimiento, se pueden predecir estructuras de complejidad media utilizando enfoques como algoritmos evolutivos, muestreo aleatorio o metadinámica.
Las estructuras cristalinas de sólidos iónicos simples (por ejemplo, NaCl o sal de mesa) se han racionalizado durante mucho tiempo en términos de las reglas de Pauling, establecidas por primera vez en 1929 por Linus Pauling, al que muchos se refieren desde entonces como el &# 34;padre del enlace químico". Pauling también consideró la naturaleza de las fuerzas interatómicas en los metales y concluyó que aproximadamente la mitad de los cinco orbitales d en los metales de transición están involucrados en la unión, siendo los restantes orbitales d no enlazantes los responsables de las propiedades magnéticas. Por lo tanto, pudo correlacionar el número de orbitales d en la formación de enlaces con la longitud del enlace, así como con muchas de las propiedades físicas de la sustancia. Posteriormente introdujo el orbital metálico, un orbital adicional necesario para permitir la resonancia desinhibida de los enlaces de valencia entre varias estructuras electrónicas.
En la teoría del enlace de valencia resonante, los factores que determinan la elección de una de las estructuras cristalinas alternativas de un metal o compuesto intermetálico giran en torno a la energía de resonancia de los enlaces entre las posiciones interatómicas. Está claro que algunos modos de resonancia harían contribuciones mayores (serían más estables mecánicamente que otros) y que, en particular, una relación simple entre el número de enlaces y el número de posiciones sería excepcional. El principio resultante es que se asocia una estabilidad especial con las proporciones más simples o "números de enlace": 1⁄2, 1⁄3, 2⁄ 3, 1⁄4 , 3⁄4, etc. La elección de la estructura y el valor de la relación axial (que determina las longitudes relativas de los enlaces) son, por lo tanto, el resultado del esfuerzo de un átomo por usar su valencia en la formación de enlaces estables con números de enlaces fraccionarios simples.
Después de postular una correlación directa entre la concentración de electrones y la estructura cristalina en aleaciones de fase beta, Hume-Rothery analizó las tendencias en puntos de fusión, compresibilidades y longitudes de enlace en función del número de grupo en la tabla periódica para establecer un sistema de valencias de los elementos de transición en estado metálico. Este tratamiento enfatizó así el aumento de la fuerza de unión en función del número de grupos. La operación de las fuerzas direccionales se enfatizó en un artículo sobre la relación entre los enlaces híbridos y las estructuras metálicas. La correlación resultante entre las estructuras electrónica y cristalina se resume en un solo parámetro, el peso de los electrones d por orbital metálico hibridado. El "peso d" calcula 0.5, 0.7 y 0.9 para las estructuras fcc, hcp y bcc respectivamente. La relación entre los electrones d y la estructura cristalina se hace evidente.
En las predicciones/simulaciones de estructuras cristalinas, se suele aplicar la periodicidad, ya que el sistema se imagina con un tamaño ilimitado en todas las direcciones. Partiendo de una estructura triclínica sin asumir más propiedades de simetría, se puede impulsar el sistema para que muestre algunas propiedades de simetría adicionales aplicando la Segunda Ley de Newton a las partículas en la celda unitaria y una ecuación dinámica desarrollada recientemente para los vectores del período del sistema. (parámetros de la red, incluidos los ángulos), incluso si el sistema está sujeto a esfuerzos externos.
Polimorfismo
El polimorfismo es la aparición de múltiples formas cristalinas de un material. Se encuentra en muchos materiales cristalinos, incluidos polímeros, minerales y metales. Según Gibbs' reglas de equilibrio de fase, estas fases cristalinas únicas dependen de variables intensivas como la presión y la temperatura. El polimorfismo está relacionado con la alotropía, que se refiere a los sólidos elementales. La morfología completa de un material se describe mediante polimorfismo y otras variables como el hábito cristalino, la fracción amorfa o los defectos cristalográficos. Los polimorfos tienen diferentes estabilidades y pueden transformarse espontánea e irreversiblemente de una forma metaestable (o una forma termodinámicamente inestable) a la forma estable a una temperatura particular. También exhiben diferentes puntos de fusión, solubilidades y patrones de difracción de rayos X.
Un buen ejemplo de esto es la forma de cuarzo del dióxido de silicio, o SiO2. En la gran mayoría de los silicatos, el átomo de Si muestra coordinación tetraédrica por 4 oxígenos. Todas menos una de las formas cristalinas involucran unidades tetraédricas {SiO4} unidas entre sí por vértices compartidos en diferentes arreglos. En diferentes minerales, los tetraedros muestran diferentes grados de formación de redes y polimerización. Por ejemplo, ocurren individualmente, unidos en pares, en grupos finitos más grandes que incluyen anillos, cadenas, cadenas dobles, láminas y estructuras tridimensionales. Los minerales se clasifican en grupos basados en estas estructuras. En cada una de las 7 formas cristalinas termodinámicamente estables o polimorfos de cuarzo cristalino, solo 2 de cada 4 de cada uno de los bordes de los tetraedros {SiO4} se comparten con otros, lo que da la fórmula química neta para la sílice: SiO2.
Otro ejemplo es el estaño elemental (Sn), que es maleable cerca de la temperatura ambiente pero se vuelve quebradizo cuando se enfría. Este cambio en las propiedades mecánicas se debe a la existencia de sus dos alótropos principales, α- y β-estaño. Los dos alótropos que se encuentran a presión y temperatura normales, α-estaño y β-estaño, se conocen más comúnmente como estaño gris y estaño blanco respectivamente. Existen dos alótropos más, γ y σ, a temperaturas superiores a 161 °C y presiones superiores a varios GPa. El estaño blanco es metálico y es la forma cristalina estable a temperatura ambiente o superior. Por debajo de 13,2 °C, el estaño existe en forma gris, que tiene una estructura cristalina cúbica de diamante, similar al diamante, al silicio o al germanio. El estaño gris no tiene propiedades metálicas en absoluto, es un material en polvo de color gris opaco y tiene pocos usos, además de algunas aplicaciones especializadas de semiconductores. Aunque la temperatura de transformación α-β del estaño es nominalmente de 13,2 °C, las impurezas (por ejemplo, Al, Zn, etc.) reducen la temperatura de transición muy por debajo de 0 °C y, al agregar Sb o Bi, es posible que la transformación no se produzca en absoluto.
Propiedades físicas
Veinte de las 32 clases de cristales son piezoeléctricos y los cristales que pertenecen a una de estas clases (grupos puntuales) muestran piezoelectricidad. Todas las clases piezoeléctricas carecen de simetría de inversión. Cualquier material desarrolla una polarización dieléctrica cuando se aplica un campo eléctrico, pero una sustancia que tiene tal separación de carga natural incluso en ausencia de un campo se denomina material polar. Si un material es polar o no, está determinado únicamente por su estructura cristalina. Solo 10 de los 32 grupos de puntos son polares. Todos los cristales polares son piroeléctricos, por lo que las 10 clases de cristales polares a veces se denominan clases piroeléctricas.
Hay algunas estructuras cristalinas, en particular la estructura de perovskita, que muestran un comportamiento ferroeléctrico. Esto es análogo al ferromagnetismo, en el sentido de que, en ausencia de un campo eléctrico durante la producción, el cristal ferroeléctrico no presenta polarización. Tras la aplicación de un campo eléctrico de suficiente magnitud, el cristal se polariza permanentemente. Esta polarización se puede invertir mediante una contracarga suficientemente grande, de la misma manera que se puede invertir un ferroimán. Sin embargo, aunque se denominan ferroeléctricos, el efecto se debe a la estructura cristalina (no a la presencia de un metal ferroso).
Contenido relacionado
Murray Gell-Mann
Pirómetro
Walter Houser Brattain