Espectroscopia rotacional

3I. Cada transición rotacional se etiqueta con los números cuánticos, J, de los estados finales e iniciales, y se divide extensamente por los efectos del acoplamiento de cuádrupo nuclear con el 127Yo nucleo.
espectroscopia rotacional se ocupa de la medición de las energías de las transiciones entre estados rotacionales cuantificados de moléculas en la fase gaseosa. El espectro de rotación (densidad espectral de potencia versus frecuencia de rotación) de las moléculas polares se puede medir en absorción o emisión mediante espectroscopia de microondas o espectroscopia de infrarrojo lejano. Los espectros de rotación de moléculas no polares no pueden observarse con esos métodos, pero pueden observarse y medirse mediante espectroscopia Raman. La espectroscopia rotacional a veces se denomina espectroscopia rotacional pura para distinguirla de la espectroscopia rotacional-vibracional, donde los cambios en la energía rotacional ocurren junto con cambios en la energía vibratoria, y también de la espectroscopia ro-vibrónica (o simplemente espectroscopia vibrónica).) donde los cambios de energía rotacional, vibratoria y electrónica ocurren simultáneamente.
Para la espectroscopia rotacional, las moléculas se clasifican según su simetría en una parte superior esférica, una parte superior lineal y una superior simétrica; Se pueden derivar expresiones analíticas para los términos de energía de rotación de estas moléculas. Se pueden derivar expresiones analíticas para la cuarta categoría, parte superior asimétrica, para niveles de rotación de hasta J=3, pero los niveles de energía más altos deben determinarse utilizando métodos numéricos. Las energías de rotación se derivan teóricamente considerando que las moléculas son rotores rígidos y luego aplicando términos adicionales para tener en cuenta la distorsión centrífuga, la estructura fina, la estructura hiperfina y el acoplamiento de Coriolis. Al ajustar los espectros a las expresiones teóricas se obtienen valores numéricos de los momentos angulares de inercia, de los que en casos favorables se pueden derivar valores muy precisos de las longitudes y ángulos de los enlaces moleculares. En presencia de un campo electrostático se produce una división Stark que permite determinar los momentos dipolares eléctricos moleculares.
Una aplicación importante de la espectroscopia rotacional es la exploración de la composición química del medio interestelar utilizando radiotelescopios.
Aplicaciones
La espectroscopia rotacional se ha utilizado principalmente para investigar aspectos fundamentales de la física molecular. Es una herramienta excepcionalmente precisa para la determinación de la estructura molecular en moléculas en fase gaseosa. Se puede utilizar para establecer barreras a la rotación interna, como la asociada con la rotación del CH
3 grupo relativo al < span class="chemf nowrap">C
6H
4Cl grupo en clorotolueno (C
7H
7Cl). Cuando se pueden observar estructuras finas o hiperfinas, la técnica también proporciona información sobre las estructuras electrónicas de las moléculas. Gran parte del conocimiento actual sobre la naturaleza de las interacciones moleculares débiles, como los enlaces de Van der Waals, hidrógeno y halógeno, se ha establecido mediante espectroscopia rotacional. En relación con la radioastronomía, la técnica desempeña un papel clave en la exploración de la composición química del medio interestelar. Las transiciones de microondas se miden en el laboratorio y se comparan
a las emisiones del medio interestelar utilizando un radiotelescopio. NH3 fue la primera molécula poliatómica estable identificada en el medio interestelar. La medición del monóxido de cloro es importante para la química atmosférica. Los proyectos actuales en astroquímica involucran tanto espectroscopía de microondas de laboratorio como observaciones realizadas utilizando radiotelescopios modernos como el Atacama Large Millimeter/submillimeter Array (ALMA).
Descripción general
Una molécula en la fase de gas es libre de girar en relación con un conjunto de ejes ortogonales mutuos de orientación fija en el espacio, centrado en el centro de masa de la molécula. La rotación libre no es posible para moléculas en fases líquidas o sólidas debido a la presencia de fuerzas intermoleculares. La rotación sobre cada eje único se asocia con un conjunto de niveles de energía cuantificados dependientes del momento de la inercia sobre ese eje y un número cuántico. Así, para las moléculas lineales los niveles de energía se describen por un solo momento de inercia y un solo número cuántico, , que define la magnitud del impulso angular rotacional.
Para las moléculas no lineales que son rotores simétricos (o tops simétricas - ver la siguiente sección), hay dos momentos de inercia y la energía también depende de un segundo número cuántico rotacional, , que define el componente vectorial del impulso angular rotacional a lo largo del eje principal de simetría. El análisis de datos espectroscópicos con las expresiones detalladas a continuación da como resultado la determinación cuantitativa del valor(s) del momento(s) de la inercia. De estos valores precisos de la estructura y dimensiones moleculares se pueden obtener.
Para una molécula lineal, el análisis del espectro rotacional proporciona valores para la constante de rotación y el momento de inercia de la molécula y, conociendo las masas atómicas, se puede utilizar para determinar la longitud del enlace directamente. Para las moléculas diatómicas este proceso es sencillo. Para moléculas lineales con más de dos átomos es necesario medir los espectros de dos o más isotopólogos, como 16O12C32S y 16O12C34S. Esto permite establecer y resolver un conjunto de ecuaciones simultáneas para las longitudes de enlace). La longitud del enlace obtenida de esta manera es ligeramente diferente de la longitud del enlace en equilibrio. Esto se debe a que hay energía de punto cero en el estado fundamental vibratorio, al que se refieren los estados rotacionales, mientras que la longitud del enlace de equilibrio es mínima en la curva de energía potencial. La relación entre las constantes de rotación está dada por
donde v es un número cuántico vibratorio y α es una constante de interacción vibración-rotación que se puede calcular si se pueden encontrar los valores B para dos estados vibratorios diferentes.
Para otras moléculas, si se pueden resolver los espectros y se pueden deducir las transiciones individuales a las que se les asignan longitudes y ángulos de enlace. Cuando esto no es posible, como ocurre con la mayoría de las cimas asimétricas, todo lo que se puede hacer es ajustar los espectros a tres momentos de inercia calculados a partir de una estructura molecular supuesta. Variando la estructura molecular se puede mejorar el ajuste, dando una estimación cualitativa de la estructura. La sustitución isotópica es invaluable cuando se utiliza este enfoque para la determinación de la estructura molecular.
Clasificación de rotores moleculares
En la mecánica cuántica se cuantifica la rotación libre de una molécula, de modo que la energía rotacional y el impulso angular sólo pueden tomar ciertos valores fijos, que están relacionados simplemente con el momento de la inercia, De la molécula. Para cualquier molécula, hay tres momentos de inercia: , y alrededor de tres ejes ortogonales mutuamente A, B, y C con el origen en el centro de masa del sistema. La convención general, utilizada en este artículo, es definir los ejes tal que , con eje correspondiente al momento más pequeño de la inercia. Algunos autores, sin embargo, definen eje como eje de rotación molecular del orden más alto.
El patrón particular de niveles de energía (y, por tanto, de transiciones en el espectro rotacional) de una molécula está determinado por su simetría. Una forma conveniente de observar las moléculas es dividirlas en cuatro clases diferentes, según la simetría de su estructura. Estos son
- Tops esféricos (rotores esféricos)
- Los tres momentos de inercia son iguales entre sí: . Ejemplos de tapas esféricas incluyen tetramer fósforo (P4), tetracloruro de carbono (CCl4) y otros tetrahalides, metano (CH4), silana, (SiH4), hexafluoruro de azufre (SF6) y otros hexahalides. Las moléculas pertenecen a los grupos de puntos cúbicos Td o Oh.
- moléculas lineales
- Para una molécula lineal los momentos de la inercia están relacionados por . Para la mayoría de los fines, se puede tomar para ser cero. Ejemplos de moléculas lineales incluyen dioxígeno (O2), dinitrógeno (N2), monóxido de carbono (CO), radical hidroxi (OH), dióxido de carbono (CO2), cianuro de hidrógeno (HCN), sulfuro de carbono (OCS), acetileno (ethyne (HCCH) y dihaloethynes. Estas moléculas pertenecen a los grupos de puntos C∞v o DLevántate.
- Tops simétricos (rotores simétricos)
- Una tapa simétrica es una molécula en la que dos momentos de inercia son los mismos, o . Por definición, una parte superior simétrica debe tener un eje de rotación de orden 3 veces o superior. Como cuestión de conveniencia, los espectroscopistas dividen moléculas en dos clases de tapas simétricas, Tops simétricos oblatos (saucer o en forma de disco) con y Tops simétricos Prolate (futbol de droga, o forma de puro) con . Los espectros parecen bastante diferentes, y son inmediatamente reconocibles. Ejemplos de tapas simétricas incluyen
- Oblatos
- Benzene, C6H6; amoníaco, NH3; tetrafluoruro xenón, XeF4
- Prolate
- Clorometano, CH3Cl, propyne, CH3CADOCH
- Tops asimétricos (rotores asimétricos)
- Los tres momentos de la inercia tienen valores diferentes. Ejemplos de pequeñas moléculas que son tapas asimétricas incluyen agua, H2O y dióxido de nitrógeno, NO2 cuyo eje de simetría de mayor orden es un eje de rotación de dos veces. La mayoría de las moléculas grandes son tops asimétricas.
Reglas de selección
Espectros de microondas y infrarrojo lejano
Las transiciones entre estados de rotación se pueden observar en moléculas con un momento dipolar eléctrico permanente. Una consecuencia de esta regla es que no se puede observar ningún espectro de microondas para moléculas lineales centrosimétricas como N
2 (dinitrógeno) o HCCH (etino), que no son polares. Moléculas tetraédricas como CH
4 (metano), que tienen un momento dipolar cero y polarizabilidad isotrópica, no tendrían un espectro de rotación excepto por el efecto de distorsión centrífuga; cuando la molécula gira alrededor de un eje de simetría triple, se crea un pequeño momento dipolar, lo que permite observar un espectro de rotación débil mediante espectroscopia de microondas.
Con cimas simétricas, la regla de selección para transiciones de rotación pura permitidas por dipolos eléctricos es ΔK = 0, ΔJ = ±1. Dado que estas transiciones se deben a la absorción (o emisión) de un solo fotón con un espín de uno, la conservación del momento angular implica que el momento angular molecular puede cambiar como máximo en una unidad. Además, el número cuántico K está limitado a tener valores entre +J y -J inclusive.
Espectros Raman
Para los espectros Raman, las moléculas experimentan transiciones en las que se absorbe un fotón incidente y se emite otro fotón disperso. La regla de selección general para que se permita tal transición es que la polarizabilidad molecular debe ser anisotrópica, lo que significa que no es la misma en todas las direcciones. La polarizabilidad es un tensor tridimensional que se puede representar como un elipsoide. El elipsoide de polarizabilidad de las moléculas superiores esféricas es de hecho esférico, por lo que esas moléculas no muestran espectro Raman rotacional. Para todas las demás moléculas se pueden observar líneas de Stokes y anti-Stokes y tienen intensidades similares debido al hecho de que muchos estados de rotación están poblados térmicamente. La regla de selección para moléculas lineales es ΔJ = 0, ±2. La razón de los valores ±2 es que la polarizabilidad vuelve al mismo valor dos veces durante una rotación. El valor ΔJ = 0 no corresponde a una transición molecular sino más bien a una dispersión de Rayleigh en la que el fotón incidente simplemente cambia de dirección.
La regla de selección para moléculas superiores simétricas es
- ΔK = 0
- Si K = 0, luego ΔJ = ±2
- Si K ل 0, luego ΔJ = 0, ±1, ±2
Se dice que las transiciones con ΔJ = +1 pertenecen a la serie R, mientras que las transiciones con ΔJ = +2 pertenecen a una serie S. Dado que las transiciones Raman involucran dos fotones, es posible que el momento angular molecular cambie en dos unidades.
Unidades
Las unidades utilizadas para las constantes de rotación dependen del tipo de medición. Con espectros infrarrojos en la escala número de onda (), la unidad es generalmente el centímetro inverso, escrito como cm−1, que es literalmente el número de ondas en un centímetro, o el recíproco de la longitud de onda en centímetros (). Por otro lado, para espectros de microondas en la escala de frecuencias (), la unidad es generalmente el gigahertz. La relación entre estas dos unidades se deriva de la expresión
donde ν es una frecuencia, λ es una longitud de onda y c es la velocidad de la luz. Resulta que
Como 1 GHz = 109 Hz, la conversión numérica se puede expresar como
Efecto de la vibración sobre la rotación
La población de estados vibratorios excitados sigue una distribución de Boltzmann, por lo que los estados vibratorios de baja frecuencia están apreciablemente poblados incluso a temperatura ambiente. A medida que el momento de inercia es mayor cuando se excita una vibración, las constantes de rotación (B) disminuyen. En consecuencia, las frecuencias de rotación en cada estado de vibración son diferentes entre sí. Esto puede dar lugar a sistemas "satélite" líneas en el espectro rotacional. Un ejemplo lo proporciona el cianodiacetileno, H−C≡C−C≡C−C≡N.
Además, existe una fuerza ficticia, el acoplamiento de Coriolis, entre el movimiento vibratorio de los núcleos en el marco giratorio (no inercial). Sin embargo, mientras el número cuántico vibratorio no cambie (es decir, la molécula esté en un solo estado de vibración), el efecto de la vibración sobre la rotación no es importante, porque el tiempo de vibración es mucho más corto que el tiempo requerido para la rotación.. El acoplamiento de Coriolis también es a menudo insignificante si uno está interesado únicamente en números cuánticos de baja vibración y rotación.
Efecto de la rotación en los espectros vibratorios
Históricamente, la teoría de los niveles de energía rotacional se desarrolló para dar cuenta de las observaciones de los espectros de vibración-rotación de los gases en la espectroscopia infrarroja, que se utilizaba antes de que la espectroscopia de microondas se volviera práctica. En una primera aproximación, la rotación y la vibración pueden considerarse separables, por lo que la energía de la rotación se suma a la energía de la vibración. Por ejemplo, los niveles de energía rotacional para moléculas lineales (en la aproximación del rotor rígido) son
En esta aproximación, los números de onda de vibración-rotación de las transiciones son
Donde y son constantes de rotación para el estado vibratorio superior e inferior respectivamente, mientras y son los números cuánticos rotativos de los niveles superior e inferior. En realidad, esta expresión tiene que ser modificada para los efectos de la anarmonía de las vibraciones, para la distorsión centrífuga y para el acoplamiento de Coriolis.
Para el llamado R rama del espectro, para que haya excitación simultánea tanto de vibración como de rotación. Para el P rama, para que se pierda un cuántico de energía rotacional mientras se gana un cuántico de energía vibracional. La transición puramente vibratoria, , da lugar a Q rama del espectro. Debido a la población térmica de los estados rotatorios P rama es ligeramente menos intensa que la R rama.
Las constantes de rotación obtenidas a partir de mediciones infrarrojas concuerdan bien con las obtenidas mediante espectroscopía de microondas, mientras que esta última suele ofrecer una mayor precisión.
Estructura de los espectros rotacionales
Parte superior esférica
Las moléculas superiores esféricas no tienen momento dipolar neto. No se puede observar un espectro de rotación puro mediante espectroscopia de absorción o emisión porque no existe un momento dipolar permanente cuya rotación pueda acelerarse mediante el campo eléctrico de un fotón incidente. Además, la polarizabilidad es isotrópica, por lo que tampoco se pueden observar transiciones rotacionales puras mediante espectroscopia Raman. Sin embargo, las constantes de rotación se pueden obtener mediante espectroscopia rovibracional. Esto ocurre cuando una molécula es polar en el estado excitado por vibración. Por ejemplo, la molécula de metano es una parte superior esférica, pero la banda de estiramiento asimétrica C-H muestra una estructura rotacional fina en el espectro infrarrojo, ilustrada en el acoplamiento rovibracional. Este espectro también es interesante porque muestra una clara evidencia de acoplamiento de Coriolis en la estructura asimétrica de la banda.
Moléculas lineales

El rotor rígido es un buen punto de partida para construir un modelo de una molécula en rotación. Se supone que los átomos componentes son masas puntuales conectadas por enlaces rígidos. Una molécula lineal se encuentra sobre un solo eje y cada átomo se mueve sobre la superficie de una esfera alrededor del centro de masa. Los dos grados de libertad de rotación corresponden a las coordenadas esféricas θ y φ que describen la dirección del eje molecular, y el estado cuántico está determinado por dos números cuánticos J y M. J define la magnitud del momento angular de rotación y M su Componente alrededor de un eje fijo en el espacio, como un campo eléctrico o magnético externo. En ausencia de campos externos, la energía depende sólo de J. Según el modelo de rotor rígido, los niveles de energía rotacional, F(J), de la molécula se pueden expresar como:
Donde es la constante rotativa de la molécula y está relacionada con el momento de la inercia de la molécula. En una molécula lineal el momento de la inercia sobre un eje perpendicular al eje molecular es único, es decir, Así que
Para una molécula diatómica
donde m1 y m2 son las masas de los átomos y d es la distancia entre ellos.
Las reglas de selección dictan que durante la emisión o absorción el número de cuántico rotacional tiene que cambiar por unidad; es decir, . Así, las ubicaciones de las líneas en un espectro rotacional serán dadas por
Donde denota el nivel inferior y denota el nivel superior implicado en la transición.
El diagrama ilustra las transiciones rotacionales que obedecen al = 1 regla de selección. Las líneas desgarradas muestran cómo estas transiciones mapean características que se pueden observar experimentalmente. Adjacent las transiciones se separan por 2B en el espectro observado. Las unidades de frecuencia o número de onda también se pueden utilizar para x eje de esta trama.
Intensidades de líneas rotacionales
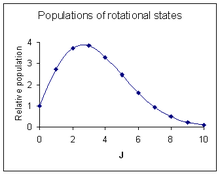
La probabilidad de que se produzca una transición es el factor más importante que influye en la intensidad de una línea rotacional observada. Esta probabilidad es proporcional a la población del estado inicial involucrado en la transición. La población de un estado rotacional depende de dos factores. El número de moléculas en estado excitado con número cuántico J, en relación con el número de moléculas en el estado fundamental, NJ/N0 viene dado por la distribución de Boltzmann como
- ,
donde k es la constante de Boltzmann y T la temperatura absoluta. Este factor disminuye a medida que J aumenta. El segundo factor es la degeneración del estado de rotación, que es igual a 2J + 1. Este factor aumenta a medida que aumenta J. Combinando los dos factores
La intensidad relativa máxima ocurre en
El diagrama de la derecha muestra un patrón de intensidad que corresponde aproximadamente al espectro que se encuentra encima.
Distorsión centrífuga
Cuando una molécula gira, la fuerza centrífuga separa los átomos. Como resultado, el momento de la inercia de la molécula aumenta, disminuyendo así el valor , cuando se calcula utilizando la expresión para el rotor rígido. Para tener en cuenta esto se añade un término de corrección de distorsión centrífuga a los niveles de energía rotativa de la molécula diatómica.
Donde es la constante de distorsión centrífuga.
Por lo tanto, las posiciones de línea para el modo rotacional cambian a
En consecuencia, el espacio entre líneas no es constante, como en la aproximación del rotor rígido, sino que disminuye al aumentar el número cuántico de rotación.
Una suposición subyacente de estas expresiones es que la vibración molecular sigue simple movimiento armónico. En la aproximación armónica la constante centrífuga puede derivarse como
Donde k es la fuerza vibratoria constante. La relación entre y
Donde es la frecuencia de vibración armónica, sigue. Si se debe tener en cuenta la anarmonía, se deben añadir términos en potencias superiores de J a las expresiones para los niveles de energía y posiciones de línea. Un ejemplo llamativo se refiere al espectro rotacional del fluoruro de hidrógeno que se conectó hasta términos [J(J+1)]5.
Oxígeno
El momento dipolar eléctrico de la molécula de dioxígeno, O
2 es cero, pero la molécula es paramagnética con dos electrones desapareados de modo que haya transiciones permitidas de dipolo magnético que puedan observarse mediante espectroscopía de microondas. El espín unitario del electrón tiene tres orientaciones espaciales con respecto al vector de momento angular de rotación molecular dado, K, de modo que cada nivel de rotación se divide en tres estados, J = K + 1, K y K - 1, cada J estado de este el llamado triplete tipo p que surge de una orientación diferente del espín con respecto al movimiento de rotación de la molécula. La diferencia de energía entre los términos J sucesivos en cualquiera de estos tripletes es de aproximadamente 2 cm−1 (60 GHz), con la única excepción de J = 1←0 diferencia que es de aproximadamente 4 cm− 1. Las reglas de selección para las transiciones de dipolos magnéticos permiten transiciones entre miembros sucesivos del triplete (ΔJ = ±1) de modo que para cada valor del número cuántico del momento angular de rotación K hay dos transiciones permitidas. El núcleo 16O tiene un momento angular de espín nuclear nulo, de modo que las consideraciones de simetría exigen que K tenga sólo valores impares.
Top simétrico
Para rotores simétricos, un número cuántico J está asociado con el momento angular total de la molécula. Para un valor dado de J, hay una degeneración de 2J+1 veces con el número cuántico, M toma los valores +J...0... -J. El tercer número cuántico, K, está asociado con la rotación alrededor del eje de rotación principal de la molécula. En ausencia de un campo eléctrico externo, la energía rotacional de una peonza simétrica es función únicamente de J y K y, en la aproximación del rotor rígido, la energía de cada estado rotacional viene dada por
Donde y para un prolate molécula superior simétrica o para una oblación molécula.
Esto da los números de onda de transición como
que es lo mismo que en el caso de una molécula lineal. Con una corrección de primer orden para la distorsión centrífuga, los números de onda de transición se vuelven
El término en DJK tiene el efecto de eliminar la degeneración presente en la aproximación del rotor rígido, con diferentes valores de K.
Top asimétrico

El número cuántico J se refiere al momento angular total, como antes. Dado que hay tres momentos de inercia independientes, hay otros dos números cuánticos independientes a considerar, pero los valores de los términos para un rotor asimétrico no se pueden derivar en forma cerrada. Se obtienen mediante diagonalización matricial individual para cada valor J. Hay fórmulas disponibles para moléculas cuya forma se aproxima a la de una punta simétrica.
La molécula de agua es un ejemplo importante de una cima asimétrica. Tiene un espectro de rotación puro e intenso en la región del infrarrojo lejano, por debajo de unos 200 cm−1. Por este motivo, los espectrómetros de infrarrojo lejano deben liberarse del vapor de agua atmosférico mediante purga con un gas seco o mediante evacuación. El espectro ha sido analizado en detalle.
División cuadrupolo
Cuando un núcleo tiene un número cuántico de espín, I, mayor que 1/2 tiene un momento cuadripolar. En ese caso, el acoplamiento del momento angular del espín nuclear con el momento angular de rotación provoca la división de los niveles de energía de rotación. Si el número cuántico J de un nivel rotacional es mayor que I, se producen 2I + 1 niveles; pero si J es menor que I, se obtienen 2J + 1 niveles. El efecto es un tipo de división hiperfina. Por ejemplo, con 14N (I = 1) en HCN, todos los niveles con J > 0 se dividen en 3. Las energías de los subniveles son proporcionales al momento cuadripolar nuclear y son función de F y J. donde F = J + I, J + I − 1, …, |J − I|. Por tanto, la observación de la división del cuadrupolo nuclear permite determinar la magnitud del momento del cuadrupolo nuclear. Este es un método alternativo al uso de espectroscopia de resonancia de cuadrupolo nuclear. La regla de selección para transiciones rotacionales se convierte en
Efectos de Stark y Zeeman
En presencia de un campo eléctrico externo estático, la degeneración 2J + 1 de cada estado rotacional se elimina parcialmente, un ejemplo de Stark. efecto. Por ejemplo, en las moléculas lineales cada nivel de energía se divide en J + 1 componentes. El grado de división depende del cuadrado de la intensidad del campo eléctrico y del cuadrado del momento dipolar de la molécula. En principio, esto proporciona un medio para determinar el valor del momento dipolar molecular con alta precisión. Los ejemplos incluyen sulfuro de carbonilo, OCS, con μ = 0,71521 ± 0,00020 debye. Sin embargo, debido a que la división depende de μ2, la orientación del dipolo debe deducirse de consideraciones de mecánica cuántica.
Se producirá una eliminación similar de la degeneración cuando una molécula paramagnética se coloque en un campo magnético, un ejemplo del efecto Zeeman. La mayoría de las especies que se pueden observar en estado gaseoso son diamagnéticas. Las excepciones son las moléculas de electrones impares como el óxido nítrico, NO, dióxido de nitrógeno, NO
2, algunos óxidos de cloro y el radical hidroxilo. El efecto Zeeman se ha observado con dioxígeno, O
2
Espectroscopia Raman rotacional
Las transiciones rotacionales moleculares también se pueden observar mediante espectroscopía Raman. Las transiciones rotacionales están permitidas por Raman para cualquier molécula con una polarizabilidad anisotrópica que incluya todas las moléculas excepto las puntas esféricas. Esto significa que las transiciones rotacionales de moléculas sin momento dipolar permanente, que no pueden observarse en absorción o emisión, pueden observarse mediante dispersión en la espectroscopia Raman. Se pueden obtener espectros Raman de muy alta resolución adaptando un espectrómetro infrarrojo por transformada de Fourier. Un ejemplo es el espectro de 15
N
>2. Muestra el efecto del espín nuclear, lo que resulta en una variación de intensidades de 3:1 en líneas adyacentes. De los datos se dedujo una longitud de enlace de 109,9985 ± 0,0010 pm.
Instrumentos y métodos
La gran mayoría de los espectrómetros contemporáneos utilizan una combinación de componentes personalizados y disponibles comercialmente que los usuarios integran según sus necesidades particulares. Los instrumentos se pueden clasificar ampliamente según sus principios operativos generales. Aunque se pueden encontrar transiciones rotacionales en una región muy amplia del espectro electromagnético, existen limitaciones físicas fundamentales en el ancho de banda operativo de los componentes del instrumento. A menudo resulta poco práctico y costoso cambiar a mediciones dentro de una región de frecuencia completamente diferente. Los instrumentos y principios operativos que se describen a continuación son generalmente apropiados para experimentos de espectroscopia de microondas realizados a frecuencias entre 6 y 24 GHz.
Células de absorción y modulación de Stark
Un espectrómetro de microondas se puede construir de manera más sencilla utilizando una fuente de radiación de microondas, una celda de absorción en la que se puede introducir gas de muestra y un detector como un receptor superheterodino. Se puede obtener un espectro barriendo la frecuencia de la fuente mientras se detecta la intensidad de la radiación transmitida. Una simple sección de guía de ondas puede servir como celda de absorción. Una variación importante de la técnica en la que se aplica una corriente alterna a través de electrodos dentro de la celda de absorción da como resultado una modulación de las frecuencias de las transiciones rotacionales. Esto se conoce como modulación Stark y permite el uso de métodos de detección sensibles a la fase que ofrecen una sensibilidad mejorada. La espectroscopia de absorción permite el estudio de muestras termodinámicamente estables a temperatura ambiente. El primer estudio del espectro de microondas de una molécula (NH
3) fue realizado por Cleeton & Williams en 1934. Experimentos posteriores explotaron poderosas fuentes de microondas como el klistrón, muchas de las cuales fueron desarrolladas para radar durante la Segunda Guerra Mundial. El número de experimentos en espectroscopia de microondas aumentó inmediatamente después de la guerra. En 1948, Walter Gordy pudo preparar una revisión de los resultados contenidos en aproximadamente 100 artículos de investigación. Hewlett-Packard desarrolló versiones comerciales del espectrómetro de absorción de microondas en la década de 1970 y alguna vez fueron ampliamente utilizadas para la investigación fundamental. La mayoría de los laboratorios de investigación utilizan ahora espectrómetros de microondas por transformada de Fourier (FTMW) de Balle-Flygare o de pulso chirriado.
Espectroscopia de microondas por transformada de Fourier (FTMW)
El marco teórico que sustenta la espectroscopia FTMW es análogo al utilizado para describir la espectroscopia FT-NMR. El comportamiento del sistema en evolución se describe mediante ecuaciones ópticas de Bloch. En primer lugar, se introduce un pulso de microondas corto (normalmente de 0 a 3 microsegundos de duración) en resonancia con una transición rotacional. Aquellas moléculas que absorben la energía de este pulso son inducidas a girar coherentemente en fase con la radiación incidente. A la desactivación del pulso de polarización le sigue la emisión de microondas que acompaña a la decoherencia del conjunto molecular. Esta caída de inducción libre se produce en una escala de tiempo de 1 a 100 microsegundos, dependiendo de la configuración del instrumento. Tras el trabajo pionero de Dicke y sus colaboradores en la década de 1950, Ekkers y Flygare construyeron el primer espectrómetro FTMW en 1975.
Espectrómetro Balle-Flygare FTMW
Balle, Campbell, Keenan y Flygare demostraron que la técnica FTMW se puede aplicar dentro de una "celda de espacio libre" que comprende una cámara evacuada que contiene una cavidad de Fabry-Perot. Esta técnica permite sondear una muestra sólo milisegundos después de que se enfríe rápidamente a sólo unos pocos kelvin en la garganta de un chorro de gas en expansión. Este fue un desarrollo revolucionario porque (i) enfriar las moléculas a bajas temperaturas concentra la población disponible en los niveles de energía rotacional más bajos. Junto con los beneficios conferidos por el uso de una cavidad de Fabry-Perot, esto trajo una gran mejora en la sensibilidad y resolución de los espectrómetros junto con una reducción en la complejidad de los espectros observados; (ii) fue posible aislar y estudiar moléculas que están muy débilmente unidas porque no hay suficiente energía disponible para sufrir fragmentación o reacción química a temperaturas tan bajas. William Klemperer fue un pionero en el uso de este instrumento para la exploración de interacciones débilmente ligadas. Si bien la cavidad Fabry-Perot de un espectrómetro Balle-Flygare FTMW normalmente se puede sintonizar en resonancia a cualquier frecuencia entre 6 y 18 GHz, el ancho de banda de las mediciones individuales está restringido a aproximadamente 1 MHz. Una animación ilustra el funcionamiento de este instrumento que actualmente es la herramienta más utilizada para espectroscopía de microondas.
Espectrómetro FTMW de pulso chirriado
Observando que los digitalizadores y la tecnología electrónica relacionada habían progresado significativamente desde el inicio de la espectroscopia FTMW, B.H. Pate, de la Universidad de Virginia, diseñó un espectrómetro que conserva muchas ventajas del espectrómetro Balle-Flygare FT-MW al mismo tiempo que innova en (i) el uso de un generador de formas de onda arbitrarias de alta velocidad (>4 GS/s) para generar un > 34;chirrió" pulso de polarización de microondas que barre hasta 12 GHz de frecuencia en menos de un microsegundo y (ii) el uso de un osciloscopio de alta velocidad (>40 GS/s) para digitalizar y transformar Fourier la desintegración de inducción libre molecular. El resultado es un instrumento que permite estudiar moléculas débilmente unidas pero que es capaz de aprovechar un ancho de banda de medición (12 GHz) muy mejorado en comparación con el espectrómetro FTMW de Balle-Flygare. Varios grupos en los Estados Unidos, Canadá y Europa han construido versiones modificadas del espectrómetro CP-FTMW original. El instrumento ofrece una capacidad de banda ancha que es altamente complementaria a la alta sensibilidad y resolución que ofrece el diseño Balle-Flygare.
Contenido relacionado
Julio (unidad)
Ley de Fick
Pascal (unidad)
























































