Especies de oxígeno reactivas
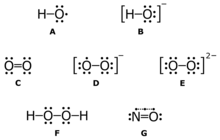
A: radical hidroxilHOMBRE•);
B: hidróxido de ionesHOMBRE−);
C: oxigeno de tripleteO22•);
D: anión de superoxidaO2• –);
E: peróxido de ionesO2 - 22);
F: peróxido de hidrógenoH2O2);
G: óxido nítricoNO•)
En química y biología, las especies reactivas de oxígeno (ROS) son sustancias químicas altamente reactivas formadas a partir de oxígeno diatómico (O2), agua y peróxido de hidrógeno. Algunas ROS destacadas son el hidroperóxido (O2H), el superóxido (O2-), el radical hidroxilo (OH.), y oxígeno singlete. Las ROS son omnipresentes porque se producen fácilmente a partir de O2, que es abundante. Las ROS son importantes en muchos sentidos, tanto beneficiosos como no. Las ROS funcionan como señales que activan y desactivan funciones biológicas. Son intermediarios en el comportamiento redox del O2, que es fundamental para las pilas de combustible. Los ROS son fundamentales para la fotodegradación de los contaminantes orgánicos en la atmósfera. Sin embargo, la mayoría de las veces, las ROS se analizan en un contexto biológico, que abarca desde sus efectos sobre el envejecimiento hasta su papel en la causa de mutaciones genéticas peligrosas.
Inventario de ROS
Los ROS no están definidos de manera uniforme. Todas las fuentes incluyen superóxido, oxígeno singlete y radical hidroxilo. El peróxido de hidrógeno no es tan reactivo como estas especies, pero se activa fácilmente y, por tanto, se incluye. El peroxinitrito y el óxido nítrico también son especies reactivas que contienen oxígeno.
- radical hidroxilHO·) es generado por la reacción Fenton de peróxido de hidrógeno con compuestos ferrosos y agentes de reducción relacionados:
- Fe(II) + H2O2 → Fe(III)OH + HO·
En su fugaz existencia, el radical hidroxilo reacciona rápidamente de forma irreversible con todos los compuestos orgánicos.
- superóxido (superóxido)O−2) se produce por reducción de O2. Se producen varios gramos por día en el cuerpo humano dentro de la mitocondria.
- O2 + e− → O−2
Compitiendo con su formación, el superóxido es destruido por la acción de las superóxido dismutasas, enzimas que catalizan su desproporción:
- 2 O−2 + 2H+ → O2 + H2O2
- peróxido de hidrógenoH2O2) también se produce como un producto lateral de la respiración.
- PeroxynitriteONO−2) resultados de la reacción de superóxido y óxido nítrico.
- Oxigeno de una sola pieza1O2) se incluye a veces como ROS. Los fotoensitizantes como la clorofila pueden convertir triplet (3O2) a un solo oxígeno: El oxígeno Singlet es altamente reactivo con compuestos orgánicos insaturados. Carotenoides, tocoferollas y plastoquinonas contenidas en cloroplastos que anclan el oxígeno y protegen contra sus efectos tóxicos. Los productos oxidados del β-caroteno que surgen de la presencia de oxígeno monot actúan como segundos mensajeros que pueden proteger contra la toxicidad inducida por el oxígeno o iniciar la muerte celular programada. Los niveles de jasmonato juegan un papel clave en la decisión entre aclimatación celular o muerte celular en respuesta a niveles elevados de esta especie reactiva de oxígeno.
Función biológica
En un contexto biológico, las ROS son subproductos del metabolismo normal del oxígeno. Las ROS tienen funciones en la señalización celular y la homeostasis. Las ROS son intrínsecas al funcionamiento celular y están presentes en niveles bajos y estacionarios en las células normales. En las plantas, las ROS participan en procesos metabólicos relacionados con la fotoprotección y la tolerancia a diversos tipos de estrés. Sin embargo, las ROS pueden causar daños irreversibles al ADN, ya que oxidan y modifican algunos componentes celulares e impiden que realicen sus funciones originales. Esto sugiere que ROS tiene una doble función; si actuarán como factores dañinos, protectores o de señalización depende del equilibrio entre la producción y eliminación de ROS en el momento y lugar adecuados. En otras palabras, la toxicidad del oxígeno puede surgir tanto de la producción descontrolada como de la eliminación ineficiente de ROS por parte del sistema antioxidante. También se demostró que las ROS modifican la apariencia visual de los peces. Esto afecta potencialmente su comportamiento y ecología, como su control de temperatura, su comunicación visual, su reproducción y supervivencia. Durante momentos de estrés ambiental (por ejemplo, exposición a los rayos UV o al calor), los niveles de ROS pueden aumentar drásticamente. Esto puede provocar daños importantes a las estructuras celulares. En conjunto, esto se conoce como estrés oxidativo. La producción de ROS está fuertemente influenciada por las respuestas de los factores de estrés en las plantas; estos factores que aumentan la producción de ROS incluyen la sequía, la salinidad, el frío, la defensa de patógenos, la deficiencia de nutrientes, la toxicidad de los metales y la radiación UV-B. Las ROS también son generadas por fuentes exógenas como las radiaciones ionizantes generando efectos irreversibles en el desarrollo de los tejidos tanto en animales como en plantas.
Fuentes de producción de ROS

Fuentes endógenas
Las ROS se producen durante los procesos de respiración y fotosíntesis en orgánulos como mitocondrias, peroxisomas y cloroplastos. Durante el proceso de respiración, las mitocondrias convierten la energía para la célula en una forma utilizable: trifosfato de adenosina (ATP). El proceso de producción de ATP en las mitocondrias, llamado fosforilación oxidativa, implica el transporte de protones (iones de hidrógeno) a través de la membrana mitocondrial interna mediante la cadena de transporte de electrones. En la cadena de transporte de electrones, los electrones pasan a través de una serie de proteínas mediante reacciones de oxidación-reducción, y cada proteína aceptora a lo largo de la cadena tiene un mayor potencial de reducción que la anterior. El último destino de un electrón a lo largo de esta cadena es una molécula de oxígeno. En condiciones normales, el oxígeno se reduce para producir agua; sin embargo, en aproximadamente el 0,1-2% de los electrones que pasan a través de la cadena (este número se deriva de estudios en mitocondrias aisladas, aunque la tasa exacta en organismos vivos aún no se ha acordado completamente), el oxígeno se reduce prematura e incompletamente para dar la radical superóxido (•O−
2), mejor documentado para el Complejo I y el Complejo III.
Otra fuente de producción de ROS en células animales son las reacciones de transferencia de electrones catalizadas por los sistemas mitocondriales P450 en tejidos esteroidogénicos. Estos sistemas P450 dependen de la transferencia de electrones del NADPH al P450. Durante este proceso, algunos electrones se “fugan”; y reacciona con O2 produciendo superóxido. Para hacer frente a esta fuente natural de ROS, los tejidos esteroidogénicos, ovario y testículo, tienen una gran concentración de antioxidantes como la vitamina C (ascorbato) y el β-caroteno y enzimas antioxidantes.
Si hay demasiado daño en las mitocondrias, una célula sufre apoptosis o muerte celular programada.
Además, las ROS se producen en la señalización de las células inmunitarias a través de la vía NOX. Las células fagocíticas como los neutrófilos, los eosinófilos y los fagocitos mononucleares producen ROS cuando se estimulan.
En los cloroplastos, las reacciones de carboxilación y oxigenación catalizadas por la rubisco aseguran que el funcionamiento de la cadena de transporte de electrones (ETC) se produzca en un ambiente rico en O2. La fuga de electrones en la ETC producirá inevitablemente ROS dentro de los cloroplastos. Alguna vez se creyó que ETC en el fotosistema I (PSI) era la única fuente de ROS en los cloroplastos. El flujo de electrones de los centros de reacción excitados se dirige al NADP y estos se reducen a NADPH, para luego entrar en el ciclo de Calvin y reducir el aceptor final de electrones, CO2. En los casos en los que hay una sobrecarga de ETC, parte del flujo de electrones se desvía de la ferredoxina al O2, formándose el radical libre superóxido (mediante la reacción de Mehler). Además, también puede producirse una fuga de electrones hacia O2 desde los grupos 2Fe-2S y 4Fe-4S en el PSI ETC. Sin embargo, PSII también proporciona ubicaciones de fuga de electrones (QA, QB) para O2-que produce O2-. El superóxido (O2-) se genera a partir de PSII, en lugar de PSI; QB se muestra como la ubicación para la generación de O2•-.
Fuentes exógenas
La formación de ROS puede ser estimulada por una variedad de agentes como contaminantes, metales pesados, tabaco, humo, drogas, xenobióticos, microplásticos o radiación. En las plantas, además de la acción de los factores abióticos secos, la alta temperatura, la interacción con otros seres vivos puede influir en la producción de ROS.
La radiación ionizante puede generar intermediarios dañinos a través de la interacción con el agua, un proceso denominado radiólisis. Dado que el agua constituye entre el 55% y el 60% del cuerpo humano, la probabilidad de radiólisis es bastante alta en presencia de radiación ionizante. En el proceso, el agua pierde un electrón y se vuelve altamente reactiva. Luego, a través de una reacción en cadena de tres pasos, el agua se convierte secuencialmente en radical hidroxilo (•OH), peróxido de hidrógeno (H2O2), radical superóxido (•O−
2) y, en última instancia, oxígeno (O2 ).
El radical hidroxilo es extremadamente reactivo e inmediatamente elimina electrones de cualquier molécula en su camino, convirtiendo esa molécula en un radical libre y propagando así una reacción en cadena. Sin embargo, el peróxido de hidrógeno es en realidad más dañino para el ADN que el radical hidroxilo, ya que la menor reactividad del peróxido de hidrógeno proporciona tiempo suficiente para que la molécula viaje al núcleo de la célula y posteriormente reaccione con macromoléculas como el ADN.
En las plantas, la producción de ROS ocurre durante eventos de estrés abiótico que conducen a una reducción o interrupción de la actividad metabólica. Por ejemplo, el aumento de temperatura, la sequía son factores que limitan la disponibilidad de CO2·- y 1O2 en cloroplastos. La producción de 1O2 en los cloroplastos puede provocar una reprogramación de la expresión de genes del núcleo que conduce a clorosis y muerte celular programada. En casos de estrés biótico, la generación de ROS se produce de forma rápida y débil inicialmente para luego volverse más sólida y duradera. La primera fase de acumulación de ROS está asociada con la infección de la planta y probablemente sea independiente de la síntesis de nuevas enzimas generadoras de ROS. Sin embargo, la segunda fase de acumulación de ROS se asocia únicamente con la infección por patógenos no virulentos y es una respuesta inducida que depende del aumento de las enzimas que codifican la transcripción del ARNm.
Enzimas antioxidantes
Superóxido dismutasa
Las superóxido dismutasas (SOD) son una clase de enzimas que catalizan la dismutación del superóxido en oxígeno y peróxido de hidrógeno. Como tales, son una importante defensa antioxidante en casi todas las células expuestas al oxígeno. En los mamíferos y en la mayoría de los cordados, están presentes tres formas de superóxido dismutasa. La SOD1 se encuentra principalmente en el citoplasma, la SOD2 en las mitocondrias y la SOD3 es extracelular. El primero es un dímero (consta de dos unidades), mientras que los demás son tetrámeros (cuatro subunidades). SOD1 y SOD3 contienen iones de cobre y zinc, mientras que SOD2 tiene un ion de manganeso en su centro reactivo. Los genes están ubicados en los cromosomas 21, 6 y 4, respectivamente (21q22.1, 6q25.3 y 4p15.3-p15.1).
La dismutación de superóxido catalizada por SOD se puede escribir con las siguientes semirreacciones:
donde M = Cu (n = 1); Mn (n = 2); Fe (n = 2); Ni (n = 2). En esta reacción, el estado de oxidación del catión metálico oscila entre n y n + 1.
La catalasa, que se concentra en los peroxisomas ubicados junto a las mitocondrias, reacciona con el peróxido de hidrógeno para catalizar la formación de agua y oxígeno. La glutatión peroxidasa reduce el peróxido de hidrógeno transfiriendo la energía de los peróxidos reactivos a un tripéptido que contiene azufre llamado glutatión. El azufre contenido en estas enzimas actúa como centro reactivo, transportando electrones reactivos desde el peróxido al glutatión. Las peroxiredoxinas también degradan H2O2, dentro de las mitocondrias, el citosol y el núcleo.
Efectos perjudiciales

Los efectos de las ROS sobre el metabolismo celular están bien documentados en una variedad de especies. Estos incluyen no sólo funciones en la apoptosis (muerte celular programada), sino también efectos positivos como la inducción de genes de defensa del huésped y la movilización de transportadores de iones. Esto los implica en el control de la función celular. En particular, las plaquetas involucradas en la reparación de heridas y la homeostasis sanguínea liberan ROS para reclutar plaquetas adicionales en los sitios de la lesión. Estos también proporcionan un vínculo con el sistema inmunológico adaptativo mediante el reclutamiento de leucocitos.
Las especies reactivas de oxígeno están implicadas en la actividad celular ante una variedad de respuestas inflamatorias, incluidas las enfermedades cardiovasculares. También pueden estar involucrados en la discapacidad auditiva a través del daño coclear inducido por niveles elevados de sonido, en la ototoxicidad de fármacos como el cisplatino y en la sordera congénita tanto en animales como en humanos. Las ROS también están implicadas en la mediación de la apoptosis o muerte celular programada y lesión isquémica. Ejemplos específicos incluyen accidente cerebrovascular y ataque cardíaco.
En general, los efectos nocivos de las especies reactivas de oxígeno en la célula son el daño del ADN o ARN, la oxidación de ácidos grasos poliinsaturados en lípidos (peroxidación lipídica), la oxidación de aminoácidos en proteínas y la desactivación oxidativa de enzimas específicas por cofactores de oxidación.
Respuesta del patógeno
Cuando una planta reconoce un patógeno atacante, una de las primeras reacciones inducidas es producir rápidamente superóxido (O−
>2) o peróxido de hidrógeno (H
2O< /sup>
2) para fortalecer la pared celular. Esto evita la propagación del patógeno a otras partes de la planta, esencialmente formando una red alrededor del patógeno para restringir el movimiento y la reproducción.
En el huésped mamífero, las ROS se inducen como defensa antimicrobiana. Para resaltar la importancia de esta defensa, las personas con enfermedad granulomatosa crónica que tienen deficiencias en la generación de ROS son altamente susceptibles a la infección por una amplia gama de microbios, incluidos Salmonella enterica, Staphylococcus aureus, Serratia marcescens y Aspergillus spp.
Los estudios sobre la homeostasis de los intestinos de Drosophila melanogaster han demostrado que la producción de ROS es un componente clave de la respuesta inmune en el intestino de la mosca. ROS actúa tanto como bactericida, dañando el ADN, el ARN y las proteínas bacterianas, como también como molécula de señalización que induce mecanismos de reparación del epitelio. El uracilo liberado por los microorganismos desencadena la producción y actividad de DUOX, la enzima productora de ROS en el intestino. La actividad DUOX se induce según el nivel de uracilo en el intestino; en condiciones basales, está regulado negativamente por la proteína quinasa MkP3. La estricta regulación de DUOX evita la producción excesiva de ROS y facilita la diferenciación entre microorganismos benignos y dañinos en el intestino.
No se comprende completamente la manera en que ROS defiende al huésped de los microbios invasores. Uno de los modos de defensa más probables es el daño al ADN microbiano. Los estudios que utilizaron Salmonella demostraron que se necesitaban mecanismos de reparación del ADN para resistir la destrucción por ROS. Se ha demostrado un papel de las ROS en los mecanismos de defensa antiviral a través de la helicasa-1 tipo Rig y la proteína de señalización antiviral mitocondrial. Los niveles elevados de ROS potencian la señalización a través de este receptor antiviral asociado a las mitocondrias para activar el factor regulador de interferón (IRF) -3, IRF-7 y el factor nuclear kappa B (NF-κB), lo que da como resultado un estado antiviral. Las células epiteliales respiratorias inducen ROS mitocondriales en respuesta a la infección por influenza. Esta inducción de ROS condujo a la inducción de interferón tipo III y a la inducción de un estado antiviral, limitando la replicación viral. En la defensa del huésped contra las micobacterias, las ROS desempeñan un papel, aunque la destrucción directa probablemente no sea el mecanismo clave; más bien, es probable que las ROS afecten los controles de señalización dependientes de ROS, como la producción de citocinas, la autofagia y la formación de granulomas.
Las especies reactivas de oxígeno también están implicadas en la activación, la anergia y la apoptosis de las células T.
Daño oxidativo
En los organismos aeróbicos, la energía necesaria para alimentar las funciones biológicas se produce en las mitocondrias a través de la cadena de transporte de electrones. Junto con la liberación de energía se producen especies reactivas de oxígeno (ROS) con potencial de causar daño celular. Las ROS pueden dañar los lípidos, el ADN, el ARN y las proteínas, lo que, en teoría, contribuye a la fisiología del envejecimiento.
Las ROS se producen como un producto normal del metabolismo celular. En particular, uno de los principales contribuyentes al daño oxidativo es el peróxido de hidrógeno (H2O2), que se convierte a partir del superóxido que se escapa de las mitocondrias. La catalasa y la superóxido dismutasa mejoran los efectos dañinos del peróxido de hidrógeno y el superóxido, respectivamente, al convertir estos compuestos en oxígeno y peróxido de hidrógeno (que luego se convierte en agua), lo que da como resultado la producción de moléculas benignas. Sin embargo, esta conversión no es 100% eficiente y los peróxidos residuales persisten en la celda. Si bien las ROS se producen como producto del funcionamiento celular normal, cantidades excesivas pueden provocar efectos nocivos.
Deterioro de la función cognitiva
La capacidad de memoria disminuye con la edad, algo evidente en enfermedades degenerativas humanas como la enfermedad de Alzheimer, que se acompaña de una acumulación de daño oxidativo. Los estudios actuales demuestran que la acumulación de ROS puede disminuir la aptitud de un organismo porque el daño oxidativo contribuye a la senescencia. En particular, la acumulación de daño oxidativo puede conducir a una disfunción cognitiva, como se demostró en un estudio en el que a ratas viejas se les administraron metabolitos mitocondriales y luego se les realizaron pruebas cognitivas. Los resultados mostraron que las ratas se desempeñaron mejor después de recibir los metabolitos, lo que sugiere que los metabolitos redujeron el daño oxidativo y mejoraron la función mitocondrial. La acumulación de daño oxidativo puede afectar la eficiencia de las mitocondrias y aumentar aún más la tasa de producción de ROS. La acumulación de daño oxidativo y sus implicaciones para el envejecimiento depende del tipo de tejido particular donde se produce el daño. Resultados experimentales adicionales sugieren que el daño oxidativo es responsable del deterioro del funcionamiento cerebral relacionado con la edad. Se encontró que los jerbos más viejos tenían niveles más altos de proteína oxidada en comparación con los jerbos más jóvenes. El tratamiento de ratones viejos y jóvenes con un compuesto atrapador de espín provocó una disminución en el nivel de proteínas oxidadas en los jerbos más viejos, pero no tuvo ningún efecto en los jerbos más jóvenes. Además, los jerbos de mayor edad realizaron mejor las tareas cognitivas durante el tratamiento, pero perdieron su capacidad funcional cuando se interrumpió el tratamiento, lo que provocó que aumentaran los niveles de proteína oxidada. Esto llevó a los investigadores a concluir que la oxidación de las proteínas celulares es potencialmente importante para la función cerebral.
Causa del envejecimiento
Según la teoría del envejecimiento de los radicales libres, el daño oxidativo iniciado por especies reactivas de oxígeno es un importante contribuyente al deterioro funcional característico del envejecimiento. Si bien los estudios en modelos de invertebrados indican que los animales genéticamente modificados para carecer de enzimas antioxidantes específicas (como la SOD), en general, muestran una esperanza de vida más corta (como se esperaría de la teoría), la manipulación inversa, aumentando los niveles de enzimas antioxidantes, ha produjo efectos inconsistentes sobre la esperanza de vida (aunque algunos estudios en Drosophila muestran que la esperanza de vida puede aumentar mediante la sobreexpresión de MnSOD o enzimas biosintetizadoras de glutatión). También contrariamente a esta teoría, la eliminación de la SOD2 mitocondrial puede prolongar la vida útil en Caenorhabditis elegans.
En los ratones, la historia es algo similar. La eliminación de enzimas antioxidantes, en general, produce una vida útil más corta, aunque los estudios de sobreexpresión no han extendido (con algunas excepciones) la vida útil de manera consistente. Un estudio de un modelo de envejecimiento prematuro en ratas encontró un aumento del estrés oxidativo, una reducción de la actividad de las enzimas antioxidantes y un daño sustancialmente mayor en el ADN en la neocorteza cerebral y el hipocampo de las ratas envejecidas prematuramente que en las ratas de control que envejecen normalmente. El daño al ADN 8-OHdG es producto de la interacción de ROS con el ADN. Numerosos estudios han demostrado que el 8-OHdG aumenta con la edad (consulte la teoría del envejecimiento del daño al ADN).
Cáncer
Las ROS se generan y eliminan constantemente en el sistema biológico y son necesarias para impulsar las vías reguladoras. En condiciones fisiológicas normales, las células controlan los niveles de ROS equilibrando la generación de ROS con su eliminación mediante sistemas de eliminación. Pero en condiciones de estrés oxidativo, el exceso de ROS puede dañar las proteínas celulares, los lípidos y el ADN, provocando lesiones fatales en la célula que contribuyen a la carcinogénesis.
Las células cancerosas exhiben un mayor estrés por ROS que las células normales, en parte debido a la estimulación oncogénica, el aumento de la actividad metabólica y el mal funcionamiento mitocondrial. ROS es un arma de doble filo. Por un lado, en niveles bajos, las ROS facilitan la supervivencia de las células cancerosas, ya que la progresión del ciclo celular impulsada por factores de crecimiento y los receptores tirosina quinasas (RTK) requieren ROS para su activación y la inflamación crónica, un mediador importante del cáncer, está regulada por ROS. Por otro lado, un alto nivel de ROS puede suprimir el crecimiento tumoral mediante la activación sostenida del inhibidor del ciclo celular y la inducción de la muerte celular, así como la senescencia al dañar macromoléculas. De hecho, la mayoría de los agentes quimioterapéuticos y radioterapéuticos matan las células cancerosas aumentando el estrés por ROS. La capacidad de las células cancerosas para distinguir entre ROS como señal de supervivencia o apoptótica está controlada por la dosis, la duración, el tipo y el sitio de producción de ROS. Se requieren niveles modestos de ROS para que las células cancerosas sobrevivan, mientras que niveles excesivos las matan.
La adaptación metabólica en los tumores equilibra la función de las células. necesidad de energía con una necesidad igualmente importante de componentes macromoleculares y un control más estricto del equilibrio redox. Como resultado, se mejora enormemente la producción de NADPH, que funciona como cofactor para proporcionar poder reductor en muchas reacciones enzimáticas para la biosíntesis macromolecular y al mismo tiempo rescatar a las células del exceso de ROS producido durante la rápida proliferación. Las células contrarrestan los efectos perjudiciales de las ROS mediante la producción de moléculas antioxidantes, como el glutatión reducido (GSH) y la tiorredoxina (TRX), que dependen del poder reductor del NADPH para mantener sus actividades.
La mayoría de los factores de riesgo asociados con el cáncer interactúan con las células mediante la generación de ROS. Luego, las ROS activan varios factores de transcripción, como el factor nuclear kappa, potenciador de la cadena ligera de las células B activadas (NF-κB), la proteína activadora 1 (AP-1), el factor 1α inducible por hipoxia y el transductor de señal y activador de la transcripción. 3 (STAT3), que conduce a la expresión de proteínas que controlan la inflamación; transformación celular; supervivencia de células tumorales; proliferación de células tumorales; e invasión, angiogénesis y metástasis. Y las ROS también controlan la expresión de varios genes supresores de tumores como p53, el gen del retinoblastoma (Rb) y el homólogo de fosfatasa y tensina (PTEN).
Carcinogénesis
La oxidación del ADN relacionada con ROS es una de las principales causas de mutaciones, que pueden producir varios tipos de daño en el ADN, incluidas modificaciones de bases no voluminosas (8-oxoguanina y formamidopirimidina) y voluminosas (ciclopurina y aductos de eteno), abásicas. sitios, roturas monocatenarias no convencionales, aductos proteína-ADN y entrecruzamientos intra/entre cadenas de ADN. Se ha estimado que las ROS endógenas producidas a través del metabolismo celular normal modifican aproximadamente 20.000 bases de ADN por día en una sola célula. La 8-oxoguanina es la más abundante entre las diversas bases nitrogenadas oxidadas observadas. Durante la replicación del ADN, la ADN polimerasa despareja la 8-oxoguanina con la adenina, lo que lleva a una mutación de transversión G→T. La inestabilidad genómica resultante contribuye directamente a la carcinogénesis. La transformación celular conduce al cáncer y la interacción de la isoforma atípica PKC-ζ con p47phox controla la producción de ROS y la transformación de células madre cancerosas apoptóticas a través del programa de emergencia blebbishield.
Proliferación celular
La proliferación descontrolada es una característica distintiva de las células cancerosas. Se ha demostrado que tanto las ROS exógenas como las endógenas mejoran la proliferación de células cancerosas. El papel de las ROS en la promoción de la proliferación tumoral se ve respaldado por la observación de que los agentes con potencial para inhibir la generación de ROS también pueden inhibir la proliferación de células cancerosas. Aunque las ROS pueden promover la proliferación de células tumorales, un gran aumento de ROS se ha asociado con una reducción de la proliferación de células cancerosas mediante la inducción de la detención del ciclo celular G2/M; aumento de la fosforilación de la ataxia telangiectasia mutada (ATM), punto de control quinasa 1 (Chk 1), Chk 2; y ciclo de división celular reducido 25 homólogo c (CDC25).
Muerte celular
Una célula cancerosa puede morir de tres maneras: apoptosis, necrosis y autofagia. El exceso de ROS puede inducir apoptosis a través de la vía extrínseca e intrínseca. En la vía extrínseca de la apoptosis, el ligando de Fas genera ROS como un evento aguas arriba para la activación de Fas mediante la fosforilación, que es necesaria para el reclutamiento posterior de la proteína asociada a Fas con dominio de muerte y caspasa 8, así como para la inducción de la apoptosis. En la vía intrínseca, las ROS funcionan para facilitar la liberación de citocromo c activando proteínas estabilizadoras de poros (Bcl-2 y Bcl-xL), así como inhibiendo proteínas desestabilizadoras de poros (proteína X asociada a Bcl-2, antagonista homólogo de Bcl-2/ asesino). La vía intrínseca también se conoce como cascada de caspasas y se induce mediante daño mitocondrial que desencadena la liberación de citocromo c. El daño del ADN, el estrés oxidativo y la pérdida del potencial de la membrana mitocondrial conducen a la liberación de las proteínas proapoptóticas mencionadas anteriormente que estimulan la apoptosis. El daño mitocondrial está estrechamente relacionado con la apoptosis y, dado que las mitocondrias son fácilmente atacables, existe potencial para la terapia contra el cáncer.
La naturaleza citotóxica de las ROS es una fuerza impulsora detrás de la apoptosis, pero en cantidades aún mayores, las ROS pueden provocar tanto apoptosis como necrosis, una forma de muerte celular incontrolada, en las células cancerosas.
Numerosos estudios han demostrado las vías y asociaciones entre los niveles de ROS y la apoptosis, pero una línea de estudio más nueva ha conectado los niveles de ROS y la autofagia. Las ROS también pueden inducir la muerte celular a través de la autofagia, que es un proceso autocatabólico que implica el secuestro de contenidos citoplasmáticos (orgánulos y agregados de proteínas agotados o dañados) para su degradación en los lisosomas. Por tanto, la autofagia también puede regular la salud de las células en momentos de estrés oxidativo. La autofagia puede ser inducida por los niveles de ROS a través de muchas vías en la célula en un intento de eliminar orgánulos dañinos y prevenir daños, como los carcinógenos, sin inducir apoptosis. La muerte celular autofágica puede ser provocada por la sobreexpresión de la autofagia, donde la célula digiere demasiado de sí misma en un intento de minimizar el daño y ya no puede sobrevivir. Cuando se produce este tipo de muerte celular, comúnmente se observa conjuntamente un aumento o pérdida de control de los genes reguladores de la autofagia. Por lo tanto, una vez que se logre una comprensión más profunda de la muerte celular autofágica y su relación con las ROS, esta forma de muerte celular programada puede servir como una futura terapia contra el cáncer. La autofagia y la apoptosis son mecanismos distintos de muerte celular provocada por altos niveles de ROS. Sin embargo, la aautofagia y la apoptosis rara vez actúan a través de vías estrictamente independientes. Existe una conexión clara entre ROS y autofagia y se observa una correlación entre cantidades excesivas de ROS que conducen a la apoptosis. La despolarización de la membrana mitocondrial también es característica del inicio de la autofagia. Cuando las mitocondrias se dañan y comienzan a liberar ROS, se inicia la autofagia para eliminar el orgánulo dañino. Si un fármaco se dirige a las mitocondrias y crea ROS, la autofagia puede eliminar tantas mitocondrias y otros orgánulos dañados que la célula ya no sea viable. La gran cantidad de ROS y el daño mitocondrial también pueden indicar apoptosis. El equilibrio de la autofagia dentro de la célula y la interferencia entre la autofagia y la apoptosis mediada por ROS es crucial para la supervivencia de una célula. Esta interferencia y conexión entre la autofagia y la apoptosis podría ser un mecanismo al que apuntan las terapias contra el cáncer o usarse en terapias combinadas para cánceres altamente resistentes.
Invasión de células tumorales, angiogénesis y metástasis
Después de la estimulación de las RTK por factores de crecimiento, las ROS pueden desencadenar la activación de vías de señalización implicadas en la migración e invasión celular, como los miembros de la familia de la proteína quinasa activada por mitógenos (MAPK): quinasa regulada extracelular (ERK), c-jun NH-2 quinasa terminal (JNK) y p38 MAPK. ROS también puede promover la migración al aumentar la fosforilación de la quinasa de adhesión focal (FAK) p130Cas y paxilina.
Tanto in vitro como in vivo, se ha demostrado que las ROS inducen factores de transcripción y modulan las moléculas de señalización implicadas en la angiogénesis (MMP, VEGF) y la metástasis (regulación positiva de AP-1, CXCR4, AKT y regulación negativa de PTEN).
Inflamación crónica y cáncer
La investigación experimental y epidemiológica de los últimos años ha indicado estrechas asociaciones entre ROS, inflamación crónica y cáncer. ROS induce inflamación crónica mediante la inducción de COX-2, citocinas inflamatorias (TNFα, interleucina 1 (IL-1), IL-6), quimiocinas (IL-8, CXCR4) y factores de transcripción proinflamatorios (NF-κB). Estas quimiocinas y receptores de quimiocinas, a su vez, promueven la invasión y metástasis de diversos tipos de tumores.
Terapia contra el cáncer
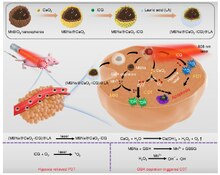
Se han desarrollado estrategias para aumentar y eliminar ROS, siendo predominantemente las primeras. Las células cancerosas con niveles elevados de ROS dependen en gran medida del sistema de defensa antioxidante. Los fármacos que elevan las ROS aumentan aún más el nivel de estrés celular de ROS, ya sea mediante la generación directa de ROS (p. ej., motexafina gadolinio, elesclomol) o mediante agentes que anulan el sistema antioxidante inherente, como el inhibidor de SOD (p. ej., ATN-224, 2-metoxiestradiol) y el inhibidor de GSH. (por ejemplo, PEITC, butionina sulfoximina (BSO)). El resultado es un aumento general de las ROS endógenas, que cuando están por encima del umbral de tolerabilidad celular, pueden inducir la muerte celular. Por otro lado, las células normales parecen tener, bajo estrés y reserva basales más bajos, una mayor capacidad para hacer frente a agresiones adicionales que generan ROS que las células cancerosas. Por lo tanto, la elevación de ROS en todas las células se puede utilizar para lograr la destrucción selectiva de las células cancerosas.
La radioterapia también se basa en la toxicidad de las ROS para erradicar las células tumorales. La radioterapia utiliza rayos X, rayos γ y radiación de partículas pesadas, como protones y neutrones, para inducir la muerte celular mediada por ROS y la falla mitótica.
Debido a la doble función de las ROS, se han desarrollado agentes anticancerígenos tanto prooxidantes como antioxidantes. Sin embargo, la modulación de la señalización de ROS por sí sola parece no ser un enfoque ideal debido a la adaptación de las células cancerosas al estrés de ROS, vías redundantes para apoyar el crecimiento del cáncer y la toxicidad de los fármacos anticancerígenos que generan ROS. Las combinaciones de fármacos generadores de ROS con productos farmacéuticos que pueden romper la adaptación redox podrían ser una mejor estrategia para mejorar la citotoxicidad de las células cancerosas.
James Watson y otros han propuesto que la falta de ROS intracelular debido a la falta de ejercicio físico puede contribuir a la progresión maligna del cáncer, porque se necesitan picos de ROS para plegar correctamente las proteínas en el retículo endoplasmático y, por lo tanto, los niveles bajos de ROS pueden obstaculizan específicamente la formación de proteínas supresoras de tumores. Dado que el ejercicio físico induce picos temporales de ROS, esto puede explicar por qué el ejercicio físico es beneficioso para el pronóstico de los pacientes con cáncer. Además, los inductores elevados de ROS, como la 2-desoxi-D-glucosa y los inductores del estrés celular basados en carbohidratos, inducen la muerte de las células cancerosas de manera más potente porque explotan la alta avidez de las células cancerosas por los azúcares.
Papel positivo de ROS en la memoria


Los ROS son fundamentales en la formación de la memoria. Las ROS también tienen un papel central en la desmetilación epigenética del ADN, que es relevante para el aprendizaje y la memoria.
En el ADN nuclear de los mamíferos, se puede agregar un grupo metilo, mediante una ADN metiltransferasa, al quinto carbono de la citosina para formar 5 mC (ver grupo metilo rojo agregado para formar 5 mC cerca de la parte superior de la primera figura). Las ADN metiltransferasas suelen formar 5 mC dentro de la secuencia de dinucleótidos "citosina-fosfato-guanina" para formar 5mCpG. Esta adición es un tipo importante de alteración epigenética y puede silenciar la expresión genética. La citosina metilada también puede desmetilarse, una alteración epigenética que puede aumentar la expresión de un gen. Una enzima importante implicada en la desmetilación de 5mCpG es TET1. Sin embargo, TET1 solo puede actuar sobre 5mCpG si una ROS ha actuado primero sobre la guanina para formar 8-hidroxi-2'-desoxiguanosina (8-OHdG), lo que da como resultado un dinucleótido de 5mCp-8-OHdG. Sin embargo, TET1 solo puede actuar en la parte de 5 mC del dinucleótido cuando la enzima reparadora por escisión de bases OGG1 se une a la lesión de 8-OHdG sin escisión inmediata. La adherencia de OGG1 al sitio 5mCp-8-OHdG recluta TET1 y TET1 luego oxida el 5mC adyacente al 8-OHdG, como se muestra en la primera figura, iniciando una vía de desmetilación que se muestra en la segunda figura.
Los miles de sitios CpG que se desmetilan durante la formación de la memoria dependen de ROS en un paso inicial. La expresión alterada de proteínas en las neuronas, controlada en parte por la desmetilación dependiente de ROS de los sitios CpG en los promotores de genes dentro del ADN de las neuronas, es fundamental para la formación de la memoria.
![{displaystyle {begin{aligned}&{ce {M}}^{(n+1)+}+{ce {O2- ->[SOD]}} {ce {M}}^{n+}+{ce {O2}}\&{ce {M}}^{n+}+{ce {O2- + 2H+ ->[][SOD]}} {ce {M}}^{(n+1)+}+{ce {H2O2}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7f939ecda1a07badabb855bce5991e15d94a25c)
![{displaystyle {begin{aligned}&{ce {2H2O2->[{text{catalase}}]2H2O{}+O2}}\&{ce {2GSH{}+H2O2->[][{text{glutathione}} atop {text{peroxidase}}]GS-SG{}+2H2O}}end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/699aacd6aea04d8ae2454398770976661e745d19)