Esfera de coordinación

El NH3 y los grupos Cl forman una esfera de coordinación alrededor del ión central del cobalto.
En química de coordinación, la primera esfera de coordinación se refiere al conjunto de moléculas e iones (los ligandos) unidos directamente al átomo central de metal. La segunda esfera de coordinación está formada por moléculas e iones que se unen de diversas maneras a la primera esfera de coordinación.
Primera esfera de coordinación
La primera esfera de coordinación se refiere a las moléculas que están unidas directamente al metal. Las interacciones entre la primera y la segunda esfera de coordinación suelen implicar enlaces de hidrógeno. En el caso de los complejos cargados, el apareamiento iónico es importante.
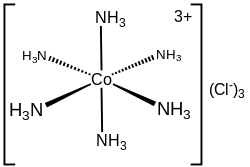
En el cloruro de hexametilcobalto(III) ([Co(NH3)6]Cl3), el catión cobalto más los 6 ligandos de amoníaco forman la primera esfera de coordinación. La esfera de coordinación de este ion consiste, por tanto, en un núcleo central MN6 "decorado" por 18 enlaces N−H que irradian hacia el exterior.
Segunda esfera de coordinación

Los iones metálicos pueden describirse como compuestos por una serie de dos esferas de coordinación concéntricas, la primera y la segunda. Más alejadas de la segunda esfera de coordinación, las moléculas de disolvente se comportan más como un "disolvente en masa". La simulación de la segunda esfera de coordinación es de interés en la química computacional. La segunda esfera de coordinación puede consistir en iones (especialmente en complejos cargados), moléculas (especialmente aquellas que forman enlaces de hidrógeno con ligandos en la primera esfera de coordinación) y porciones de una cadena principal de ligando. En comparación con la primera esfera de coordinación, la segunda esfera de coordinación tiene una influencia menos directa en la reactividad y las propiedades químicas del complejo metálico. No obstante, la segunda esfera de coordinación es relevante para comprender las reacciones del complejo metálico, incluidos los mecanismos de intercambio de ligandos y catálisis.
Función en la catalisis
Los mecanismos de las metaloproteínas a menudo invocan la modulación de la segunda esfera de coordinación por parte de la proteína.

Papel en la química inorgánica mecanicista
La velocidad a la que se intercambian los ligandos entre la primera y la segunda esfera de coordinación es el primer paso en las reacciones de sustitución de ligandos. En la sustitución asociativa de ligandos, el nucleófilo entrante reside en la segunda esfera de coordinación. Estos efectos son relevantes para aplicaciones prácticas, como los agentes de contraste utilizados en la resonancia magnética.
La energética de las reacciones de transferencia de electrones en la esfera interna se analiza en términos de la segunda esfera de coordinación. Algunas reacciones de transferencia de electrones acopladas a protones implican la transferencia de átomos entre las segundas esferas de coordinación de los reactivos:
- [Fe*(H)2O)6]2+ [Fe(H)2O)5(OH)]2+ [Fe(H)2O)6]3+ [Fe*(H)2O)5(OH)]2+
Papel en la espectroscopia
Los efectos de los disolventes sobre los colores y la estabilidad suelen atribuirse a cambios en la segunda esfera de coordinación. Dichos efectos pueden ser pronunciados en complejos en los que los ligandos de la primera esfera de coordinación son fuertes donantes y aceptores de enlaces de hidrógeno, por ejemplo, respectivamente [Co(NH3)6]3+ y [Fe(CN)6]3−. Los éteres corona se unen a los complejos de poliamina a través de su segunda esfera de coordinación. Los cationes de poliamonio se unen a los centros de nitrógeno de los cianometalatos.
Papel en la química supramolecular
Las moléculas macrocíclicas como las ciclodextrinas actúan a menudo como segunda esfera de coordinación para los complejos metálicos.
Véase también
- Número de coordinación
- Ángulo de ligand cone
- Geometría de coordinación
Más lectura
- ¿Qué es un compuesto de coordinación?
Referencias
- ^ Zhao, Meng; Wang, Hai-Bo; Ji, Liang-Nian; Mao, Zong-Wan (2013). "Insights into metalloenzyme microenvironments: biomimetic metal complexes with a functional second coordination sphere". Chemical Society Reviews. 42 (21): 8360–8375. doi:10.1039/c3cs60162e. ISSN 0306-0012. PMID 23881282.
- ^ Yang, J. Y.; Chen, S.; Dougherty, W. G.; Kassel, W. S.; Bullock, R. M.; DuBois, D. L.; Raugei, S.; Rousseau, R.; Dupuis, M.; Rakowski DuBois, M. (2010). "Calálisis de oxidación de hidrógeno por un complejo de níquel difosfina con aminas colgante tert-butil". Comuna. 46 (45): 8618–8620. doi:10.1039/c0cc03246h. PMID 20938535.
- ^ Bullock, R. M.; Helm, M. L. (2015). "Electrónicos moleculares para la oxidación del hidrógeno utilizando metales abundantes en la Tierra: Protones de choque alrededor con relés de protones". Acc. Chem. Res. 48 (7): 2017–2026. doi:10.1021/acs.accounts.5b00069. OSTI 1582563. PMID 26079983.
- ^ R. M. Supkowski, W. DeW. Horrocks Jr. "Sobre la determinación del número de moléculas de agua, q, coordinada a iones europium(III) en solución de vidas de decaimiento de luminiscencia" Inorgánico Chimica Acta 2002, Volumen 340, pp. 44–48. doi:10.1016/S0020-1693(02)01022-8
- ^ Lehn, J. M. Supramolecular Química: Conceptos y perspectivas; VCH: Weinhiem, 1995.
- ^ Z. Liu, S. T. Schneebeli, J. F. Stoddart "Second-sphere coordination revisited" Chimia 2014, 68, 315-320. doi:10.2533/chimia.2014.315
- ^ Z. Liu, M. Frasconi, J. Lei, Z. J. Brown, Z. Zhu, D. Cao, J. Iehl, G. Liu, A. C. Fahrenbach, O. K. Farha, J. T. Hupp, C. A. Mirkin, Y. Y. Botros, J. F. Stoddart "Aislamiento selectivo de oro facilitado por segunda fase Nature Communications 2013, 4, 1855. doi:10.1038/ncomms2891