Esclerosis múltiple
La esclerosis múltiple (EM) es la enfermedad desmielinizante más común, en la que las cubiertas aislantes de las células nerviosas del cerebro y la médula espinal están dañados. Este daño interrumpe la capacidad de partes del sistema nervioso para transmitir señales, lo que da como resultado una variedad de signos y síntomas, que incluyen problemas físicos, mentales y, a veces, psiquiátricos. Los síntomas específicos pueden incluir visión doble, ceguera en un ojo, debilidad muscular y problemas con la sensibilidad o la coordinación. La EM toma varias formas, con nuevos síntomas que ocurren en ataques aislados (formas recurrentes) o se acumulan con el tiempo (formas progresivas). En las formas recurrentes de EM, entre ataques, los síntomas pueden desaparecer por completo, aunque a menudo persisten algunos problemas neurológicos permanentes, especialmente a medida que avanza la enfermedad.
Si bien la causa no está clara, se cree que el mecanismo subyacente es la destrucción por parte del sistema inmunitario o la falla de las células productoras de mielina. Las causas propuestas para esto incluyen la genética y los factores ambientales, como las infecciones virales. La EM generalmente se diagnostica en función de los signos y síntomas de presentación y los resultados de las pruebas médicas de respaldo.
No se conoce cura para la esclerosis múltiple. Los tratamientos intentan mejorar la función después de un ataque y prevenir nuevos ataques. La fisioterapia y la terapia ocupacional pueden ayudar con la capacidad de funcionamiento de las personas. Muchas personas buscan tratamientos alternativos, a pesar de la falta de evidencia de beneficio. El resultado a largo plazo es difícil de predecir; los mejores resultados se observan con mayor frecuencia en las mujeres, aquellas que desarrollan la enfermedad a una edad temprana, aquellas con un curso recurrente y aquellas que inicialmente experimentaron pocos ataques.
La esclerosis múltiple es el trastorno inmunomediado más común que afecta al sistema nervioso central. Casi un millón de personas tienen EM en los Estados Unidos en 2022, y en 2020, alrededor de 2,8 millones de personas se vieron afectadas en todo el mundo, con tasas que varían ampliamente en diferentes regiones y entre diferentes poblaciones. La enfermedad suele comenzar entre los 20 y los 50 años y es dos veces más frecuente en mujeres que en hombres. La EM fue descrita por primera vez en 1868 por el neurólogo francés Jean-Martin Charcot. El nombre "esclerosis múltiple" se refiere a las numerosas cicatrices gliales (o escleróticas, esencialmente placas o lesiones) que se desarrollan en la sustancia blanca del cerebro y la médula espinal.
Signos y síntomas
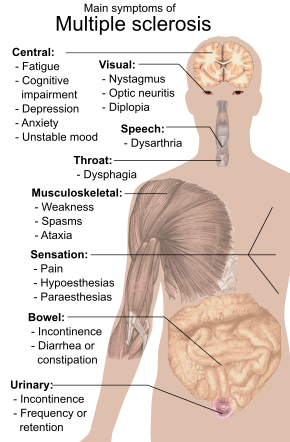
Una persona con EM puede tener casi cualquier síntoma o signo neurológico, siendo los más comunes los problemas autonómicos, visuales, motores y sensoriales. Los síntomas específicos están determinados por la ubicación de las lesiones dentro del sistema nervioso y pueden incluir pérdida de sensibilidad o cambios en la sensación, como hormigueo, hormigueo o entumecimiento; debilidad muscular, visión borrosa, reflejos pronunciados, espasmos musculares, dificultad para moverse, dificultades con la coordinación y el equilibrio (ataxia); problemas para hablar o tragar, problemas visuales (nistagmo, neuritis óptica o visión doble), cansancio, dolor agudo o crónico; y dificultades vesicales e intestinales (como vejiga neurógena), entre otras. Cuando la esclerosis múltiple está más avanzada, pueden presentarse dificultades para caminar y aumenta el riesgo de caídas.
También son comunes las dificultades para pensar y los problemas emocionales, como la depresión o el estado de ánimo inestable. El déficit principal en la función cognitiva que experimentan las personas con EM es una velocidad de procesamiento de información más lenta, con la memoria también comúnmente afectada y la función ejecutiva con menos frecuencia. La inteligencia, el lenguaje y la memoria semántica generalmente se conservan, y el nivel de deterioro cognitivo varía significativamente entre las personas con EM.
El fenómeno de Uhthoff, un empeoramiento de los síntomas debido a la exposición a temperaturas más altas de lo habitual, y el signo de Lhermitte, una sensación eléctrica que recorre la espalda al doblar el cuello, son particularmente característicos de EM. La principal medida de discapacidad y gravedad es la escala ampliada del estado de discapacidad (EDSS), y otras medidas, como el compuesto funcional de esclerosis múltiple, se utilizan cada vez más en la investigación. EDSS también se correlaciona con caídas en personas con EM. Si bien es una medida popular, EDSS ha sido criticado por algunas de sus limitaciones, como depender demasiado de caminar.
La afección comienza en el 85 % de los casos como un síndrome clínicamente aislado (CIS, por sus siglas en inglés) durante varios días, con un 45 % de problemas motores o sensoriales, un 20 % de neuritis óptica y un 10 % de síntomas relacionados con disfunción del tronco encefálico, mientras que el 25% restante tiene más de una de las dificultades anteriores. El curso de los síntomas ocurre inicialmente en dos patrones principales: ya sea como episodios de empeoramiento repentino que duran de unos pocos días a meses (llamados recaídas, exacerbaciones, episodios, ataques o brotes) seguidos de una mejoría (85% de los casos) o como un empeoramiento gradual en el tiempo sin períodos de recuperación (10-15% de los casos). También puede ocurrir una combinación de estos dos patrones o las personas pueden comenzar en un curso de recaídas y remisiones que luego se vuelve progresivo más adelante.
Las recaídas generalmente no son predecibles y ocurren sin previo aviso. Las exacerbaciones rara vez ocurren con más frecuencia que dos veces al año. Sin embargo, algunas recaídas están precedidas por desencadenantes comunes y ocurren con mayor frecuencia durante la primavera y el verano. Del mismo modo, las infecciones virales como el resfriado común, la gripe o la gastroenteritis aumentan su riesgo. El estrés también puede desencadenar un ataque. Las mujeres con EM que quedan embarazadas experimentan menos recaídas; sin embargo, durante los primeros meses después del parto el riesgo aumenta. En general, el embarazo no parece influir en la discapacidad a largo plazo. Se ha encontrado que muchos eventos no afectan las tasas de recaída, incluidas la vacunación, la lactancia materna, el trauma físico y el fenómeno de Uhthoff.
Fase prodrómica
La EM puede tener una fase prodrómica en los años previos a la manifestación de la EM, caracterizada por problemas psiquiátricos, deterioro cognitivo y una mayor utilización de la atención médica.
Causas
Se desconoce la causa de la EM, pero se cree que se debe a una combinación de factores genéticos y ambientales, como agentes infecciosos.
Agentes infecciosos
Se han propuesto muchos microbios como desencadenantes de la EM. Una hipótesis es que la infección por un microbio generalizado contribuye al desarrollo de la enfermedad, y la distribución geográfica de este organismo influye significativamente en la epidemiología de la EM. Dos versiones opuestas de esta hipótesis incluyen la hipótesis de la higiene y la hipótesis de la prevalencia, siendo la primera la más favorecida. La hipótesis de la higiene propone que la exposición temprana a ciertos agentes infecciosos es protectora; la enfermedad es una respuesta a un encuentro tardío con dichos agentes. La hipótesis de la prevalencia propone que una infección temprana, persistente y silenciosa aumenta el riesgo de enfermedad, por lo que la enfermedad es más común donde el agente infeccioso es más común. Solo en unos pocos casos y después de muchos años provoca desmielinización. La evidencia de un virus como causa incluye la presencia de bandas oligoclonales en el cerebro y el líquido cefalorraquídeo de la mayoría de las personas con EM, la asociación de varios virus con la encefalomielitis desmielinizante humana y la aparición de desmielinización en animales causada por algunas infecciones virales.
El virus del herpes de Epstein-Barr (EBV) puede causar mononucleosis infecciosa e infecta a aproximadamente el 95 % de los adultos. En combinación con otros factores genéticos y ambientales, existe "evidencia epidemiológica y mecanicista convincente de un papel causal del EBV en la esclerosis múltiple", aunque solo una pequeña proporción de las personas infectadas con EBV desarrollan EM posteriormente. Un estudio de personas en el ejército de los Estados Unidos entre 1993 y 2013 (población total superior a 10 millones) comparó 801 personas que desarrollaron EM durante o después del servicio militar con 1566 controles emparejados que no desarrollaron EM durante este período de observación. El estudio encontró un riesgo 32 veces mayor de desarrollar EM después de la infección con EBV. No encontró un mayor riesgo después de la infección con otros virus, incluido el citomegalovirus transmitido de manera similar. El hallazgo sugiere fuertemente que el EBV juega un papel en la aparición de la EM, aunque el EBV por sí solo puede ser insuficiente para causarla.
Genética
La EM no se considera una enfermedad hereditaria, pero se ha demostrado que varias variaciones genéticas aumentan el riesgo. Algunos de estos genes parecen tener niveles más altos de expresión en las células microgliales de lo esperado por casualidad. La probabilidad de desarrollar la enfermedad es mayor en los familiares de una persona afectada, siendo mayor el riesgo entre los más cercanos. Un gemelo idéntico de una persona afectada tiene un 30 % de posibilidades de desarrollar EM, un 5 % para un gemelo no idéntico, un 2,5 % para un hermano y una probabilidad aún menor para un medio hermano. Si ambos padres están afectados, el riesgo en sus hijos es 10 veces mayor que el de la población general. La EM también es más común en algunos grupos étnicos que en otros.
Los genes específicos que se han relacionado con la EM incluyen diferencias en el sistema del antígeno leucocitario humano (HLA), un grupo de genes en el cromosoma 6 que sirve como complejo principal de histocompatibilidad (MHC). Desde la década de 1980 se sabe que las diferencias en la región HLA están relacionadas con la susceptibilidad, y esta misma región también se ha implicado en el desarrollo de otras enfermedades autoinmunes, como la diabetes tipo I y el lupus eritematoso sistémico. El hallazgo más consistente es la asociación entre la esclerosis múltiple y los alelos del MHC definidos como DR15 y DQ6. Otros loci han mostrado un efecto protector, como HLA-C554 y HLA-DRB1*11. Las diferencias de HLA representan aproximadamente del 20 al 60% de la predisposición genética. Los métodos genéticos modernos (estudios de asociación del genoma completo) han revelado al menos 200 variantes fuera del locus HLA que aumentan modestamente la probabilidad de EM.
Geografía
La EM es más común en personas que viven más lejos del ecuador, aunque existen excepciones. Estas excepciones incluyen grupos étnicos que tienen un riesgo bajo y que viven lejos del ecuador, como los sami, los amerindios, los huteritas canadienses, los maoríes de Nueva Zelanda y los inuit de Canadá, así como grupos que tienen un riesgo relativamente alto y que viven más cerca del ecuador, como los sardos, los sicilianos del interior, los palestinos y los parsis. La causa de este patrón geográfico no está clara. Si bien el gradiente de incidencia norte-sur está disminuyendo, a partir de 2010 todavía está presente.
La EM es más común en regiones con poblaciones del norte de Europa, por lo que la variación geográfica puede reflejar simplemente la distribución global de estas poblaciones de alto riesgo.
Una relación entre la estación del nacimiento y la EM respalda esta idea, con menos personas nacidas en el hemisferio norte en noviembre en comparación con mayo que se ven afectadas más adelante en la vida.
Los factores ambientales pueden jugar un papel durante la infancia, con varios estudios que encuentran que las personas que se mudan a una región diferente del mundo antes de los 15 años adquieren el riesgo de EM de la nueva región. Si la migración se produce después de los 15 años, las personas conservan el riesgo de su país de origen. Cierta evidencia indica que el efecto de mudarse aún puede aplicarse a personas mayores de 15 años.
Otro
Fumar puede ser un factor de riesgo independiente para la EM. El estrés puede ser un factor de riesgo, aunque la evidencia que lo respalda es débil. Se evaluó la asociación con exposiciones ocupacionales y toxinas, principalmente solventes orgánicos, pero no se llegó a conclusiones claras. Las vacunas se estudiaron como factores causales; la mayoría de los estudios, sin embargo, no muestran asociación. Se han evaluado varios otros posibles factores de riesgo, como la dieta y la ingesta de hormonas, pero la evidencia sobre su relación con la enfermedad es "escasa y poco convincente". La gota ocurre menos de lo esperado y se han encontrado niveles más bajos de ácido úrico en personas con EM. Esto ha llevado a la teoría de que el ácido úrico es protector, aunque se desconoce su importancia exacta. La obesidad durante la adolescencia y la edad adulta joven es un factor de riesgo para la EM.
Fisiopatología
Las tres características principales de la EM son la formación de lesiones en el sistema nervioso central (también llamadas placas), la inflamación y la destrucción de las vainas de mielina de las neuronas. Estas características interactúan de una manera compleja y aún no completamente comprendida para producir la descomposición del tejido nervioso y, a su vez, los signos y síntomas de la enfermedad. Se cree que los cristales de colesterol alteran la reparación de la mielina y agravan la inflamación. Se cree que la EM es un trastorno inmunomediado que se desarrolla a partir de una interacción de la genética del individuo y causas ambientales aún no identificadas. Se cree que el daño es causado, al menos en parte, por el ataque al sistema nervioso por parte del propio sistema inmunitario de una persona.
Lesiones
El nombre esclerosis múltiple hace referencia a las cicatrices (escleróticas, mejor conocidas como placas o lesiones) que se forman en el sistema nervioso. Estas lesiones afectan con mayor frecuencia a la sustancia blanca del nervio óptico, el tronco encefálico, los ganglios basales y la médula espinal, o los tractos de sustancia blanca cercanos a los ventrículos laterales. La función de las células de materia blanca es transportar señales entre las áreas de materia gris, donde se realiza el procesamiento, y el resto del cuerpo. El sistema nervioso periférico rara vez se ve afectado.
Para ser específicos, la EM implica la pérdida de oligodendrocitos, las células responsables de crear y mantener una capa de grasa, conocida como vaina de mielina, que ayuda a las neuronas a transportar señales eléctricas (potenciales de acción). Esto da como resultado un adelgazamiento o pérdida completa de mielina y, a medida que avanza la enfermedad, la ruptura de los axones de las neuronas. Cuando se pierde la mielina, una neurona ya no puede conducir señales eléctricas de manera efectiva. Un proceso de reparación, llamado remielinización, tiene lugar en las primeras fases de la enfermedad, pero los oligodendrocitos no pueden reconstruir por completo la vaina de mielina de la célula. Los ataques repetidos conducen a remielinizaciones cada vez menos efectivas, hasta que se acumula una placa similar a una cicatriz alrededor de los axones dañados. Estas cicatrices son el origen de los síntomas y durante un ataque la resonancia magnética nuclear (RMN) suele mostrar más de 10 placas nuevas. Esto podría indicar que existe una serie de lesiones por debajo de las cuales el cerebro es capaz de repararse a sí mismo sin producir consecuencias notorias. Otro proceso involucrado en la creación de lesiones es un aumento anormal en el número de astrocitos debido a la destrucción de las neuronas cercanas. Se han descrito varios patrones de lesiones.
Inflamación
Además de la desmielinización, el otro signo de la enfermedad es la inflamación. Con una explicación inmunológica, el proceso inflamatorio es causado por las células T, un tipo de linfocitos que juega un papel importante en las defensas del organismo. Las células T logran ingresar al cerebro como resultado de interrupciones en la barrera hematoencefálica. Las células T reconocen la mielina como extraña y la atacan, lo que explica por qué estas células también se denominan "linfocitos autorreactivos".
El ataque a la mielina inicia procesos inflamatorios, que desencadenan otras células inmunitarias y la liberación de factores solubles como citoquinas y anticuerpos. A su vez, una mayor ruptura de la barrera hematoencefálica provoca una serie de otros efectos dañinos, como hinchazón, activación de macrófagos y más activación de citocinas y otras proteínas destructivas. La inflamación puede reducir potencialmente la transmisión de información entre neuronas en al menos tres formas. Los factores solubles liberados podrían detener la neurotransmisión de las neuronas intactas. Estos factores podrían provocar o aumentar la pérdida de mielina, o pueden causar que el axón se rompa por completo.
Barrera hematoencefálica
La barrera hematoencefálica (BBB, por sus siglas en inglés) es una parte del sistema capilar que impide la entrada de células T en el sistema nervioso central. Puede volverse permeable a este tipo de células como consecuencia de una infección por un virus o una bacteria. Después de que se repara a sí mismo, por lo general una vez que la infección ha desaparecido, las células T pueden quedar atrapadas dentro del cerebro. El gadolinio no puede cruzar una BBB normal, por lo que se usa una resonancia magnética realzada con gadolinio para mostrar rupturas de la BBB.
Diagnóstico
La esclerosis múltiple generalmente se diagnostica en función de los signos y síntomas de presentación, en combinación con pruebas de laboratorio e imágenes médicas de apoyo. Puede ser difícil de confirmar, especialmente al principio, ya que los signos y síntomas pueden ser similares a los de otros problemas médicos.
Los criterios de McDonald, que se enfocan en la evidencia clínica, de laboratorio y radiológica de las lesiones en diferentes momentos y en diferentes áreas, es el método de diagnóstico más comúnmente utilizado, y los criterios de Schumacher y Poser tienen mayor importancia histórica.
A partir de 2017, ninguna prueba (incluida la biopsia) por sí sola puede proporcionar un diagnóstico definitivo.
Las imágenes por resonancia magnética (IRM) del cerebro y la columna vertebral pueden mostrar áreas de desmielinización (lesiones o placas). El gadolinio se puede administrar por vía intravenosa como agente de contraste para resaltar las placas activas y, por eliminación, demostrar la existencia de lesiones históricas no asociadas con síntomas al momento de la evaluación.
Los signos de la vena central (CVS) se han propuesto como un buen indicador de la EM en comparación con otras afecciones que causan lesiones blancas. Un pequeño estudio encontró menos CVS en personas mayores e hipertensas. Se están realizando más investigaciones sobre el CVS como biomarcador de la EM.
La atrofia cerebral se considera un indicador de EM.
Las pruebas de líquido cefalorraquídeo obtenido de una punción lumbar pueden proporcionar evidencia de inflamación crónica en el sistema nervioso central. El líquido cefalorraquídeo se analiza en busca de bandas oligoclonales de IgG en la electroforesis, que son marcadores de inflamación que se encuentran en el 75-85 % de las personas con EM.
Diagnóstico diferencial
Varias enfermedades se presentan de manera similar a la esclerosis múltiple. Los vómitos intratables, la neuritis óptica grave o la neuritis óptica bilateral hacen sospechar un trastorno del espectro de la neuromielitis óptica (NMOSD, por sus siglas en inglés). La afectación de múltiples nervios craneales hace sospechar de neurosarcoidosis. La mielitis transversa longitudinalmente extensa (LETM), en la que el daño de la médula espinal abarca tres o más segmentos vertebrales, genera sospechas de NMOSD, neurosarcoidosis, mielitis asociada a anti-MOG, enfermedad reumatológica sistémica o un trastorno paraneoplásico.
Tipos y variantes
Se han descrito varios fenotipos (comúnmente denominados "tipos") o patrones de progresión. Los fenotipos utilizan el curso pasado de la enfermedad en un intento de predecir el curso futuro. Son importantes no solo para el pronóstico, sino también para las decisiones de tratamiento.
El Comité Asesor Internacional sobre Ensayos Clínicos de EM describe cuatro tipos de EM (revisada en 2013) en lo que se conoce como la clasificación de Lublin:
- Síndrome clínico aislado (CIS)
- Relapsing-remitting MS (RRMS)
- MS progresiva primaria (PPMS)
- MS progresiva secundaria (SMS)
RRMS se caracteriza por recaídas impredecibles seguidas de períodos de meses a años de relativa calma (remisión) sin nuevos signos de actividad de la enfermedad. Los déficits que ocurren durante los ataques pueden resolver o dejar problemas, esto último en alrededor del 40% de los ataques y siendo más común cuanto más tiempo la persona ha tenido la enfermedad. Esto describe el curso inicial del 80% de las personas con EM.
El subtipo recurrente-remitente generalmente comienza con un síndrome clínicamente aislado (CIS). En CIS, una persona tiene un ataque que sugiere desmielinización, pero no cumple con los criterios de esclerosis múltiple. Del 30 al 70% de las personas que experimentan CIS, luego desarrollan EM.
PPMS ocurre en aproximadamente el 10-20 % de las personas con la enfermedad, sin remisión después de los síntomas iniciales. Se caracteriza por la progresión de la discapacidad desde el inicio, sin remisiones y mejoras, o solo ocasionalmente y de menor importancia. La edad habitual de aparición del subtipo progresivo primario es más tardía que la del subtipo remitente-recurrente. Es similar a la edad a la que suele comenzar la secundaria progresiva en la EMRR, alrededor de los 40 años.
La EMSP se produce en alrededor del 65 % de las personas con RRMS inicial, que finalmente tienen un deterioro neurológico progresivo entre los ataques agudos sin períodos definidos de remisión. Pueden aparecer recaídas ocasionales y remisiones menores. El tiempo más común entre el inicio de la enfermedad y la conversión de RRMS a SPMS es de 19 años.
Cursos especiales
Independientemente de los tipos publicados por las asociaciones de EM, las agencias reguladoras como la FDA a menudo consideran cursos especiales, tratando de reflejar algunos resultados de ensayos clínicos en sus documentos de aprobación. Algunos ejemplos podrían ser "EM altamente activa" (HAMS), "MS secundaria activa" (similar al antiguo progresivo-recidivante) y "PPMS que progresa rápidamente".
Además, los déficits que siempre se resuelven entre ataques a veces se denominan "benignos" EM, aunque las personas siguen acumulando algún grado de discapacidad a largo plazo. Por otro lado, el término esclerosis múltiple maligna se utiliza para describir a las personas con EM que han alcanzado un nivel significativo de discapacidad en un período breve.
Un panel internacional ha publicado una definición estandarizada para el curso HAMS.
Variantes
Se han descrito variantes atípicas de la EM; estos incluyen la esclerosis múltiple tumefacta, la esclerosis concéntrica de Balo, la esclerosis difusa de Schilder y la esclerosis múltiple de Marburg. Sigue habiendo debate sobre si se trata de variantes de la EM o de enfermedades diferentes. Algunas enfermedades que antes se consideraban variantes de la EM, como la enfermedad de Devic, ahora se consideran fuera del espectro de la EM.
Administración
Aunque no se ha encontrado una cura para la esclerosis múltiple, varias terapias han resultado útiles. Varios tratamientos efectivos pueden disminuir significativamente el número de ataques y la tasa de progresión. Los objetivos principales de la terapia son recuperar la función después de un ataque, prevenir nuevos ataques y prevenir la discapacidad. En general, se recomienda comenzar con los medicamentos en personas después del primer ataque cuando se observan más de dos lesiones en la resonancia magnética.
Los medicamentos más antiguos que se usaban para tratar la EM eran modestamente efectivos, podían tener efectos secundarios y se toleraban mal, pero se han introducido varias opciones de tratamiento con mejores perfiles de seguridad y tolerabilidad, lo que cambió el pronóstico de la EM. En la era del tratamiento, el 16 % de las personas con EM recurrente necesitaron un bastón para caminar después de 20 años.
Al igual que con cualquier tratamiento médico, los medicamentos utilizados en el tratamiento de la EM tienen varios efectos adversos. Algunas personas buscan tratamientos alternativos, a pesar de la escasez de evidencia que respalde su eficacia.
Ataques agudos
Durante los ataques sintomáticos, la administración de dosis altas de corticosteroides intravenosos, como la metilprednisolona, es la terapia habitual, y los corticosteroides orales parecen tener un perfil de eficacia y seguridad similar. Aunque son efectivos a corto plazo para aliviar los síntomas, los tratamientos con corticosteroides no parecen tener un impacto significativo en la recuperación a largo plazo. El beneficio a largo plazo no está claro en la neuritis óptica a partir de 2020. Las consecuencias de los ataques graves que no responden a los corticosteroides podrían tratarse mediante plasmaféresis.
Tratamientos modificadores de la enfermedad
Esclerosis múltiple remitente recurrente
A partir de 2021, las agencias reguladoras aprobaron múltiples medicamentos modificadores de la enfermedad para RRMS; son modestamente efectivos para disminuir el número de ataques. Los interferones y el acetato de glatirámero son tratamientos de primera línea y son aproximadamente equivalentes, lo que reduce las recaídas en aproximadamente un 30 %. La terapia a largo plazo de inicio temprano es segura y mejora los resultados.
El tratamiento del CIS con interferones disminuye la posibilidad de progresar a EM clínica. Se ha estimado que la eficacia de los interferones y el acetato de glatirámero en niños es aproximadamente equivalente a la de los adultos. El papel de algunos agentes más nuevos, como fingolimod, teriflunomida y dimetilfumarato, aún no está del todo claro. Es difícil establecer conclusiones firmes acerca del mejor tratamiento, especialmente con respecto al beneficio a largo plazo y la seguridad del tratamiento temprano, dada la falta de estudios que comparen directamente las terapias modificadoras de la enfermedad o la monitorización a largo plazo de los resultados de los pacientes.
La efectividad relativa de los diferentes tratamientos no está clara, ya que la mayoría solo se ha comparado con un placebo o con una pequeña cantidad de otras terapias. Las comparaciones directas de los interferones y el acetato de glatirámero indican efectos similares o solo pequeñas diferencias en los efectos sobre la tasa de recaída, la progresión de la enfermedad y las medidas de resonancia magnética. El alemtuzumab, el natalizumab y el fingolimod pueden ser más efectivos que otros fármacos para reducir las recaídas a corto plazo en pacientes con EMRR. El natalizumab y el interferón beta-1a (Rebif) pueden reducir las recaídas en comparación con el placebo y el interferón beta-1a (Avonex), mientras que el interferón beta-1b (Betaseron), el acetato de glatiramer y la mitoxantrona también pueden prevenir las recaídas. La evidencia sobre la efectividad relativa para reducir la progresión de la discapacidad no está clara. Todos los medicamentos están asociados con efectos adversos que pueden influir en sus perfiles de riesgo a beneficio.
Ublituximab fue aprobado para uso médico en los Estados Unidos en diciembre de 2022.
Esclerosis múltiple progresiva
Hasta 2011, solo se había aprobado un medicamento, la mitoxantrona, para la EM progresiva secundaria. En esta población, la evidencia tentativa respalda que la mitoxantrona ralentiza moderadamente la progresión de la enfermedad y disminuye las tasas de recaídas durante dos años.
A partir de 2013, la revisión de 9 inmunomoduladores e inmunosupresores no encontró evidencia de que alguno sea efectivo para prevenir la progresión de la discapacidad en personas con EM progresiva.
En marzo de 2017, la FDA aprobó ocrelizumab como tratamiento para la EM progresiva primaria en adultos, el primer fármaco en obtener esa aprobación, con requisitos para varios ensayos clínicos de fase IV. También se utiliza para el tratamiento de formas recidivantes de esclerosis múltiple, que incluyen el síndrome clínicamente aislado, la enfermedad remitente-recidivante y la enfermedad progresiva secundaria activa en adultos.
En 2019, siponimod y cladribina fueron aprobados en los Estados Unidos para el tratamiento de la esclerosis múltiple progresiva secundaria.
Efectos adversos
Los tratamientos modificadores de la enfermedad tienen varios efectos adversos. Uno de los más comunes es la irritación en el lugar de la inyección del acetato de glatirámero y los interferones (hasta un 90 % con inyecciones subcutáneas y un 33 % con inyecciones intramusculares). Con el tiempo, se puede desarrollar una abolladura visible en el lugar de la inyección debido a la destrucción local del tejido graso, conocida como lipoatrofia. Los interferones pueden producir síntomas similares a los de la gripe; algunas personas que toman glatiramer experimentan una reacción posterior a la inyección con sofocos, opresión en el pecho, palpitaciones y ansiedad, que generalmente dura menos de treinta minutos. Más peligrosos pero mucho menos comunes son el daño hepático por los interferones, la disfunción sistólica (12 %), la infertilidad y la leucemia mieloide aguda (0,8 %) por la mitoxantrona, y la leucoencefalopatía multifocal progresiva que ocurre con el natalizumab (que ocurre en 1 de cada 600 personas tratadas).
El fingolimod puede provocar hipertensión y frecuencia cardíaca más lenta, edema macular, enzimas hepáticas elevadas o una reducción en los niveles de linfocitos. La evidencia provisional respalda la seguridad a corto plazo de la teriflunomida, con efectos secundarios comunes que incluyen: dolores de cabeza, fatiga, náuseas, pérdida de cabello y dolor en las extremidades. También ha habido informes de insuficiencia hepática y LMP con su uso y es peligroso para el desarrollo fetal. Los efectos secundarios más comunes del dimetilfumarato son sofocos y problemas gastrointestinales. Si bien el dimetilfumarato puede conducir a una reducción en el recuento de glóbulos blancos, no se informaron casos de infecciones oportunistas durante los ensayos.
Síntomas asociados
Se ha demostrado que tanto los medicamentos como la neurorrehabilitación mejoran algunos síntomas, aunque ninguno cambia el curso de la enfermedad. Algunos síntomas responden bien a la medicación, como la espasticidad de la vejiga, mientras que otros cambian poco. Equipos como catéteres para vejiga neurógena o ayudas para la movilidad pueden ser útiles para mejorar el estado funcional.
Un enfoque multidisciplinario es importante para mejorar la calidad de vida; sin embargo, es difícil especificar un 'equipo central' ya que pueden necesitarse muchos servicios de salud en diferentes momentos. Los programas de rehabilitación multidisciplinares aumentan la actividad y la participación de las personas con EM pero no influyen en el nivel de deterioro. Los estudios que investigan el suministro de información para apoyar la comprensión y la participación del paciente indican que, si bien las intervenciones (información escrita, ayudas para la toma de decisiones, orientación, programas educativos) pueden aumentar el conocimiento, la evidencia de un efecto sobre la toma de decisiones y la calidad de vida es mixta y de certeza baja. Hay evidencia limitada de la eficacia general de las disciplinas terapéuticas individuales, aunque hay buena evidencia de que los enfoques específicos, como el ejercicio y las terapias psicológicas, son efectivos. El entrenamiento cognitivo, solo o combinado con otras intervenciones neuropsicológicas, puede mostrar efectos positivos para la memoria y la atención, aunque no es posible establecer conclusiones firmes dado el pequeño número de muestras, la metodología variable, las intervenciones y las medidas de resultado. La efectividad de los enfoques paliativos además de la atención estándar es incierta debido a la falta de pruebas. La efectividad de las intervenciones, incluido el ejercicio, específicamente para la prevención de caídas en pacientes con EM es incierta, aunque hay algunas pruebas de un efecto sobre la función del equilibrio y la movilidad. La terapia cognitiva conductual ha demostrado ser moderadamente efectiva para reducir la fatiga de la EM. La evidencia de la efectividad de las intervenciones no farmacológicas para el dolor crónico es insuficiente para recomendar dichas intervenciones solas; sin embargo, su uso en combinación con medicamentos puede ser razonable.
No farmacéutico
Existe alguna evidencia de que la terapia acuática es una intervención beneficiosa.
La espasticidad asociada con la EM puede ser difícil de manejar debido al curso progresivo y fluctuante de la enfermedad. Aunque no hay una conclusión firme sobre la eficacia para reducir la espasticidad, las intervenciones de PT pueden ser una opción segura y beneficiosa para los pacientes con esclerosis múltiple. La fisioterapia, incluidas las intervenciones de vibración, la estimulación eléctrica, la terapia de ejercicios, la terapia de pie y la terapia de ondas de choque radiales (RSWT), fueron beneficiosas para limitar la espasticidad, ayudar a limitar la excitabilidad o aumentar el rango de movimiento.
Tratamientos alternativos
Más del 50 % de las personas con EM pueden usar medicina complementaria y alternativa, aunque los porcentajes varían según se defina la medicina alternativa. En cuanto a las características de los usuarios, son más frecuentes las mujeres, tienen más tiempo de EM, tienden a ser más discapacitados y tienen niveles más bajos de satisfacción con la atención médica convencional. La evidencia de la efectividad de tales tratamientos en la mayoría de los casos es débil o inexistente. Los tratamientos de beneficio no comprobado utilizados por personas con EM incluyen suplementos y regímenes dietéticos, vitamina D, técnicas de relajación como yoga, hierbas medicinales (incluido el cannabis medicinal), oxigenoterapia hiperbárica, autoinfección con anquilostomas, reflexología, acupuntura y atención plena. La evidencia sugiere que la suplementación con vitamina D, independientemente de la forma y la dosis, no proporciona ningún beneficio para las personas con EM; esto incluye medidas como la recurrencia de la recaída, la discapacidad y las lesiones por IRM, mientras que los efectos sobre la calidad de vida relacionada con la salud y la fatiga no están claros. No hay pruebas suficientes que respalden la biotina en dosis altas y algunas pruebas de una mayor actividad de la enfermedad y un mayor riesgo de recaída con su uso.
Pronóstico
La disponibilidad de tratamientos que modifican el curso de la esclerosis múltiple a partir de la década de 1990, conocidos como terapias modificadoras de la enfermedad (DMT), ha mejorado el pronóstico. Estos tratamientos pueden reducir las recaídas y la progresión lenta, pero a partir de 2022 no existe una cura.
El pronóstico de la EM depende del subtipo de la enfermedad y también existe una gran variación individual en la progresión de la enfermedad. En la EM recurrente, que es el subtipo más común, un estudio de cohorte de 2016 encontró que después de una mediana de 16,8 años desde el inicio, una de cada diez personas con EM recurrente necesitaba una ayuda para caminar, y casi dos de cada diez hicieron la transición a la EM secundaria progresiva. una forma caracterizada por un declive más progresivo. Con los tratamientos disponibles en la década de 2020, las recaídas pueden eliminarse o reducirse sustancialmente. Sin embargo, la "progresión silenciosa" de la enfermedad todavía se produce.
Además de la EM progresiva secundaria (SPMS), una pequeña proporción de personas con EM (10-15 %) experimentan un declive progresivo desde el inicio, lo que se conoce como EM progresiva primaria (EMPP). La mayoría de los tratamientos han sido aprobados para su uso en la EM recurrente; existen tratamientos efectivos limitados para las formas progresivas de EM, y los tratamientos no son tan efectivos. El pronóstico de la EM progresiva es peor, con una acumulación más rápida de discapacidad, aunque la tasa de disminución varía considerablemente entre las personas. En la EMPP no tratada, la mediana de tiempo desde el inicio hasta la necesidad de una ayuda para caminar se estima en siete años. En SPMS, un estudio de cohorte de 2014 informó que las personas requerían una ayuda para caminar después de un promedio de cinco años desde el inicio de SPMS, y estaban postradas en una silla o en la cama después de un promedio de quince años.
Tras el diagnóstico de EM, las características que predicen una peor evolución son el sexo masculino, la mayor edad y una mayor discapacidad en el momento del diagnóstico. Sin embargo, el sexo femenino se asocia con una mayor tasa de recaída. A partir de 2018, ningún biomarcador puede predecir con precisión la progresión de la enfermedad en todos los pacientes. Las lesiones de la médula espinal, las anomalías en la resonancia magnética y más atrofia cerebral predicen un peor curso, aunque la atrofia cerebral como predictor del curso de la enfermedad es experimental y no se usa en la práctica clínica a partir de 2018. El tratamiento temprano conduce a un mejor pronóstico, pero un una mayor frecuencia de recaídas cuando se trata con DMT se asocia con un peor pronóstico.
Epidemiología
La EM es el trastorno autoinmune más común del sistema nervioso central. A partir de 2022, hay casi un millón de casos conocidos de esclerosis múltiple en los Estados Unidos. En 2020, el número de personas con EM fue de 2,8 millones en todo el mundo, con tasas que varían ampliamente en las diferentes regiones. En África, las tasas son inferiores a 0,5 por 100 000, mientras que en el sudeste asiático son de 2,8 por 100 000, 8,3 por 100 000 en las Américas y 80 por 100 000 en Europa. Las tasas superan los 200 por 100.000 en ciertas poblaciones de ascendencia del norte de Europa. El número de casos nuevos que se desarrollan por año es de aproximadamente 2,5 por 100.000.
El aumento de las tasas de EM puede explicarse simplemente por un mejor diagnóstico. Los estudios sobre patrones poblacionales y geográficos han sido comunes y han dado lugar a una serie de teorías sobre la causa.
La EM suele aparecer en adultos a finales de los veinte o principios de los treinta, pero rara vez puede comenzar en la infancia y después de los 50 años. El subtipo progresivo primario es más común en personas de 50 años. De manera similar a muchos trastornos autoinmunes, la enfermedad es más común en mujeres y la tendencia puede ir en aumento. A partir de 2008, a nivel mundial es aproximadamente dos veces más común en mujeres que en hombres. En los niños, es incluso más común en mujeres que en hombres, mientras que en personas mayores de cincuenta años, afecta a hombres y mujeres casi por igual.
Historia
Descubrimiento médico
Robert Carswell (1793–1857), profesor británico de patología, y Jean Cruveilhier (1791–1873), profesor francés de anatomía patológica, describieron e ilustraron muchos de los detalles clínicos de la enfermedad, pero no identificarlo como una enfermedad separada. Específicamente, Carswell describió las lesiones que encontró como 'una lesión notable de la médula espinal acompañada de atrofia'. Bajo el microscopio, el patólogo suizo Georg Eduard Rindfleisch (1836–1908) observó en 1863 que las lesiones asociadas con la inflamación se distribuían alrededor de los vasos sanguíneos.
El neurólogo francés Jean-Martin Charcot (1825–1893) fue la primera persona en reconocer la esclerosis múltiple como una enfermedad distinta en 1868. Resumiendo informes anteriores y agregando sus propias observaciones clínicas y patológicas, Charcot llamó a la enfermedad esclerosis en placas.
Historial de diagnóstico
El primer intento de establecer un conjunto de criterios diagnósticos también se debió a Charcot en 1868. Publicó lo que ahora se conoce como la "Tríada de Charcot", que consiste en nistagmo, temblor de intención y habla telegráfica (escanear el habla). Charcot también observó cambios cognitivos y describió a sus pacientes como que tenían un "marcado debilitamiento de la memoria". y "conceptos que se formaron lentamente".
El diagnóstico se basaba en la tríada de Charcot y la observación clínica hasta que Schumacher hizo el primer intento de estandarizar criterios en 1965 introduciendo unos requisitos fundamentales: Diseminación de las lesiones en el tiempo (DIT) y espacio (DIS), y que " los signos y síntomas no pueden explicarse mejor por otro proceso patológico". El requisito DIT y DIS fue heredado posteriormente por los criterios Poser y McDonald, cuya revisión de 2017 está en uso.
Durante el siglo XX, se desarrollaron teorías sobre la causa y la patogenia y en la década de 1990 comenzaron a aparecer tratamientos efectivos. Desde principios del siglo XXI, se han producido refinamientos de los conceptos. La revisión de 2010 de los criterios de McDonald permitió el diagnóstico de EM con una sola lesión comprobada (CIS).
En 1996, la Sociedad Nacional de Esclerosis Múltiple (NMSS) de los EE. UU. (Comité Asesor de Ensayos Clínicos) definió la primera versión de los fenotipos clínicos que está en uso. En esta primera versión, proporcionaron definiciones estandarizadas para cuatro cursos clínicos de EM: recurrente-remitente (RR), secundaria progresiva (SP), primaria progresiva (PP) y progresiva recurrente (PR). En 2010, se eliminó PR y se incorporó CIS. Tres años más tarde, la revisión de 2013 de los "fenotipos para el curso de la enfermedad" se vieron obligados a considerar el CIS como uno de los fenotipos de la EM, haciendo obsoletas algunas expresiones como "conversión de CIS a EM". Otras organizaciones han propuesto nuevos fenotipos clínicos posteriores, como HAMS (Highly Active MS).
Casos históricos
Hay varios relatos históricos de personas que probablemente tenían EM y vivieron antes o poco después de que Charcot describiera la enfermedad.
Una joven llamada Halldora que vivía en Islandia alrededor del año 1200 perdió repentinamente la visión y la movilidad, pero las recuperó siete días después. Santa Lidwina de Schiedam (1380–1433), una monja holandesa, puede ser una de las primeras personas claramente identificables con EM. Desde los 16 años hasta su muerte a los 53, tuvo dolores intermitentes, debilidad en las piernas y pérdida de la visión: síntomas típicos de la EM. Ambos casos han llevado a la propuesta de un "gen vikingo" hipótesis de diseminación de la enfermedad.
Augustus Frederick d'Este (1794–1848), hijo del príncipe Augustus Frederick, duque de Sussex y Lady Augusta Murray y nieto de Jorge III del Reino Unido, casi con certeza tenía esclerosis múltiple. D'Este dejó un diario detallado describiendo sus 22 años viviendo con la enfermedad. Su diario comenzó en 1822 y finalizó en 1846, aunque permaneció desconocido hasta 1948. Sus síntomas comenzaron a los 28 años con una repentina pérdida transitoria de la visión (amaurosis fugaz) tras el funeral de un amigo. Durante su enfermedad, desarrolló debilidad en las piernas, torpeza en las manos, entumecimiento, mareos, trastornos de la vejiga y disfunción eréctil. En 1844, comenzó a usar una silla de ruedas. A pesar de su enfermedad, mantuvo una visión optimista de la vida. El cronista británico W. N. P. Barbellion, seudónimo de Bruce Frederick Cummings (1889–1919), quien mantuvo un registro detallado de su diagnóstico y lucha, llevó otro relato temprano de la EM. Su diario se publicó en 1919 como Diario de un hombre desilusionado.
Investigación
Estudios en curso sobre el virus de Epstein-Barr
A partir de 2022, la patogenia de la EM en relación con el EBV se investiga activamente, al igual que las terapias modificadoras de la enfermedad; se busca la comprensión de cómo los factores de riesgo se combinan con EBV para iniciar la EM. Se podría comprender mejor si el EBV es la única causa de la EM si se desarrolla una vacuna contra el EBV y se demuestra que también previene la EM.
Aunque una variedad de estudios mostró la conexión entre una infección por EBV y un desarrollo posterior de esclerosis múltiple, los mecanismos detrás de esta correlación aún no están completamente claros. Aunque hay algunas teorías principales que explican más de cerca la relación entre las dos enfermedades. Se espera que la participación de las células B infectadas por EBV y la participación de los anticuerpos anti-EBNA, que parecen ser significativamente mayores en pacientes con esclerosis múltiple, desempeñen un papel crucial en el desarrollo de la enfermedad. Esto está respaldado por el hecho de que con el tratamiento contra las células B, p. a través de la terapia con Ocrelizumab, se mejorará el curso de los síntomas de la esclerosis múltiple. Las recaídas anuales aparecerán en menor proporción y la progresión de la discapacidad será más lenta. Un estudio liderado por una unidad de investigación de Stanford y publicado en 2022 ha demostrado que durante una infección por EBV puede ocurrir un mimetismo molecular, donde el sistema inmunitario producirá anticuerpos contra la proteína EBNA1, que al mismo tiempo es capaz de unirse a GlialCAM. en la mielina. Además, observaron un fenómeno que es poco común en individuos sanos pero que a menudo se detecta en pacientes con esclerosis múltiple: las células B se dirigen al cerebro y la médula espinal, donde producen bandas de anticuerpos oligoclonales. La mayoría de estas bandas oligoclonales tienen afinidad con la proteína viral EBNA1, que tiene reacción cruzada con GlialCAM. Estos anticuerpos son abundantes en aproximadamente el 20-25% de los pacientes con esclerosis múltiple y empeoran la desmielinización autoinmune que conduce en consecuencia a una exacerbación fisiopatológica de la enfermedad. Además, la expansión oligoclonal intratecal con una hipermutación somática constante es única en la esclerosis múltiple en comparación con otras enfermedades neuroinflamatorias. En el estudio también se midió la abundancia de anticuerpos con genes IGHV 3-7, lo que parece estar relacionado con el progreso de la enfermedad. Los anticuerpos basados en IGHV3–7 se unen con gran afinidad a EBNA1 y GlialCAM. Este proceso está prosperando activamente la desmielinización. Es probable que las células B, que expresan los genes IGHV 3-7 entraron en el LCR y sufrieron una maduración de afinidad después de enfrentarse a GlialCAM, lo que condujo en consecuencia a la producción de anticuerpos anti-GlialCAM de alta afinidad. Esto también se demostró en el modelo de ratón EAE donde la inmunización con EBNA1 condujo a una fuerte respuesta de células B contra GlialCAM, lo que empeoró la EAE.
Medicamentos
Los medicamentos que influyen en los canales de iones de sodio dependientes de voltaje están bajo investigación como una posible estrategia neuroprotectora debido al papel hipotético del sodio en el proceso patológico que conduce a la lesión axonal y la discapacidad acumulada. No hay pruebas suficientes de un efecto de los bloqueadores de los canales de sodio para las personas con EM.
Patogénesis
La EM es una entidad clínicamente definida con varias presentaciones atípicas. Se han encontrado algunos autoanticuerpos en casos de EM atípica, dando lugar a familias de enfermedades separadas y restringiendo el concepto anteriormente más amplio de EM.
Se encontraron autoanticuerpos anti-AQP4 en la neuromielitis óptica (NMO), que anteriormente se consideraba una variante de la EM. Se ha aceptado un espectro de enfermedades denominadas NMOSD (enfermedades del espectro NMO) o enfermedades anti-AQP4. Algunos casos de EM presentaban autoanticuerpos anti-MOG, principalmente superpuestos con la variante de Marburgo. Se encontró que los autoanticuerpos anti-MOG también estaban presentes en ADEM, y se está considerando un segundo espectro de enfermedades separadas. Este espectro se nombra de manera inconsistente entre diferentes autores, pero normalmente es algo similar a las enfermedades desmielinizantes anti-MOG.
Se acepta un tercer tipo de autoanticuerpos. Son varios autoanticuerpos anti-neurofascina que dañan los nódulos de Ranvier de las neuronas. Estos anticuerpos están más relacionados con la desmielinización del sistema nervioso periférico, pero también se encontraron en la EMPP progresiva crónica y en la desmielinización central y periférica combinada (CCPD, que se considera otra presentación atípica de la EM).
Además de la importancia de los autoanticuerpos en la EM, se han informado cuatro patrones diferentes de desmielinización, lo que abre la puerta a considerar la EM como una enfermedad heterogénea.
Biomarcadores de enfermedades
Dado que la progresión de la enfermedad es el resultado de la degeneración de las neuronas, se están investigando las funciones de las proteínas que muestran pérdida de tejido nervioso, como los neurofilamentos, la tau y el N-acetilaspartato.
La mejora en las técnicas de neuroimagen, como la tomografía por emisión de positrones (PET) o la resonancia magnética nuclear (RMN), promete mejores diagnósticos y pronósticos. En cuanto a la RM, existen varias técnicas que ya han demostrado cierta utilidad en el ámbito de la investigación y que podrían introducirse en la práctica clínica, como las secuencias de recuperación de doble inversión, la transferencia de magnetización, el tensor de difusión y la resonancia magnética funcional. Estas técnicas son más específicas para la enfermedad que las existentes, pero aún carecen de cierta estandarización de los protocolos de adquisición y creación de valores normativos. Este es particularmente el caso de la espectroscopia de resonancia magnética de protones, para la cual una serie de variaciones metodológicas observadas en la literatura pueden ser la base de inconsistencias continuas en las anomalías metabólicas del sistema nervioso central, particularmente en N-acetil aspartato, mioinositol, colina, glutamato, GABA y GSH., observado para la esclerosis múltiple y sus subtipos. Hay otras técnicas en desarrollo que incluyen agentes de contraste capaces de medir niveles de macrófagos periféricos, inflamación o disfunción neuronal, y técnicas que miden el depósito de hierro que podrían servir para determinar el papel de esta característica en la EM, o la de la perfusión cerebral.
COVID-19
Se encontró que la tasa de hospitalización era más alta entre las personas con EM e infección por COVID-19, con un 10 %, mientras que la tasa de infección combinada se estima en un 4 %. La prevalencia combinada de muerte en personas hospitalizadas con EM se estima en un 4 %.
Otras teorías emergentes
Una hipótesis emergente, conocida como la hipótesis de la higiene, sugiere que la exposición temprana a agentes infecciosos ayuda a desarrollar el sistema inmunitario y reduce la susceptibilidad a las alergias y los trastornos autoinmunes, incluida la EM. Los ratones libres de gérmenes infectados con materia fecal trasplantada de pacientes con EM muestran un mayor riesgo de desarrollar EAE, un modelo animal de EM. También se ha propuesto que ciertas bacterias que se encuentran en el intestino usan el mimetismo molecular para infiltrarse en el cerebro a través del eje intestino-cerebro, iniciando una respuesta inflamatoria y aumentando la permeabilidad de la barrera hematoencefálica. Los niveles de vitamina D también se han correlacionado con la EM; los niveles más bajos de vitamina D corresponden a un mayor riesgo de EM, lo que sugiere una prevalencia reducida en los trópicos, un área con más luz solar rica en vitamina D, lo que fortalece el impacto de la ubicación geográfica en el desarrollo de la EM. Los mecanismos de la EM comienzan cuando las células T CD4+ efectoras autorreactivas periféricas se activan y se mueven hacia el SNC. Las células presentadoras de antígenos localizan la reactivación de las células CD4-T efectoras autorreactivas una vez que han ingresado al SNC, atrayendo más células T y macrófagos para formar la lesión inflamatoria. En los pacientes con EM, los macrófagos y la microglía se ensamblan en lugares donde la desmielinización y la neurodegeneración están ocurriendo activamente, y la activación de la microglía es más evidente en la sustancia blanca de apariencia normal de los pacientes con EM. Los astrocitos generan sustancias químicas neurotóxicas como el óxido nítrico y el TNFα, atraen monocitos inflamatorios neurotóxicos al SNC y son responsables de la astrogliosis, la cicatrización que evita la propagación de la neuroinflamación y mata las neuronas dentro del área cicatrizada.
Contenido relacionado
Desorden del sueño
Desarrollo del sistema nervioso
Saco amniótico