Escisión del éter
La escisión del éter se refiere a las reacciones de sustitución química que conducen a la escisión de los éteres. Debido a la alta estabilidad química de los éteres, la ruptura del enlace CO es poco común en ausencia de reactivos especializados o en condiciones extremas.
En química orgánica, la escisión del éter es una reacción de sustitución nucleófila catalizada por ácido. Dependiendo del éter específico, la escisión puede seguir mecanismos S N 1 o S N 2. Distinguir entre ambos mecanismos requiere considerar los efectos inductivos y mesoméricos que podrían estabilizar o desestabilizar un carbocatión potencial en la vía S N 1. El uso de ácidos hidrohálicos aprovecha el hecho de que estos agentes pueden protonar el átomo de oxígeno del éter y también proporcionar un anión haluro como nucleófilo adecuado. Sin embargo, como los éteres muestran una basicidad similar a la de los alcoholes (pKa de aproximadamente 16), el equilibrio de protonación se encuentra del lado del éter no protonado y la escisión suele ser muy lenta a temperatura ambiente.
Los éteres se pueden escindir con agentes fuertemente básicos, por ejemplo, compuestos de organolitio. Los éteres cíclicos son especialmente susceptibles a la escisión, pero los éteres acíclicos también pueden escindirse.
S N 1 Escisión de éter

El mecanismo S N 1 unimolecular procede a través de un carbocatión (siempre que el carbocatión se pueda estabilizar adecuadamente). En el ejemplo, el átomo de oxígeno en el metil terc - butil éter está protonado de forma reversible. El ion oxonio resultante luego se descompone en metanol y un catión terc -butilo relativamente estable. Luego, este último es atacado por un haluro nucleófilo (aquí bromuro), lo que produce bromuro de terc -butilo.
Mecanismo

Escisión del éter S N 2

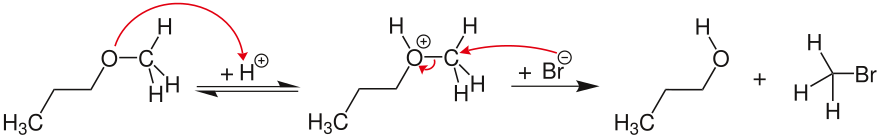
Si el carbocatión potencial no se puede estabilizar, la escisión del éter sigue un mecanismo S N 2 concertado bimolecular. En el ejemplo, el oxígeno del éter se protona reversiblemente. El ion haluro (aquí bromuro) luego ataca nucleofílicamente al átomo de carbono estéricamente menos impedido, formando así bromuro de metilo y 1-propanol.
Mecanismo
Otros factores
La escisión del éter S N 1 es generalmente más rápida que la escisión del éter S N 2. Sin embargo, las reacciones que requerirían la formación de carbocationes inestables (metilo, vinilo, arilo o carbono primario) proceden a través de S N2 mecanismo. El ácido hidrohálico también juega un papel importante, ya que la velocidad de reacción es mayor con el ácido yodhídrico que con el ácido bromhídrico. El ácido clorhídrico solo reacciona en condiciones más rigurosas. La razón radica en la mayor acidez de los ácidos hidrohálicos más pesados, así como en la mayor nucleofilia de la respectiva base conjugada. El fluoruro no es lo suficientemente nucleófilo como para permitir el uso de ácido fluorhídrico para escindir éteres en medios próticos. Independientemente de qué ácido hidrohálico se use, la velocidad de reacción es comparativamente baja, de modo que se requiere calentar la mezcla de reacción.
Desdoblamiento de éter con agentes organometálicos
Mecanismo
La escisión básica del éter se induce por desprotonación en la posición α. El éter luego se descompone en un alqueno y un alcóxido. Los éteres cíclicos permiten una escisión concertada especialmente rápida, como se ve en el THF:
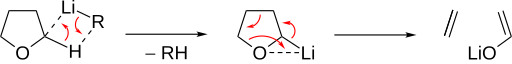
Los éteres acíclicos desprotonados realizan la eliminación de beta-hidruro, formando un éter olefínico. El hidruro formado ataca entonces el resto olefínico en posición α al oxígeno del éter, liberando el alcóxido.
Impacto
Los agentes organometálicos a menudo se manipulan en disolventes etéricos, que se coordinan con los centros metálicos y, por lo tanto, mejoran la reactividad de los restos orgánicos. Aquí, la escisión del éter plantea un problema, ya que no solo descompone el disolvente, sino que también consume el agente organometálico. Por lo tanto, las reacciones con agentes organometálicos se realizan normalmente a bajas temperaturas (-78 °C). A estas temperaturas, la desprotonación se inhibe cinéticamente y es lenta en comparación con muchas reacciones que se pretende que tengan lugar.
Contenido relacionado
Testosterona
Conteo de electrones
Cianuro de hidrógeno