Epóxido

En química orgánica, un epóxido es un éter cíclico, donde el éter forma un anillo de tres átomos: dos átomos de carbono y un átomo de oxígeno. Esta estructura triangular tiene una tensión sustancial en el anillo, lo que hace que los epóxidos sean altamente reactivos, más que otros éteres. Se producen a gran escala para muchas aplicaciones. En general, los epóxidos de bajo peso molecular son incoloros, no polares y, a menudo, volátiles.
Nomenclatura
Un compuesto que contiene el grupo funcional epóxido puede denominarse epoxi, epóxido, oxirano y etoxilina. Los epóxidos simples a menudo se denominan óxidos. Así, el epóxido de etileno (C2H4) es óxido de etileno (C2H4O). Muchos compuestos tienen nombres triviales; por ejemplo, el óxido de etileno se llama "oxirano". Algunos nombres enfatizan la presencia del grupo funcional epóxido, como en el compuesto 1,2-epoxiheptano, que también puede denominarse óxido de 1,2-hepteno.
Un polímero formado a partir de precursores de epóxido se llama epoxi, pero dichos materiales no contienen grupos epóxido (o contienen solo unos pocos grupos epoxi residuales que permanecen sin reaccionar en la formación de la resina).
Síntesis
Los epóxidos dominantes a nivel industrial son el óxido de etileno y el óxido de propileno, que se producen respectivamente en escalas de aproximadamente 15 y 3 millones de toneladas/año.
Oxidación de alquenos catalizada heterogéneamente
La epoxidación del etileno implica su reacción con el oxígeno. Según un mecanismo de reacción sugerido en 1974, al menos una molécula de etileno se oxida totalmente por cada seis que se convierten en óxido de etileno:
- 6 C2H4O + 2 CO2 + 2 H2O}}}" xmlns="http://www.w3.org/1998/Math/MathML">7H2C=CH2+6O2restablecimiento restablecimiento 6C2H4O+2CO2+2H2O{displaystyle {ce {7 H2C=CH2 + 6 O2 - titulada 6 C2H4O + 2 CO2 + 2 H2O}}}
6 C2H4O + 2 CO2 + 2 H2O}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/e02023bbe610060e15acf92840575950f8cd1c5d" style="vertical-align: -1.005ex; width:51.47ex; height:2.843ex;"/>
La reacción directa del oxígeno con los alquenos es útil sólo para este epóxido. Normalmente se emplean catalizadores de plata heterogéneos modificados. Otros alquenos no reaccionan de manera útil, ni siquiera el propileno, aunque los catalizadores de Au soportados por TS-1 pueden realizar la epoxidación del propileno de forma selectiva.
Oxidación de olefinas (alquenos) utilizando peróxidos orgánicos y catalizadores metálicos
Aparte del óxido de etileno, la mayoría de los epóxidos se generan tratando alquenos con reactivos que contienen peróxido, que donan un solo átomo de oxígeno. Las consideraciones de seguridad pesan sobre estas reacciones porque los peróxidos orgánicos son propensos a la descomposición espontánea o incluso a la combustión.
Los complejos metálicos son catalizadores útiles para epoxidaciones que involucran peróxido de hidrógeno e hidroperóxidos de alquilo. Los ácidos peroxicarboxílicos, que son más electrófilos, convierten los alquenos en epóxidos sin la intervención de catalizadores metálicos. En aplicaciones especializadas, se emplean otros reactivos que contienen peróxido, como el dimetildioxirano. Dependiendo del mecanismo de la reacción y de la geometría del material de partida alqueno, se pueden formar diastereómeros de epóxido cis y/o trans. Además, si hay otros estereocentros presentes en el material de partida, estos pueden influir en la estereoquímica de la epoxidación. Las epoxidaciones catalizadas por metales se exploraron por primera vez utilizando hidroperóxido de terc-butilo (TBHP). La asociación de TBHP con el metal (M) genera el complejo peroxi metálico activo que contiene el grupo MOOR, que luego transfiere un centro O al alqueno.
Los peróxidos orgánicos se utilizan para la producción de óxido de propileno a partir de propileno. También se requieren catalizadores. Como fuentes de oxígeno se pueden utilizar tanto hidroperóxido de t-butilo como hidroperóxido de etilbenceno.
Peroxidación de olefinas utilizando ácidos peroxicarboxílicos
Más típicamente para operaciones de laboratorio, se emplea la reacción de Prilezhaev. Este enfoque implica la oxidación del alqueno con un peroxiácido como m-CPBA. Es ilustrativa la epoxidación de estireno con ácido perbenzoico a óxido de estireno:
La reacción se produce a través de lo que comúnmente se conoce como el "mecanismo de mariposa". El peróxido se considera un electrófilo y el alqueno un nucleófilo. La reacción se considera concertada (los números en el mecanismo a continuación son para simplificar). El mecanismo de mariposa permite el posicionamiento ideal del orbital de la estrella sigma O−O para que ataquen los electrones π C−C. Debido a que dos enlaces se rompen y se forman con el oxígeno del epóxido, este es formalmente un ejemplo de un estado de transición coartado.
Los hidroperóxidos también se emplean en epoxidaciones enantioselectivas catalíticas, como la epoxidación de Sharpless y la epoxidación de Jacobsen. Junto con la epoxidación de Shi, estas reacciones son útiles para la síntesis enantioselectiva de epóxidos quirales. También se pueden utilizar reactivos de oxaziridina para generar epóxidos a partir de alquenos.
Epoxidaciones asimétricas catalizadas homogéneamente
Los óxidos de areno son intermediarios en la oxidación de arenos por el citocromo P450. Para los arenos proquirales (naftaleno, tolueno, benzoatos, benzopireno), los epóxidos se obtienen a menudo con una alta enantioselectividad.
Los epóxidos quirales a menudo pueden derivarse enantioselectivamente de alquenos proquirales. Muchos complejos metálicos dan catalizadores activos, pero los más importantes son el titanio, el vanadio y el molibdeno.
La reacción de epoxidación de Sharpless es una de las principales reacciones químicas enantioselectivas. Se utiliza para preparar 2,3-epoxialcoholes a partir de alcoholes alílicos primarios y secundarios.

Sustitución intramolecular SN2
Este método implica la deshidrohalogenación. Es una variante de la síntesis del éter de Williamson. En este caso, un ion alcóxido desplaza intramolecularmente al cloruro. Los compuestos precursores se denominan halohidrinas y pueden generarse mediante halohidratación de un alqueno. Comenzando con la clorhidrina de propileno, la mayor parte del suministro mundial de óxido de propileno surge a través de esta ruta.
Did you mean:And intramolecular epoxide formation reaction is one of the key steps in the Darzens reaction.
En la reacción de Johnson-Corey-Chaykovsky se generan epóxidos a partir de grupos carbonilo e iluros de sulfonio. En esta reacción, un sulfonio es el grupo saliente en lugar de cloruro.
Exoxidación nucleofílica
Las olefinas con deficiencia de electrones, como las enonas y los derivados acrílicos, se pueden epoxidar utilizando compuestos de oxígeno nucleofílicos como los peróxidos. La reacción es un mecanismo de dos pasos. Primero, el oxígeno realiza una adición de conjugado nucleofílico para dar un carbanión estabilizado. Este carbanión luego ataca al mismo átomo de oxígeno, desplazando un grupo saliente del mismo, para cerrar el anillo epóxido.
Biosíntesis
Los epóxidos son poco comunes en la naturaleza. Generalmente surgen a través de la oxigenación de alquenos por la acción del citocromo P450. (pero vea también los ácidos epoxieicosatrienoicos de vida corta que actúan como moléculas de señalización, y ácidos epoxicosapentaenoicos similares y ácidos epoxieicosatetraenoicos).
Reacciones
Las reacciones de apertura de anillo dominan la reactividad de los epóxidos.
Hidrólisis y adición de nucleófilos
Los epóxidos reaccionan con una amplia gama de nucleófilos, por ejemplo, alcoholes, agua, aminas, tioles e incluso haluros. Con dos sitios de ataque a menudo casi equivalentes, los epóxidos son ejemplos de "sustratos ambientales". La regioselectividad de la apertura del anillo en epóxidos asimétricos generalmente sigue el patrón de ataque SN2 en el carbono menos sustituido, pero puede verse afectada por la estabilidad de los carbocationes en condiciones ácidas. Esta clase de reacciones es la base de las colas epoxi y de la producción de glicoles.
Polimerización y oligomerización
La polimerización de epóxidos da poliéteres. Por ejemplo, el óxido de etileno se polimeriza para dar polietilenglicol, también conocido como óxido de polietileno. La reacción de un alcohol o un fenol con óxido de etileno, la etoxilación, se utiliza ampliamente para producir tensioactivos:
- ROH + n C2H4O → R(OC)2H4)nOh.
Con los anhídridos, los epóxidos dan poliésteres.
Desoxigenación
Los epóxidos se pueden desoxigenar utilizando reactivos oxófilos. Esta reacción puede ocurrir con pérdida o retención de la configuración. La combinación de hexacloruro de tungsteno y n-butillitio da el alqueno.
Otras reacciones
- La reducción de un epoxido con hidrato de aluminio de litio o hidrato de aluminio produce el alcohol correspondiente. Este proceso de reducción resulta de la adición nucleófila de hidrato (H)−).
- La división reductiva de epoxidas da β-lithioalkoxides.
- Reducción con hexacloruro de tungsteno y ni-butilio genera el alkene
- Epoxides experimentan reacciones de expansión del anillo, ilustradas por la inserción del dióxido de carbono para dar carbonatos cíclicos.
- Cuando se trata con tiourea, los epoxidos se convierten al episulfido, que se llaman thiiranes.
Usos
Bisphenol Un éter de diglycidyl es un componente en el hogar común "epoxy".
La estructura química del epoxido glycidol, un intermedio químico común.
Los epoxidos se producen naturalmente.
3,4-Epoxycyclohexylmethyl-3’,4’-epoxycyclohexane carboxilato, precursor de recubrimientos.
Linoleina epoxida, un componente importante del aceite de soja epoxidizada (ESBO), un plásticoizador comercialmente importante.
El óxido de benzene existe en equilibrio con el isómero de oxepin.
El óxido de etileno se utiliza ampliamente para generar detergentes y tensioactivos mediante etoxilación. Su hidrólisis produce etilenglicol. También se utiliza para la esterilización de instrumentos y materiales médicos.
La reacción de epóxidos con aminas es la base para la formación de colas epoxi y materiales estructurales. Un endurecedor de amina típico es la trietilentetramina (TETA).
Seguridad
Los epóxidos son agentes alquilantes, lo que hace que muchos de ellos sean altamente tóxicos.
Contenido relacionado
Gordo
Oxidación de Swern
Kobelita


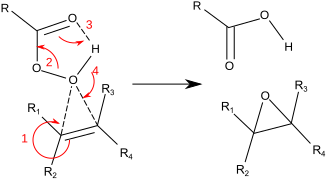






![3,4-Epoxycyclohexylmethyl-3’,4’-epoxycyclohexane carboxylate, precursor to coatings.[31]](https://upload.wikimedia.org/wikipedia/commons/thumb/0/0e/Diepoxyester.svg/175px-Diepoxyester.svg.png)

