Enzima de escisión de la cadena lateral del colesterol
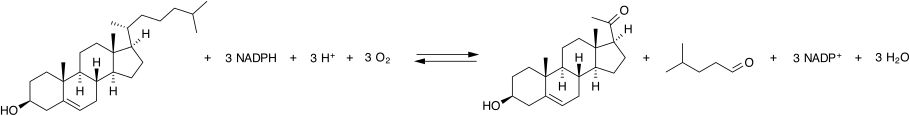
La enzima que divide la cadena lateral del colesterol se conoce comúnmente como P450scc, donde "scc" es una abreviatura de división de la cadena lateral. P450scc es una enzima mitocondrial que cataliza la conversión del colesterol en pregnenolona. Esta es la primera reacción en el proceso de esteroidogénesis en todos los tejidos de los mamíferos que se especializan en la producción de varias hormonas esteroides.
La P450scc es un miembro de la superfamilia de enzimas del citocromo P450 (familia 11, subfamilia A, polipéptido 1) y está codificada por el gen CYP11A1.
Nomenclature
El nombre sistemático de esta clase de enzimas es colesterol, ferredoxina suprarrenal reducida:oxidorreductasa (escisión de cadena lateral). Otros nombres incluyen:
|
Localización de tejidos e intracelular
El nivel más alto del sistema de división de la cadena lateral del colesterol se encuentra en la corteza suprarrenal y el cuerpo lúteo. El sistema también se expresa en niveles altos en las células de la teca esteroidogénicas del ovario y en las células de Leydig del testículo. Durante el embarazo, la placenta también expresa niveles significativos de este sistema enzimático. La p450scc también está presente en niveles mucho más bajos en varios otros tipos de tejidos, incluido el cerebro. En la corteza suprarrenal, la concentración de adrenodoxina es similar a la de la p450scc, pero la adrenodoxina reductasa se expresa en niveles más bajos.
Los estudios de inmunofluorescencia con anticuerpos específicos contra las enzimas del sistema P450scc han demostrado que las proteínas se encuentran exclusivamente dentro de las mitocondrias. El sistema P450scc se asocia con la membrana mitocondrial interna, mirando hacia el interior (matriz). La adrenodoxina y la adrenodoxina reductasa son proteínas solubles de membrana periférica ubicadas dentro de la matriz mitocondrial que parecen asociarse entre sí principalmente a través de interacciones electrostáticas.
Mecanismo de acción
La P450scc cataliza la conversión de colesterol en pregnenolona en tres reacciones de monooxigenasa. Estas implican dos hidroxilaciones de la cadena lateral del colesterol, que generan, primero, 22R-hidroxicolesterol y luego 20alfa,22R-dihidroxicolesterol. El paso final escinde el enlace entre los carbonos 20 y 22, lo que da como resultado la producción de pregnenolona y aldehído isocaproico.
Cada paso de la monooxigenasa requiere 2 electrones (equivalentes reductores). La fuente inicial de electrones es el NADPH. Los electrones se transfieren del NADPH a P450scc a través de dos proteínas de transferencia de electrones: la adrenodoxina reductasa y la adrenodoxina. Las tres proteínas juntas constituyen el complejo de escisión de la cadena lateral del colesterol.
La participación de tres proteínas en la reacción de escisión de la cadena lateral del colesterol plantea la cuestión de si las tres proteínas funcionan como un complejo ternario como reductasa:adrenodoxina:P450. Tanto los estudios espectroscópicos de la unión de la adrenodoxina a P450scc como los estudios cinéticos en presencia de concentraciones variables de adrenodoxina reductasa demostraron que la reductasa compite con P450scc por la unión a la adrenodoxina. Estos resultados demostraron que la formación de un complejo ternario funcional no es posible. A partir de estos estudios, se concluyó que los sitios de unión de la adrenodoxina a su reductasa y a P450 se superponen y, como consecuencia, la adrenodoxina funciona como una lanzadera de electrones móvil entre la reductasa y P450. Estas conclusiones se han confirmado mediante el análisis estructural del complejo adrenodoxina y P450.
El proceso de transferencia de electrones desde el NADPH a la P450scc no está estrechamente acoplado; es decir, durante la transferencia de electrones desde la adrenodoxina reductasa a través de la adrenodoxina a la P450scc, una cierta porción de los electrones se escapan fuera de la cadena y reaccionan con el O2, generando radicales superóxido. Las células esteroidogénicas incluyen una variedad de sistemas antioxidantes para hacer frente a los radicales generados por las enzimas esteroidogénicas.
Reglamento
En cada célula esteroidogénica, la expresión de las proteínas del sistema P450scc está regulada por el sistema hormonal trófico específico para el tipo celular. En las células de la corteza suprarrenal de la zona fasciculada, la expresión de los ARNm que codifican las tres proteínas P450scc está inducida por la corticotropina (ACTH). Las hormonas tróficas aumentan la expresión del gen CYP11A1 a través de factores de transcripción como el factor esteroidogénico 1 (SF-1), por la isoforma α de la proteína activadora 2 (AP-2) en el ser humano, y muchos otros. La producción de esta enzima está inhibida notablemente por el receptor nuclear DAX-1.
La P450scc siempre está activa, pero su actividad está limitada por el aporte de colesterol en la membrana interna. Por tanto, el aporte de colesterol a esta membrana (desde la membrana mitocondrial externa) se considera el verdadero paso limitante de la velocidad de producción de esteroides. Este paso está mediado principalmente por la proteína reguladora aguda esteroidogénica (StAR o STARD1). Tras la estimulación de una célula para que produzca esteroides, la cantidad de StAR disponible para transferir colesterol a la membrana interna limita la velocidad de la reacción (fase aguda). Con una estimulación prolongada (crónica), se cree que el aporte de colesterol ya no es un problema y que la capacidad del sistema para producir esteroides (es decir, el nivel de P450scc en las mitocondrias) es ahora más importante.
La corticotropina (ACTH) es una hormona que se libera desde la hipófisis anterior en respuesta a situaciones de estrés. Un estudio de la capacidad esteroidogénica de la corteza suprarrenal en lactantes con enfermedad respiratoria aguda demostró que efectivamente durante el estado patológico hay un aumento específico de la capacidad esteroidogénica para la síntesis del glucocorticoide cortisol pero no del mineralocorticoide aldosterona o del andrógeno DHEAS que se secretan desde otras zonas de la corteza suprarrenal.
Patología
Las mutaciones en el gen CYP11A1 dan lugar a una deficiencia de hormonas esteroides, lo que provoca una minoría de casos de hiperplasia suprarrenal congénita lipoidea, una enfermedad poco frecuente y potencialmente mortal. La deficiencia de CYP11A1 puede provocar hiperpigmentación, hipoglucemia e infecciones recurrentes.
Inhibidores
Los inhibidores de la enzima que escinde la cadena lateral del colesterol incluyen aminoglutetimida, ketoconazol y mitotano, entre otros.
Véase también
- enzima esteroideogénica
- Cytochrome P450 oxidase
Referencias
- ^ a b c ENSG00000288362 GRCh38: Ensembl release 89: ENSG00000140459, ENSG00000288362 – Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG000323 – Ensembl, mayo 2017
- ^ "Human PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d Hanukoglu I (diciembre de 1992). "Enzimas esteroideogénicas: estructura, función y papel en la regulación de la biosíntesis de la hormona esteroidea". The Journal of Steroid Biochemistry and Molecular Biology. 43 (8): 779–804. doi:10.1016/0960-0760(92)90307-5. PMID 22217824. S2CID 112729.
- ^ "Entrez Gene: CYP11A1 cytochrome P450, family 11, subfamilia A, polipeptide 1".
- ^ Strauss JF, Martinez F, Kiriakidou M (febrero de 1996). "Síntesis hormonal esteroide de plasma: características únicas y preguntas sin respuesta". Biología de la Reproducción. 54 (2): 303-311. doi:10.1095/biolreprod54.2.303. PMID 8788180.
- ^ Stoffel-Wagner B (diciembre de 2001). "El metabolismo neurosteroideo en el cerebro humano". European Journal of Endocrinology. 145 (6): 669–679. doi:10.1530/eje.0.1450669. PMID 11720889.
- ^ Hanukoglu I, Hanukoglu Z (mayo de 1986). "Stoichiometry of mitocondrial cytochromes P-450, adrenodoxin and adrenodoxin reductase in adrenal cortex and corpus luteum. Implicaciones para la organización de membrana y regulación de genes". European Journal of Biochemistry. 157 (1): 27–31. doi:10.1111/j.1432-1033.1986.tb09633.x. PMID 3011431.
- ^ Hanukoglu I, Suh BS, Himmelhoch S, Amsterdam A (octubre de 1990). "Inducción y localización mitocondrial de enzimas del sistema citocromo P450scc en células de granulosa ováricas normales y transformadas". The Journal of Cell Biology. 111 (4): 1373–1381. doi:10.1083/jcb.111.4.1373. PMC 2116250. PMID 2170421.
- ^ a b Hanukoglu I, Feuchtwanger R, Hanukoglu A (noviembre de 1990). "Mecanismo de corticotropina y inducción de cAMP de enzimas del sistema de citocromo mitocondrial P450 en células de corteza suprarrenal". El Diario de Química Biológica. 265 (33): 20602–20608. doi:10.1016/S0021-9258(17)30545-8. PMID 2173715.
- ^ Estudios topológicos de citocromas P-450scc y P-45011 beta en las membranas mitocondriales internas bovinas adrenocorticas. Efectos de la digestión testéptica controlada. J. Biol. Chem. 1979 254: 10443-8.
- ^ Farkash Y, Timberg R, Orly J (abril de 1986). "Preparación de antisuero a rata cytocromo P-450 colesterol cadena lateral escote, y su uso para la localización ultraestructura de la enzima inmunoreactiva por la técnica de proteína A-gold". Endocrinología. 118 (4): 1353–1365. doi:10.1210/endo-118-4-1353. PMID 3948785.
- ^ Hanukoglu I, Privalle CT, Jefcoate CR (mayo 1981). "Mechanisms of ionic activation of adrenal mitocondrial cytochromes P-450scc and P-45011 beta". El Diario de Química Biológica. 256 (9): 4329–4335. doi:10.1016/S0021-9258(19)69437-8. PMID 6783659.
- ^ Hanukoglu I, Rapoport R (1995). "Routes and regulation of NADPH production in esteroidesogenic mitocondria". Endocrine Research. 21 (1–2): 231–241. doi:10.3109/07435809509030439. PMID 7588385.
- ^ Hanukoglu I, Gutfinger T, Haniu M, Shively JE (diciembre de 1987). "Isolación de un cDNA para reductasa adrenodoxina (reductasa ferredoxina-NADP+). Implications for mitocondrial cytochrome P-450 systems". European Journal of Biochemistry. 169 (3): 449-455. doi:10.1111/j.1432-1033.1987.tb13632.x. PMID 3691502.
- ^ a b c Hanukoglu I, Jefcoate CR (abril de 1980). "Mitocondrial cytochrome P-450scc. Mecanismo de transporte de electrones por adrenodoxin". El Diario de Química Biológica. 255 (7): 3057–3061. doi:10.1016/S0021-9258(19)85851-9. PMID 6766943.
- ^ Hanukoglu I, Spitsberg V, Bumpus JA, Dus KM, Jefcoate CR (mayo 1981). "Citocromo mitocondrial Adrenal P-450scc. Interacciones de colesterol y adrenodoxin en equilibrio y durante la rotación". El Diario de Química Biológica. 256 (9): 4321–4328. doi:10.1016/S0021-9258(19)69436-6. PMID 7217084.
- ^ Strushkevich N, MacKenzie F, Cherkesova T, Grabovec I, Usanov S, Park HW (junio de 2011). "Base estructural para la biosíntesis pregnenolona por el sistema de monooxigenasa mitocondrial". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 108 (25): 10139–10143. código:2011PNAS..10810139S. doi:10.1073/pnas.1019441108. PMC 3121847. PMID 21636783.
- ^ Hanukoglu I, Rapoport R, Weiner L, Sklan D (septiembre de 1993). "Electron escapeage from the mitocondrial NADPH-adrenodoxin reductase-adrenodoxin-P450scc (cholesterol side chain cleavage) system". Archivos de Bioquímica y Biofísica. 305 (2): 489-498. doi:10.1006/abbi.1993.1452. PMID 8396893.
- ^ Hanukoglu I (2006). "Mecanismos protectores antioxidantes contra especies reactivas de oxígeno (ROS) generados por sistemas de P450 mitocondriales en células esterogénicas". Reseñas del metabolismo de las drogas. 38 (1–2): 171–196. doi:10.1080/03602530600570040. PMID 16684656. S2CID 10766948.
- ^ a b c Lavoie HA, King SR (agosto de 2009). "Regulación tradicional de genes esteroides: STARD1, CYP11A1 y HSD3B". Biología experimental y medicina. 234 (8): 880–907. doi:10.3181/0903-MR-97. PMID 19491374. S2CID 5350278.
- ^ Guo IC, Shih MC, Lan HC, Hsu NC, Hu MC, Chung BC (Julio 2007). "Regulación formal del CYP11A1 humano en gonads y adrenals". Journal of Biomedical Science. 14 (4): 509-515. doi:10.1007/s11373-007-9177-z. PMID 17594537.
- ^ Hanukoglu A, Fried D, Nakash I, Hanukoglu I (noviembre de 1995). "Los aumentos selectivos de la capacidad esteroideogénica suprarrenal durante la enfermedad respiratoria aguda en bebés". European Journal of Endocrinology. 133 (5): 552-556. doi:10.1530/eje.0.1330552. PMID 7581984. S2CID 44439040.
- ^ Bhangoo A, Anhalt H, Ten S, King SR (marzo de 2006). "Varias penotípicas en hiperplasia suprarrenal congénita lipoide". Endocrinología pediátrica Reseñas. 3 (3): 258–271.
- ^ al Kandari H, Katsumata N, Alexander S, Rasoul MA (agosto de 2006). "Homozygous mutation of P450 side-chain cleavage enzima gene (CYP11A1) en 46, XY paciente con insuficiencia suprarrenal, reversión sexual completa y agenesis de corpus callosum". The Journal of Clinical Endocrinology and Metabolism. 91 (8): 2821–2826. doi:10.1210/jc.2005-2230. PMID 16705068.
- ^ Kim CJ, Lin L, Huang N, Quigley CA, AvRuskin TW, Achermann JC, Miller WL (marzo de 2008). "Deficiencia suprarrenal y gonadal combinada grave causada por mutaciones novedosas en la enzima colavage de la cadena del colesterol, P450scc". The Journal of Clinical Endocrinology and Metabolism. 93 (3): 696–702. doi:10.1210/jc.2007-2330. PMC 2266942. PMID 18182448.
- ^ FBuonocore F, Achermann JC (2020). "La insuficiencia suprarrenal primaria: nuevas causas genéticas y sus consecuencias a largo plazo". Endocrinología clínica. 92 (1): 11–20. doi:10.1111/cen.14109. PMC 6916405. PMID 31610036.
- ^ Becker KL (2001). Principios y Práctica de Endocrinología y Metabolismo. Lippincott Williams & Wilkins. pp. 735–. ISBN 978-0-7817-1750-2.
- ^ Jameson JL, De Groot LJ (18 mayo 2010). Endocrinología - Libro-E: Adulto y Pediatría. Elsevier Health Sciences. pp. 301–302. ISBN 978-1-4557-1126-0.
- ^ Ortiz de Montellano PR (13 marzo 2015). Cytochrome P450: Estructura, Mecanismo y Bioquímica. Springer. pp. 851–879. ISBN 978-319-12108-6.
Más lectura
- Helmberg A (agosto de 1993). "Génes de porcino y enfermedad endocrina: genes CYP21 y CYP11B". Acta Endocrinologica. 129 (2): 97–108. doi:10.1530/acta.0.1290097. PMID 8372604.
- Papadopoulos V, Amri H, Boujrad N, Cascio C, Culty M, Garnier M, et al. (enero de 1997). "Receptor benzodiazepino periférico en transporte de colesterol y esteroides". esteroides. 62 (1): 21–28. doi:10.1016/S0039-128X(96)00154-7PMID 9029710. S2CID 1977513.
- Stocco DM (junio de 2000). "Transferencia intramitocondrial de colesterol". Biochimica et Biophysica Acta (BBA) - Biología molecular y celular de Lipids. 1486 (1): 184–197. doi:10.1016/S1388-1981(00)00056-1. PMID 10856721.
- Kristensen VN, Kure EH, Erikstein B, Harada N, Børresen-Dale A (octubre de 2001). "Suceptibilidad genética y compuestos similares al estrógeno ambiental". Mutation Research. 482 (1–2): 77–82. doi:10.1016/S0027-5107(01)00212-3. PMID 11535251.
- Strauss JF (noviembre de 2003). "Algunos pensamientos nuevos sobre la fisiopatología y la genética del síndrome de ovario poliquístico". Annals of the New York Academy of Sciences. 997 (1): 42–48. Código:2003NYASA.997...42S. doi:10.1196/annals.1290.005. PMID 14644808. S2CID 23559461.
- Wada A, Waterman MR (noviembre de 1992). "Identificación por mutagénesis dirigida por el sitio de dos residuos de lisina en la cadena del colesterol cleavage cytochrome P450 que son esenciales para la unión adrenodoxina". El Diario de Química Biológica. 267 (32): 22877–22882. doi:10.1016/S0021-9258(18)50028-4. PMID 1429635.
- Hu MC, Guo IC, Lin JH, Chung BC (marzo de 1991). "Expresión regulada de citocromo P-450scc (enzima de escolesterol de cadena lateral) en las líneas celulares cultivadas detectadas por el anticuerpo contra la proteína humana expresada bacterianamente". The Biochemical Journal. 274 (Pt 3): 813-817. doi:10.1042/bj2740813. PMC 1149983. PMID 1849407.
- Sparkes RS, Klisak I, Miller WL (junio de 1991). "Regional mapping of genes encoding human esteroideogenic enzimas: P450scc to 15q23-q24, adrenodoxin to 11q22; adrenodoxin reductase to 17q24-q25; and P450c17 to 10q24-q25". DNA and Cell Biology. 10 (5): 359–365. doi:10.1089/dna.1991.10.359. PMID 1863359.
- Coghlan VM, Vickery LE (octubre de 1991). "Las mutaciones específicas de las especies en la ferredoxina humana que afectan la unión a la reductasa ferredoxina y la citocromo P450scc". El Diario de Química Biológica. 266 (28): 18606-18612. doi:10.1016/S0021-9258(18)55106-1. PMID 1917982.
- Matteson KJ, Chung BC, Urdea MS, Miller WL (abril de 1986). "Estudio de colesterol cleavage de cadena lateral (20,22 desmolasa) deficiencia que causa hiperplasia suprarrenal lipoide congénita mediante sondas bovine-sequence P450scc oligodeoxyribonucleótido". Endocrinología. 118 (4): 1296–1305. doi:10.1210/endo-118-4-1296. PMID 2419119.
- Chung BC, Matteson KJ, Voutilainen R, Mohandas TK, Miller WL (diciembre de 1986). "Enzima de coleavage de colesterol humano, P450scc: clonación de cDNA, asignación del gen al cromosoma 15, y expresión en la placenta". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 83 (23): 8962–8966. Bibcode:1986PNAS...83.8962C. doi:10.1073/pnas.83.23.8962. PMC 387054. PMID 3024157.
- Morohashi K, Sogawa K, Omura T, Fujii-Kuriyama Y (abril de 1987). "Gene structure of human cytochrome P-450(SCC), colesterol desmolase". Journal of Biochemistry. 101 (4): 879-887. doi:10.1093/oxfordjournals.jbchem.a121955. PMID 3038854.
- Maruyama K, Sugano S (enero de 1994). "Oligo-capping: un método simple para reemplazar la estructura de capa de mRNAs eucariotas con oligoribonucleótidos". Gene. 138 (1–2): 171–174. doi:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Gharani N, Waterworth DM, Batty S, White D, Gilling-Smith C, Conway GS, et al. (marzo de 1997). "Asociación del gen de síntesis de esteroides CYP11a con síndrome de ovario poliquístico e hiperandrógeno". Genética molecular humana. 6 (3): 397-402. doi:10.1093/hmg/6.3.397. PMID 9147642.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (octubre de 1997). "Construcción y caracterización de una biblioteca de cDNA completamente rica y de 5'''''' enriquecida". Gene. 200 (1–2): 149–156. doi:10.1016/S0378-1119(97)00411-3. PMID 9373149.
- Hukkanen J, Mäntylä M, Kangas L, Wirta P, Hakkola J, Paakki P, et al. (febrero de 1998). "Expresión de citocromo P450 genes encoding enzimas activas en el metabolismo del tamoxifeno en endometrio uterino humano". Farmacología. 82 (2): 93–97. doi:10.1111/j.1600-0773.1998.tb01404.x. PMID 9498238.
- Zhou Z, Shackleton CH, Pahwa S, White PC, Speiser PW (marzo de 1998). "El metabolismo de esteroides sexuales prominentes en linfocitos humanos". Endocrinología molecular y celular. 138 (1–2): 61–69. doi:10.1016/S0303-7207(98)00052-5. PMID 9685215. S2CID 20490901.
Síntesis de hormonas esteroideas


Imágenes adicionales
- Colesterol
- Pregnenolone
Enlaces externos
- Cytochrome+P450scc en la Biblioteca Nacional de Medicina de los EE.UU.