Enzima
Las enzimas () son proteínas que actúan como catalizadores biológicos acelerando las reacciones químicas. Las moléculas sobre las que pueden actuar las enzimas se denominan sustratos, y la enzima convierte los sustratos en diferentes moléculas conocidas como productos. Casi todos los procesos metabólicos en la célula necesitan catálisis enzimática para que ocurran a un ritmo lo suficientemente rápido como para mantener la vida. Las rutas metabólicas dependen de enzimas para catalizar pasos individuales. El estudio de las enzimas se denomina enzimología y el campo del análisis de pseudoenzimas reconoce que, durante la evolución, algunas enzimas han perdido la capacidad de llevar a cabo una catálisis biológica, lo que a menudo se refleja en sus secuencias de aminoácidos y en sus inusuales &# 39;pseudocatalítico' propiedades.
Se sabe que las enzimas catalizan más de 5000 tipos de reacciones bioquímicas. Otros biocatalizadores son moléculas de ARN catalíticas, llamadas ribozimas. Enzimas' la especificidad proviene de sus estructuras tridimensionales únicas.
Como todos los catalizadores, las enzimas aumentan la velocidad de reacción al reducir su energía de activación. Algunas enzimas pueden hacer que su conversión de sustrato a producto ocurra muchos millones de veces más rápido. Un ejemplo extremo es la orotidina 5'-fosfato descarboxilasa, que permite que se produzca en milisegundos una reacción que de otro modo tardaría millones de años. Químicamente, las enzimas son como cualquier catalizador y no se consumen en las reacciones químicas, ni alteran el equilibrio de una reacción. Las enzimas difieren de la mayoría de los demás catalizadores en que son mucho más específicas. La actividad enzimática puede verse afectada por otras moléculas: los inhibidores son moléculas que disminuyen la actividad enzimática y los activadores son moléculas que aumentan la actividad. Muchas drogas terapéuticas y venenos son inhibidores de enzimas. La actividad de una enzima disminuye notablemente fuera de su temperatura y pH óptimos, y muchas enzimas se desnaturalizan (permanentemente) cuando se exponen a un calor excesivo, perdiendo su estructura y propiedades catalíticas.
Algunas enzimas se utilizan comercialmente, por ejemplo, en la síntesis de antibióticos. Algunos productos para el hogar usan enzimas para acelerar las reacciones químicas: las enzimas en los detergentes biológicos descomponen las proteínas, el almidón o las manchas de grasa en la ropa, y las enzimas en los ablandadores de carne descomponen las proteínas en moléculas más pequeñas, lo que hace que la carne sea más fácil de masticar.
Etimología e historia
A fines del siglo XVII y principios del XVIII, se conocían la digestión de la carne por las secreciones estomacales y la conversión del almidón en azúcares por medio de extractos de plantas y saliva, pero no se habían identificado los mecanismos por los cuales ocurrían.
El químico francés Anselme Payen fue el primero en descubrir una enzima, la diastasa, en 1833. Unas décadas más tarde, al estudiar la fermentación del azúcar en alcohol por medio de la levadura, Louis Pasteur concluyó que esta fermentación era causada por una fuerza vital contenida dentro las células de levadura llamadas 'fermentos', que se creía que funcionaban solo dentro de los organismos vivos. Escribió que "la fermentación alcohólica es un acto relacionado con la vida y la organización de las células de levadura, no con la muerte o putrefacción de las células".
En 1877, el fisiólogo alemán Wilhelm Kühne (1837–1900) utilizó por primera vez el término enzima, que proviene del griego ἔνζυμον, "leudado" o "en levadura", para describir este proceso. La palabra enzima se usó más tarde para referirse a sustancias no vivas como la pepsina, y la palabra fermento se usó para referirse a la actividad química producida por organismos vivos.
Eduard Buchner presentó su primer artículo sobre el estudio de los extractos de levadura en 1897. En una serie de experimentos en la Universidad de Berlín, descubrió que los extractos de levadura fermentaban el azúcar incluso cuando no había células vivas de levadura en la mezcla. Llamó a la enzima que provocó la fermentación de la sacarosa "zimasa". En 1907, recibió el Premio Nobel de Química por "su descubrimiento de la fermentación libre de células". Siguiendo el ejemplo de Buchner, las enzimas suelen nombrarse según la reacción que llevan a cabo: el sufijo -asa se combina con el nombre del sustrato (por ejemplo, la lactasa es la enzima que escinde la lactosa) o al tipo de reacción (p. ej., la ADN polimerasa forma polímeros de ADN).
La identidad bioquímica de las enzimas aún se desconocía a principios del siglo XX. Muchos científicos observaron que la actividad enzimática estaba asociada con las proteínas, pero otros (como el premio Nobel Richard Willstätter) argumentaron que las proteínas eran simplemente portadoras de las verdaderas enzimas y que las proteínas per se eran incapaces de catalizar. En 1926, James B. Sumner demostró que la enzima ureasa era una proteína pura y la cristalizó; hizo lo mismo con la enzima catalasa en 1937. La conclusión de que las proteínas puras pueden ser enzimas fue definitivamente demostrada por John Howard Northrop y Wendell Meredith Stanley, quienes trabajaron en las enzimas digestivas pepsina (1930), tripsina y quimotripsina. Estos tres científicos fueron galardonados con el Premio Nobel de Química de 1946.
El descubrimiento de que las enzimas podían cristalizarse finalmente permitió resolver sus estructuras mediante cristalografía de rayos X. Esto se hizo primero para la lisozima, una enzima que se encuentra en las lágrimas, la saliva y las claras de huevo y que digiere la cubierta de algunas bacterias; la estructura fue resuelta por un grupo dirigido por David Chilton Phillips y publicada en 1965. Esta estructura de lisozima de alta resolución marcó el comienzo del campo de la biología estructural y el esfuerzo por comprender cómo funcionan las enzimas a un nivel atómico de detalle.
Clasificación y nomenclatura
Las enzimas se pueden clasificar según dos criterios principales: similitud de secuencia de aminoácidos (y, por lo tanto, relación evolutiva) o actividad enzimática.
Actividad enzimática. El nombre de una enzima a menudo se deriva de su sustrato o de la reacción química que cataliza, y la palabra termina en -asa. Los ejemplos son lactasa, alcohol deshidrogenasa y ADN polimerasa. Las diferentes enzimas que catalizan la misma reacción química se denominan isoenzimas.
La Unión Internacional de Bioquímica y Biología Molecular ha desarrollado una nomenclatura para las enzimas, los números EC (para "Comisión de enzimas"). Cada enzima se describe mediante "EC" seguida de una secuencia de cuatro números que representan la jerarquía de la actividad enzimática (de muy general a muy específica). Es decir, el primer número clasifica ampliamente la enzima según su mecanismo, mientras que los otros dígitos agregan más y más especificidad.
La clasificación de nivel superior es:
- CE 1, Oxidoreductasas: cataliza la oxidación/reducción reacciones
- CE 2, Transferases: transferir un grupo funcional (Por ejemplo. a grupo de metilo o fosfato)
- EC 3, Hidrolasas: cataliza la hidrólisis de varios lazos
- EC 4, Lyases: cleave varios lazos por medios distintos a la hidrolisis y oxidación
- CE 5, Isomerases: catalice los cambios de isomerización dentro de una sola molécula
- EC 6, Ligas: une dos moléculas con vínculos covalentes.
- EC 7, Translocases: cataliza el movimiento de iones o moléculas a través de las membranas, o su separación dentro de las membranas.
Estas secciones se subdividen en otras características, como el sustrato, los productos y el mecanismo químico. Una enzima se especifica completamente mediante cuatro designaciones numéricas. Por ejemplo, la hexoquinasa (EC 2.7.1.1) es una transferasa (EC 2) que agrega un grupo fosfato (EC 2.7) a un azúcar hexosa, una molécula que contiene un grupo alcohol (EC 2.7.1).
Similitud de secuencia. Las categorías EC no reflejan similitud de secuencia. Por ejemplo, dos ligasas del mismo número EC que catalizan exactamente la misma reacción pueden tener secuencias completamente diferentes. Independientemente de su función, las enzimas, como cualquier otra proteína, se han clasificado por su similitud de secuencia en numerosas familias. Estas familias se han documentado en docenas de diferentes bases de datos de proteínas y familias de proteínas, como Pfam.
Estructura
Las enzimas son generalmente proteínas globulares que actúan solas o en complejos más grandes. La secuencia de los aminoácidos especifica la estructura que a su vez determina la actividad catalítica de la enzima. Aunque la estructura determina la función, todavía no se puede predecir una nueva actividad enzimática a partir de la estructura solamente. Las estructuras enzimáticas se despliegan (desnaturalizan) cuando se calientan o se exponen a desnaturalizantes químicos y esta alteración de la estructura generalmente provoca una pérdida de actividad. La desnaturalización de enzimas normalmente está relacionada con temperaturas superiores a las de una especie. nivel normal; como resultado, las enzimas de las bacterias que viven en ambientes volcánicos, como las aguas termales, son apreciadas por los usuarios industriales por su capacidad para funcionar a altas temperaturas, lo que permite que las reacciones catalizadas por enzimas funcionen a una velocidad muy alta.
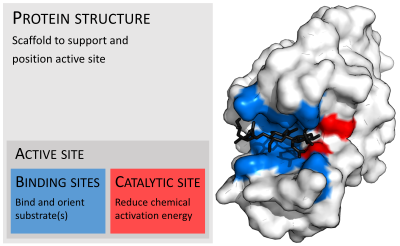
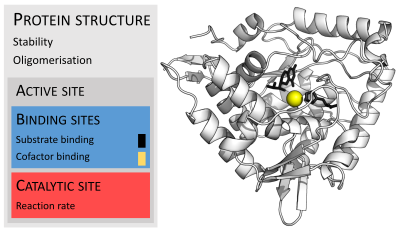
Las enzimas suelen ser mucho más grandes que sus sustratos. Los tamaños varían desde solo 62 residuos de aminoácidos, para el monómero de 4-oxalocrotonato tautomerasa, hasta más de 2500 residuos en la sintasa de ácidos grasos animales. Solo una pequeña porción de su estructura (alrededor de 2 a 4 aminoácidos) está directamente involucrada en la catálisis: el sitio catalítico. Este sitio catalítico está ubicado junto a uno o más sitios de unión donde los residuos orientan los sustratos. El sitio catalítico y el sitio de unión juntos componen el sitio activo de la enzima. La mayoría restante de la estructura de la enzima sirve para mantener la orientación y la dinámica precisas del sitio activo.
En algunas enzimas, ningún aminoácido está directamente involucrado en la catálisis; en cambio, la enzima contiene sitios para unir y orientar cofactores catalíticos. Las estructuras enzimáticas también pueden contener sitios alostéricos donde la unión de una molécula pequeña provoca un cambio conformacional que aumenta o disminuye la actividad.
Existe una pequeña cantidad de catalizadores biológicos basados en ARN llamados ribozimas, que nuevamente pueden actuar solos o en forma compleja con proteínas. El más común de estos es el ribosoma, que es un complejo de proteínas y componentes de ARN catalítico.
Mecanismo
Aglutinante del sustrato
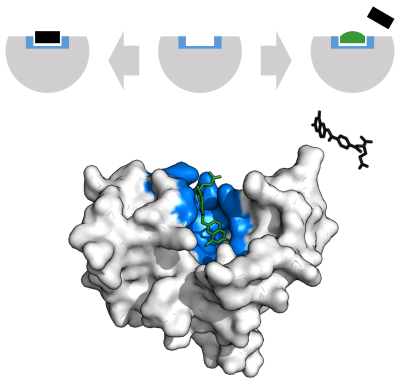
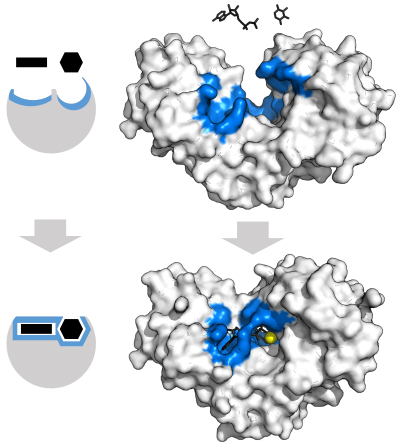
Las enzimas deben unirse a sus sustratos antes de que puedan catalizar cualquier reacción química. Las enzimas suelen ser muy específicas en cuanto a qué sustratos se unen y luego la reacción química catalizada. La especificidad se logra uniendo bolsillos con forma, carga y características hidrofílicas/hidrofóbicas complementarias a los sustratos. Por lo tanto, las enzimas pueden distinguir entre moléculas de sustrato muy similares para ser quimioselectivas, regioselectivas y estereoespecíficas.
Algunas de las enzimas que muestran la mayor especificidad y precisión están involucradas en la copia y expresión del genoma. Algunas de estas enzimas tienen "corrección de pruebas" mecanismos. Aquí, una enzima como la ADN polimerasa cataliza una reacción en un primer paso y luego verifica que el producto sea correcto en un segundo paso. Este proceso de dos pasos da como resultado tasas de error promedio de menos de 1 error en 100 millones de reacciones en polimerasas de mamíferos de alta fidelidad. También se encuentran mecanismos de revisión similares en la ARN polimerasa, las aminoacil ARNt sintetasas y los ribosomas.
Por el contrario, algunas enzimas muestran promiscuidad enzimática, tienen una amplia especificidad y actúan sobre una variedad de diferentes sustratos fisiológicamente relevantes. Muchas enzimas poseen pequeñas actividades secundarias que surgieron de forma fortuita (es decir, de forma neutra), lo que puede ser el punto de partida para la selección evolutiva de una nueva función.
"Cerradura y llave" modelo
Para explicar la especificidad observada de las enzimas, en 1894 Emil Fischer propuso que tanto la enzima como el sustrato poseen formas geométricas complementarias específicas que encajan exactamente entre sí. Esto a menudo se conoce como "la cerradura y la llave" modelo. Este modelo inicial explica la especificidad de la enzima, pero no logra explicar la estabilización del estado de transición que alcanzan las enzimas.
Modelo de ajuste inducido
En 1958, Daniel Koshland sugirió una modificación al modelo de llave y candado: dado que las enzimas son estructuras bastante flexibles, el sitio activo se remodela continuamente por interacciones con el sustrato a medida que el sustrato interactúa con la enzima. Como resultado, el sustrato no se une simplemente a un sitio activo rígido; las cadenas laterales de aminoácidos que forman el sitio activo se moldean en las posiciones precisas que permiten que la enzima realice su función catalítica. En algunos casos, como las glucosidasas, la molécula de sustrato también cambia ligeramente de forma cuando ingresa al sitio activo. El sitio activo continúa cambiando hasta que el sustrato está completamente unido, momento en el cual se determina la forma final y la distribución de carga. El ajuste inducido puede mejorar la fidelidad del reconocimiento molecular en presencia de competencia y ruido a través del mecanismo de revisión conformacional.
Catálisis
Las enzimas pueden acelerar las reacciones de varias maneras, todas las cuales reducen la energía de activación (ΔG‡, energía libre de Gibbs)
- Estabilizando el estado de transición:
- Crear un entorno con una distribución de carga complementaria a la del estado de transición para reducir su energía
- Proporcionando una vía de reacción alternativa:
- Reaccionando temporalmente con el sustrato, formando un intermedio covalente para proporcionar un estado de transición energética inferior
- Al desestabilizar el estado del substrato:
- Distorsionar sustrato(s) en su forma de estado de transición para reducir la energía necesaria para alcanzar el estado de transición
- Al orientar los sustratos en un arreglo productivo para reducir el cambio de entropía de reacción (la contribución de este mecanismo a la catalisis es relativamente pequeña)
Las enzimas pueden usar varios de estos mecanismos simultáneamente. Por ejemplo, las proteasas como la tripsina realizan una catálisis covalente mediante una tríada catalítica, estabilizan la acumulación de carga en los estados de transición mediante un agujero de oxianión y completan la hidrólisis mediante un sustrato de agua orientada.
Dinámica
Las enzimas no son estructuras rígidas y estáticas; en cambio, tienen movimientos dinámicos internos complejos, es decir, movimientos de partes de la estructura de la enzima, como residuos de aminoácidos individuales, grupos de residuos que forman un bucle de proteína o una unidad de estructura secundaria, o incluso un dominio de proteína completo. Estos movimientos dan lugar a un conjunto conformacional de estructuras ligeramente diferentes que se interconvierten entre sí en equilibrio. Los diferentes estados dentro de este conjunto pueden estar asociados con diferentes aspectos de la función de una enzima. Por ejemplo, diferentes conformaciones de la enzima dihidrofolato reductasa están asociadas con los pasos de unión al sustrato, catálisis, liberación de cofactores y liberación de productos del ciclo catalítico, de acuerdo con la teoría de la resonancia catalítica.
Presentación de sustrato
La presentación de sustrato es un proceso en el que la enzima se separa de su sustrato. Las enzimas pueden secuestrarse en la membrana plasmática lejos de un sustrato en el núcleo o el citosol. O dentro de la membrana, una enzima puede secuestrarse en balsas lipídicas lejos de su sustrato en la región desordenada. Cuando se libera la enzima, se mezcla con su sustrato. Alternativamente, la enzima se puede secuestrar cerca de su sustrato para activar la enzima. Por ejemplo, la enzima puede ser soluble y al activarse unirse a un lípido en la membrana plasmática y luego actuar sobre las moléculas en la membrana plasmática.
Modulación alostérica
Los sitios alostéricos son bolsillos en la enzima, distintos del sitio activo, que se unen a moléculas en el entorno celular. Estas moléculas luego provocan un cambio en la conformación o dinámica de la enzima que se transduce al sitio activo y, por lo tanto, afecta la velocidad de reacción de la enzima. De esta forma, las interacciones alostéricas pueden inhibir o activar enzimas. Las interacciones alostéricas con metabolitos aguas arriba o aguas abajo en la vía metabólica de una enzima provocan una regulación por retroalimentación, alterando la actividad de la enzima de acuerdo con el flujo a través del resto de la vía.
Cofactores
Algunas enzimas no necesitan componentes adicionales para mostrar una actividad completa. Otros requieren moléculas no proteicas llamadas cofactores para unirse para la actividad. Los cofactores pueden ser compuestos inorgánicos (p. ej., iones metálicos y grupos de hierro y azufre) o compuestos orgánicos (p. ej., flavina y hemo). Estos cofactores sirven para muchos propósitos; por ejemplo, los iones metálicos pueden ayudar a estabilizar las especies nucleófilas dentro del sitio activo. Los cofactores orgánicos pueden ser coenzimas, que se liberan del sitio activo de la enzima durante la reacción, o grupos prostéticos, que están fuertemente unidos a una enzima. Los grupos prostéticos orgánicos pueden unirse covalentemente (p. ej., biotina en enzimas como la piruvato carboxilasa).
Un ejemplo de una enzima que contiene un cofactor es la anhidrasa carbónica, que utiliza un cofactor de zinc unido como parte de su sitio activo. Estos iones o moléculas estrechamente unidos se encuentran generalmente en el sitio activo y están involucrados en la catálisis. Por ejemplo, los cofactores de flavina y hemo a menudo están involucrados en reacciones redox.
Las enzimas que requieren un cofactor pero no tienen un enlace se denominan apoenzimas o apoproteínas. Una enzima junto con los cofactores necesarios para la actividad se denomina holoenzima (o haloenzima). El término holoenzima también se puede aplicar a enzimas que contienen múltiples subunidades de proteínas, como las ADN polimerasas; aquí la holoenzima es el complejo completo que contiene todas las subunidades necesarias para la actividad.
Coenzimas
Las coenzimas son pequeñas moléculas orgánicas que pueden estar unidas de forma suelta o estrecha a una enzima. Las coenzimas transportan grupos químicos de una enzima a otra. Los ejemplos incluyen NADH, NADPH y trifosfato de adenosina (ATP). Algunas coenzimas, como el mononucleótido de flavina (FMN), el dinucleótido de flavina y adenina (FAD), el pirofosfato de tiamina (TPP) y el tetrahidrofolato (THF), se derivan de las vitaminas. Estas coenzimas no pueden ser sintetizadas por el cuerpo de novo y los compuestos estrechamente relacionados (vitaminas) deben adquirirse de la dieta. Los grupos químicos transportados incluyen:
- el ión de hidrato (H−), llevado por NAD o NADP+
- el grupo fosfato, llevado por adenosina triphosphate
- el grupo acetil, llevado por la coenzima A
- formyl, methenyl or metil groups, carried by folic acid and
- el grupo metil, llevado por S-adenosylmethionine
Dado que las coenzimas se modifican químicamente como consecuencia de la acción enzimática, es útil considerarlas como una clase especial de sustratos, o segundos sustratos, que son comunes a muchas enzimas diferentes. Por ejemplo, se sabe que alrededor de 1000 enzimas utilizan la coenzima NADH.
Las coenzimas generalmente se regeneran continuamente y sus concentraciones se mantienen en un nivel constante dentro de la célula. Por ejemplo, el NADPH se regenera a través de la ruta de las pentosas fosfato y la S-adenosilmetionina por la metionina adenosiltransferasa. Esta regeneración continua significa que pequeñas cantidades de coenzimas se pueden utilizar de forma muy intensiva. Por ejemplo, el cuerpo humano convierte su propio peso en ATP cada día.
Termodinámica
Al igual que con todos los catalizadores, las enzimas no alteran la posición del equilibrio químico de la reacción. En presencia de una enzima, la reacción transcurre en la misma dirección que sin la enzima, solo que más rápidamente. Por ejemplo, la anhidrasa carbónica cataliza su reacción en cualquier dirección dependiendo de la concentración de sus reactivos:
- [{text{Carbonic anhydrase}}]H2CO3}}}" xmlns="http://www.w3.org/1998/Math/MathML">CO2+H2O→Carbonic anhydraseH2CO3{displaystyle {ce {cH2O-Inglés}}H2CO3}}}
[{text{Carbonic anhydrase}}]H2CO3}}}" aria-hidden="true" class="mwe-math-fallback-image-inline" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4c8837b26e96fe552c17d863f93e0618cd998b" style="vertical-align: -1.005ex; margin-top: -0.329ex; width:36.285ex; height:4.509ex;"/> (en tejidos; alta CO2 concentración)
()1)
- <math alttext="{displaystyle {ce {CO2{}+H2OCO2+H2O←Carbonic anhydraseH2CO3{displaystyle {ce {cH2}+H2O observado-[{text{text{Carbonic anhydrase}]H2CO3}}}<img alt="{displaystyle {ce {CO2{}+H2O (en pulmones; bajo CO2 concentración)
()2)
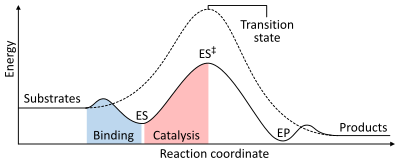
La velocidad de una reacción depende de la energía de activación necesaria para formar el estado de transición que luego se descompone en productos. Las enzimas aumentan las velocidades de reacción al reducir la energía del estado de transición. Primero, la unión forma un complejo enzima-sustrato (ES) de baja energía. En segundo lugar, la enzima estabiliza el estado de transición de modo que requiere menos energía para lograrlo en comparación con la reacción no catalizada (ES‡). Finalmente, el complejo enzima-producto (EP) se disocia para liberar los productos.
Las enzimas pueden acoplar dos o más reacciones, de modo que una reacción termodinámicamente favorable puede usarse para "impulsar" uno termodinámicamente desfavorable de manera que la energía combinada de los productos es menor que la de los sustratos. Por ejemplo, la hidrólisis de ATP a menudo se usa para impulsar otras reacciones químicas.
Cinética
La cinética enzimática es la investigación de cómo las enzimas se unen a los sustratos y los convierten en productos. Los datos de velocidad utilizados en los análisis cinéticos se obtienen comúnmente de ensayos enzimáticos. En 1913, Leonor Michaelis y Maud Leonora Menten propusieron una teoría cuantitativa de la cinética enzimática, que se conoce como cinética de Michaelis-Menten. La principal contribución de Michaelis y Menten fue pensar en las reacciones enzimáticas en dos etapas. En el primero, el sustrato se une reversiblemente a la enzima, formando el complejo enzima-sustrato. Esto a veces se llama complejo Michaelis-Menten en su honor. La enzima luego cataliza el paso químico en la reacción y libera el producto. Este trabajo fue desarrollado aún más por G. E. Briggs y J. B. S. Haldane, quienes derivaron ecuaciones cinéticas que todavía se usan ampliamente en la actualidad.
Las velocidades de las enzimas dependen de las condiciones de la solución y la concentración del sustrato. Para encontrar la velocidad máxima de una reacción enzimática, se aumenta la concentración de sustrato hasta que se observa una tasa constante de formación de producto. Esto se muestra en la curva de saturación a la derecha. La saturación ocurre porque, a medida que aumenta la concentración de sustrato, más y más enzima libre se convierte en el complejo ES unido al sustrato. A la velocidad de reacción máxima (Vmax) de la enzima, todos los sitios activos de la enzima se unen al sustrato y la cantidad de complejo ES es la misma que la cantidad total de enzima
Vmax es solo uno de varios parámetros cinéticos importantes. La cantidad de sustrato necesaria para lograr una determinada velocidad de reacción también es importante. Esto viene dado por la constante de Michaelis-Menten (Km), que es la concentración de sustrato requerida para que una enzima alcance la mitad de su velocidad máxima de reacción; generalmente, cada enzima tiene una característica KM para un sustrato dado. Otra constante útil es kcat, también llamada número de rotación, que es la cantidad de moléculas de sustrato manejadas por un sitio activo por segundo.
La eficiencia de una enzima se puede expresar en términos de kgato/Km. Esto también se llama la constante de especificidad e incorpora las constantes de tarifas para todos los pasos en la reacción hasta e incluyendo el primer paso irreversible. Debido a que la constante de especificidad refleja tanto la afinidad como la capacidad catalítica, es útil para comparar diferentes enzimas entre sí, o la misma enzima con diferentes sustratos. El máximo teórico para la constante de especificidad se llama límite de difusión y es de unos 108 a 109 (M−1 s−1). En este momento cada colisión de la enzima con su sustrato resultará en catalisis, y la tasa de formación de productos no se limita por la tasa de reacción sino por la tasa de difusión. Enzimas con esta propiedad se llaman catalíticamente perfecto o kinetically perfecto. Ejemplo de estas enzimas son la isomerasa triose-phosphate, anhidrasa carbónica, acetilcolinesterasa, catalasa, fumarasa, β-lactamasa y dismutase superóxido. La rotación de estas enzimas puede llegar a varios millones de reacciones por segundo. Pero la mayoría de las enzimas están lejos de ser perfectas: los valores promedio de kcat/Km{displaystyle k_{rm {cat}/K_{rm} {m}} y kcat{displaystyle k_{rm {cat}} sobre 105s− − 1M− − 1{displaystyle 10^{5}{rm} {cHFF} {cHFF} {cH00}} {cH00}} {cH00}} {cH00}} {cH00}}} {cH00}}}} {cH00}}} {cH}}} {cH00}}}}} {cH00}}}}}}} {ccccH}}}}}}}}}}}}}}}}}}}}} {ccccc}}}}}} {ccH}}}}}}}}} {cc}}}}}} {cccccH} {cH}} {ccH}}} {ccccH}}}}}}}}}}} {cH}}}}}} {cH}}}}}}}}}} {ccccccc {M}} {fn} y 10s− − 1{displaystyle 10{rm} {fn}}} {fn}}}, respectivamente.
La cinética de Michaelis-Menten se basa en la ley de acción de masas, que se deriva de los supuestos de difusión libre y colisión aleatoria impulsada termodinámicamente. Muchos procesos bioquímicos o celulares se desvían significativamente de estas condiciones, debido al hacinamiento macromolecular y al movimiento molecular restringido. Extensiones más recientes y complejas del modelo intentan corregir estos efectos.
Inhibición
Las velocidades de reacción de las enzimas se pueden reducir con varios tipos de inhibidores de enzimas.
Tipos de inhibición
Competitivo
Un inhibidor competitivo y un sustrato no pueden unirse a la enzima al mismo tiempo. A menudo, los inhibidores competitivos se parecen mucho al sustrato real de la enzima. Por ejemplo, el fármaco metotrexato es un inhibidor competitivo de la enzima dihidrofolato reductasa, que cataliza la reducción de dihidrofolato a tetrahidrofolato. La similitud entre las estructuras del dihidrofolato y este fármaco se muestra en la figura adjunta. Este tipo de inhibición se puede superar con una alta concentración de sustrato. En algunos casos, el inhibidor puede unirse a un sitio distinto del sitio de unión del sustrato habitual y ejercer un efecto alostérico para cambiar la forma del sitio de unión habitual.
No competitiva
(feminine)Un inhibidor no competitivo se une a un sitio diferente al que se une al sustrato. El sustrato aún se une con su afinidad habitual y, por lo tanto, Km permanece igual. Sin embargo, el inhibidor reduce la eficiencia catalítica de la enzima de modo que se reduce la Vmax. A diferencia de la inhibición competitiva, la inhibición no competitiva no puede superarse con una alta concentración de sustrato.
No competitiva
(feminine)Un inhibidor no competitivo no puede unirse a la enzima libre, solo al complejo enzima-sustrato; por lo tanto, estos tipos de inhibidores son más efectivos a una alta concentración de sustrato. En presencia del inhibidor, el complejo enzima-sustrato es inactivo. Este tipo de inhibición es raro.
Mixta
(feminine)Un inhibidor mixto se une a un sitio alostérico y la unión del sustrato y el inhibidor se afectan entre sí. La función de la enzima se reduce pero no se elimina cuando se une al inhibidor. Este tipo de inhibidor no sigue la ecuación de Michaelis-Menten.
Irreversibles
Un inhibidor irreversible inactiva permanentemente la enzima, generalmente formando un enlace covalente con la proteína. La penicilina y la aspirina son medicamentos comunes que actúan de esta manera.
Funciones de los inhibidores
En muchos organismos, los inhibidores pueden actuar como parte de un mecanismo de retroalimentación. Si una enzima produce demasiado de una sustancia en el organismo, esa sustancia puede actuar como un inhibidor de la enzima al comienzo de la vía que la produce, haciendo que la producción de la sustancia disminuya o se detenga cuando hay una cantidad suficiente. Esta es una forma de retroalimentación negativa. Las principales vías metabólicas, como el ciclo del ácido cítrico, hacen uso de este mecanismo.
Dado que los inhibidores modulan la función de las enzimas, a menudo se utilizan como fármacos. Muchos de estos medicamentos son inhibidores competitivos reversibles que se asemejan al sustrato nativo de la enzima, similar al metotrexato anterior; otros ejemplos bien conocidos incluyen las estatinas que se usan para tratar el colesterol alto y los inhibidores de la proteasa que se usan para tratar infecciones retrovirales como el VIH. Un ejemplo común de un inhibidor irreversible que se usa como fármaco es la aspirina, que inhibe las enzimas COX-1 y COX-2 que producen la prostaglandina, mensajera de la inflamación. Otros inhibidores de enzimas son venenos. Por ejemplo, el veneno cianuro es un inhibidor enzimático irreversible que se combina con el cobre y el hierro en el sitio activo de la enzima citocromo c oxidasa y bloquea la respiración celular.
Factores que afectan la actividad enzimática
Como las enzimas están formadas por proteínas, sus acciones son sensibles a los cambios en muchos factores fisicoquímicos, como el pH, la temperatura, la concentración de sustrato, etc.
La siguiente tabla muestra el pH óptimo para varias enzimas.
| Enzyme | Optimum pH | p H descripción |
|---|---|---|
| Pepsin | 1.5 a 1,6 | Altamente ácido |
| Inversión | 4.5 | Acidic |
| Lipase (stomach) | 4.0–5.0 | Acidic |
| Lipase (aceite de cántor) | 4.7 | Acidic |
| Lipase (pancreas) | 8.0 | Alkaline |
| Amylase (malt) | 4.6–5.2 | Acidic |
| Amylase (pancreas) | 6.7-7.0 | Acidic-neutral |
| Cellobiase | 5.0 | Acidic |
| Maltase | 6.1 a 6.8 | Acidic |
| Sucrase | 6.2 | Acidic |
| Catalase | 7.0 | Neutral |
| Urease | 7.0 | Neutral |
| Cholinesterase | 7.0 | Neutral |
| Ribonucleasa | 7.0-7.5 | Neutral |
| Fumarase | 7.8 | Alkaline |
| Trypsin | 7.8 a 8.7 | Alkaline |
| Adenosine triphosphate | 9.0 | Alkaline |
| Arginase | 10.0 | Highly alkaline |
Función biológica
Las enzimas cumplen una amplia variedad de funciones dentro de los organismos vivos. Son indispensables para la transducción de señales y la regulación celular, a menudo a través de quinasas y fosfatasas. También generan movimiento, con miosina hidrolizando ATP para generar contracción muscular, y también transportan carga alrededor de la célula como parte del citoesqueleto. Otras ATPasas en la membrana celular son bombas de iones involucradas en el transporte activo. Las enzimas también están involucradas en funciones más exóticas, como la luciferasa que genera luz en las luciérnagas. Los virus también pueden contener enzimas para infectar células, como la integrasa del VIH y la transcriptasa inversa, o para la liberación viral de las células, como la neuraminidasa del virus de la influenza.
Una función importante de las enzimas es en los sistemas digestivos de los animales. Las enzimas como las amilasas y las proteasas descomponen las moléculas grandes (almidón o proteínas, respectivamente) en otras más pequeñas, para que puedan ser absorbidas por los intestinos. Las moléculas de almidón, por ejemplo, son demasiado grandes para ser absorbidas por el intestino, pero las enzimas hidrolizan las cadenas de almidón en moléculas más pequeñas, como maltosa y, finalmente, glucosa, que luego se pueden absorber. Diferentes enzimas digieren diferentes sustancias alimenticias. En los rumiantes, que tienen dietas herbívoras, los microorganismos en el intestino producen otra enzima, la celulasa, para descomponer las paredes celulares de celulosa de la fibra vegetal.
Metabolismo
Varias enzimas pueden trabajar juntas en un orden específico, creando vías metabólicas. En una ruta metabólica, una enzima toma el producto de otra enzima como sustrato. Después de la reacción catalítica, el producto pasa a otra enzima. A veces, más de una enzima puede catalizar la misma reacción en paralelo; esto puede permitir una regulación más compleja: con, por ejemplo, una actividad constante baja proporcionada por una enzima pero una actividad alta inducible de una segunda enzima.
Las enzimas determinan qué pasos ocurren en estas vías. Sin enzimas, el metabolismo no progresaría a través de los mismos pasos y no podría regularse para satisfacer las necesidades de la célula. La mayoría de las vías metabólicas centrales están reguladas en unos pocos pasos clave, generalmente a través de enzimas cuya actividad implica la hidrólisis de ATP. Debido a que esta reacción libera tanta energía, otras reacciones que son termodinámicamente desfavorables pueden acoplarse a la hidrólisis de ATP, impulsando la serie general de reacciones metabólicas vinculadas.
Control de actividad
Hay cinco formas principales en que la actividad enzimática se controla en la célula.
Regulación
Las enzimas pueden ser activadas o inhibidas por otras moléculas. Por ejemplo, los productos finales de una vía metabólica suelen ser inhibidores de una de las primeras enzimas de la vía (generalmente el primer paso irreversible, llamado paso comprometido), regulando así la cantidad de producto final elaborado por las vías. Tal mecanismo regulador se llama mecanismo de retroalimentación negativa, porque la cantidad del producto final producido está regulada por su propia concentración. El mecanismo de retroalimentación negativa puede ajustar efectivamente la tasa de síntesis de metabolitos intermedios de acuerdo con las demandas de las células. Esto ayuda con asignaciones efectivas de materiales y economía de energía, y evita la fabricación excesiva de productos finales. Al igual que otros dispositivos homeostáticos, el control de la acción enzimática ayuda a mantener un ambiente interno estable en los organismos vivos.
Modificación postraduccional
Ejemplos de modificación postraduccional incluyen fosforilación, miristoilación y glicosilación. Por ejemplo, en la respuesta a la insulina, la fosforilación de múltiples enzimas, incluida la glucógeno sintasa, ayuda a controlar la síntesis o degradación del glucógeno y permite que la célula responda a los cambios en el azúcar en la sangre. Otro ejemplo de modificación postraduccional es la escisión de la cadena polipeptídica. La quimotripsina, una proteasa digestiva, se produce en forma inactiva como quimotripsinógeno en el páncreas y se transporta de esta forma al estómago donde se activa. Esto evita que la enzima digiera el páncreas u otros tejidos antes de que ingrese al intestino. Este tipo de precursor inactivo de una enzima se conoce como zimógeno o proenzima.
Cantidad
Una célula puede aumentar o disminuir la producción de enzimas (transcripción y traducción de genes de enzimas) en respuesta a cambios en el entorno de la célula. Esta forma de regulación génica se denomina inducción enzimática. Por ejemplo, las bacterias pueden volverse resistentes a los antibióticos como la penicilina porque se inducen enzimas llamadas betalactamasas que hidrolizan el anillo betalactámico crucial dentro de la molécula de penicilina. Otro ejemplo proviene de las enzimas del hígado llamadas citocromo P450 oxidasas, que son importantes en el metabolismo de los fármacos. La inducción o inhibición de estas enzimas puede provocar interacciones farmacológicas. Los niveles de enzima también se pueden regular cambiando la tasa de degradación de la enzima. Lo opuesto a la inducción enzimática es la represión enzimática.
Distribución subcelular
Las enzimas se pueden compartimentar, con diferentes rutas metabólicas que ocurren en diferentes compartimentos celulares. Por ejemplo, los ácidos grasos son sintetizados por un conjunto de enzimas en el citosol, el retículo endoplásmico y el aparato de Golgi y son utilizados por un conjunto diferente de enzimas como fuente de energía en la mitocondria, a través de la β-oxidación. Además, el tránsito de la enzima a diferentes compartimentos puede cambiar el grado de protonación (p. ej., el citoplasma neutro y el lisosoma ácido) o el estado oxidativo (p. ej., periplasma oxidante o citoplasma reductor), lo que a su vez afecta la actividad enzimática. A diferencia de la partición en orgánulos unidos a la membrana, la localización subcelular de enzimas también puede alterarse mediante la polimerización de enzimas en filamentos citoplasmáticos macromoleculares.
Especialización en órganos
En los eucariotas multicelulares, las células de diferentes órganos y tejidos tienen diferentes patrones de expresión génica y, por lo tanto, tienen diferentes conjuntos de enzimas (conocidas como isoenzimas) disponibles para las reacciones metabólicas. Esto proporciona un mecanismo para regular el metabolismo general del organismo. Por ejemplo, la hexoquinasa, la primera enzima en la ruta de la glucólisis, tiene una forma especializada llamada glucoquinasa expresada en el hígado y el páncreas que tiene una menor afinidad por la glucosa pero es más sensible a la concentración de glucosa. Esta enzima está involucrada en la detección del azúcar en la sangre y en la regulación de la producción de insulina.
Implicación en la enfermedad
Dado que el control estricto de la actividad enzimática es esencial para la homeostasis, cualquier mal funcionamiento (mutación, sobreproducción, producción insuficiente o eliminación) de una sola enzima crítica puede conducir a una enfermedad genética. El mal funcionamiento de un solo tipo de enzima de los miles de tipos presentes en el cuerpo humano puede ser fatal. Un ejemplo de una enfermedad genética mortal debida a insuficiencia enzimática es la enfermedad de Tay-Sachs, en la que los pacientes carecen de la enzima hexosaminidasa.
Un ejemplo de deficiencia enzimática es el tipo más común de fenilcetonuria. Muchas mutaciones diferentes de un solo aminoácido en la enzima fenilalanina hidroxilasa, que cataliza el primer paso en la degradación de la fenilalanina, dan como resultado la acumulación de fenilalanina y productos relacionados. Algunas mutaciones están en el sitio activo, interrumpiendo directamente la unión y la catálisis, pero muchas están lejos del sitio activo y reducen la actividad desestabilizando la estructura de la proteína o afectando la oligomerización correcta. Esto puede conducir a una discapacidad intelectual si la enfermedad no se trata. Otro ejemplo es la deficiencia de pseudocolinesterasa, en la que se ve afectada la capacidad del cuerpo para descomponer los fármacos de éster de colina. La administración oral de enzimas se puede utilizar para tratar algunas deficiencias de enzimas funcionales, como la insuficiencia pancreática y la intolerancia a la lactosa.
Otra forma en que el mal funcionamiento de las enzimas puede causar enfermedades proviene de las mutaciones de la línea germinal en los genes que codifican las enzimas de reparación del ADN. Los defectos en estas enzimas causan cáncer porque las células son menos capaces de reparar las mutaciones en sus genomas. Esto provoca una acumulación lenta de mutaciones y da como resultado el desarrollo de cánceres. Un ejemplo de un síndrome de cáncer hereditario de este tipo es el xeroderma pigmentoso, que provoca el desarrollo de cánceres de piel en respuesta incluso a una exposición mínima a la luz ultravioleta.
Evolución
Al igual que cualquier otra proteína, las enzimas cambian con el tiempo a través de mutaciones y divergencias de secuencia. Dado su papel central en el metabolismo, la evolución de las enzimas juega un papel crítico en la adaptación. Por lo tanto, una pregunta clave es si las enzimas pueden cambiar sus actividades enzimáticas y cómo pueden hacerlo. En general, se acepta que muchas actividades enzimáticas nuevas han evolucionado a través de la duplicación de genes y la mutación de las copias duplicadas, aunque la evolución también puede ocurrir sin duplicación. Un ejemplo de una enzima que ha cambiado su actividad es el ancestro de la metionil amino peptidasa (MAP) y la creatina amidinohidrolasa (creatinasa), que son claramente homólogos pero catalizan reacciones muy diferentes (MAP elimina la metionina amino-terminal en nuevas proteínas, mientras que la creatinasa hidroliza la creatina). sarcosina y urea). Además, MAP depende de los iones metálicos, mientras que la creatinasa no, por lo que esta propiedad también se perdió con el tiempo. Pequeños cambios de actividad enzimática son extremadamente comunes entre las enzimas. En particular, la especificidad de unión al sustrato (ver arriba) puede cambiar fácil y rápidamente con cambios de un solo aminoácido en sus bolsillos de unión al sustrato. Esto se ve con frecuencia en las principales clases de enzimas, como las quinasas.
La evolución artificial (in vitro) ahora se usa comúnmente para modificar la actividad enzimática o la especificidad para aplicaciones industriales (ver más abajo).
Aplicaciones industriales
Las enzimas se utilizan en la industria química y otras aplicaciones industriales cuando se requieren catalizadores extremadamente específicos. Las enzimas en general están limitadas en el número de reacciones que han evolucionado para catalizar y también por su falta de estabilidad en disolventes orgánicos ya altas temperaturas. Como consecuencia, la ingeniería de proteínas es un área activa de investigación e implica intentos de crear nuevas enzimas con propiedades novedosas, ya sea a través del diseño racional o de la evolución in vitro. Estos esfuerzos han comenzado a tener éxito, y ahora se han diseñado algunas enzimas 'desde cero'. para catalizar reacciones que no ocurren en la naturaleza.
| Aplicación | Enzimas utilizados | Usos |
|---|---|---|
| Industria biocombustible | Celulases | Descomponer la celulosa en azúcares que pueden ser fermentados para producir etanol celulósico. |
| Ligninases | Pretratamiento de biomasa para la producción de biocombustibles. | |
| Detergente biológico | Proteas, amilas, lipasas | Retire las manchas de proteína, almidón y grasa o aceite de la ropa y el desguace. |
| Mannanases | Eliminar las manchas de alimentos de la goma de guar de alimentos comunes. | |
| Industria manufacturera | Amylase, glucanases, proteases | Dividir polisacáridos y proteínas en la malta. |
| Betaglucanases | Mejorar las características de filtración de la hierba y la cerveza. | |
| Amyloglucosidase y poleulanas | Hacer cerveza baja en calorías y ajustar la fermentabilidad. | |
| Acetolactate decarboxylase (ALDC) | Aumentar la eficiencia de la fermentación reduciendo la formación diacetil. | |
| Usos culinarios | Papain | Tenderizar la carne para cocinar. |
| Industria láctea | Rennin | Proteína de hidrógeno en la fabricación de queso. |
| Lipases | Produce queso Camembert y quesos azules como Roquefort. | |
| Procesamiento de alimentos | Amylases | Producir azúcares de almidón, como en hacer jarabe de maíz de alta fructosa. |
| Proteas | Bajar el nivel de proteína de la harina, como en la elaboración de galletas. | |
| Trypsin | Fabricación de alimentos hipoalergénicos para bebés. | |
| Celulases, pectinasas | Zumos de fruta claros. | |
| Biología molecular | Nucleasas, ligasa de ADN y polimeras | Use la digestión de restricción y la reacción de cadena de polimerasa para crear ADN recombinante. |
| Industria papelera | Xylanases, hemicellulas y peróxidos de lignino | Quitar el lignin de la pulpa de kraft. |
| Atención personal | Proteas | Quitar proteínas en lentes de contacto para prevenir infecciones. |
| Industria estelar | Amylases | Convertir almidón en glucosa y varios jarabes. |
Contenido relacionado
Rata
Galvanización
Vaso