Enol
Los enoles, o más formalmente, los alquenoles, son un tipo de estructura reactiva o intermedio en química orgánica que se representa como un alqueno (olefina) con un grupo hidroxilo unido a un extremo del doble enlace alqueno. Los términos enol y alquenol son acrónimos derivados de "-eno"/"alqueno" y el sufijo "-ol" que indica el grupo hidroxilo de los alcoholes, eliminando la "-e" terminal del primer término. La generación de enoles a menudo implica la eliminación de un hidrógeno adyacente (α -) al grupo carbonilo, es decir, la desprotonación, su eliminación como protón, H. Cuando este protón no se devuelve al final del proceso paso a paso, el resultado es un anión denominado enolato (ver imágenes a la derecha). Las estructuras de enolato que se muestran son esquemáticas; una representación más moderna considera los orbitales moleculares que están formados y ocupados por electrones en el enolato. De manera similar, la generación del enol a menudo va acompañada de "atrapamiento" o enmascaramiento del grupo hidroxi como un éter, como un silil enol éter.
En química orgánica, el tautomerismo ceto-enol se refiere a un equilibrio químico entre una forma ceto (una cetona o un aldehído) y un enol (un alcohol). Se dice que las formas ceto y enol son tautómeros entre sí. La interconversión de las dos formas implica el movimiento de un átomo de hidrógeno alfa y la reorganización de los electrones de enlace; por lo tanto, la isomería califica como tautomerismo.
Enolización
Los ésteres orgánicos, las cetonas y los aldehídos con un hidrógeno α (enlace CH adyacente al grupo carbonilo) a menudo forman enoles. La reacción implica la migración de un protón del carbono al oxígeno:RC(O)CHR' 2<img src="https://wikimedia.org/api/rest_v1/media/math/render/svg/c78d3cd51f1e83cb464dcf6fec2e692339f2c642" alt="{displaystyle {ce {<}}}"> RC(OH)=CR' 2
En el caso de las cetonas, la conversión se denomina tautomerismo ceto-enólico, aunque este nombre suele aplicarse de forma más general a todas estas tautomerizaciones. Por lo general, la constante de equilibrio es tan pequeña que el enol es indetectable espectroscópicamente.
En algunos compuestos con dos (o más) carbonilos, la forma enólica se vuelve dominante. El comportamiento de la 2,4-pentanodiona ilustra este efecto:
| carbonilo | enol | enolización _ |
|---|---|---|
| CH 3 CHO | CH 2 =CHOH | 5,8x10 |
| CH 3 C(O)CH 3 | CH3C (OH)= CH2 | 5,12x10 |
| CH 3 CO 2 CH 3 | CH2 = CH(OH)OCH3 | 4x10 |
| C 6 H 5 C(O)CH 3 | C6H5C (OH ) = CH2 | 1x10 |
| CH 3 C(O)CH 2 C(O)CH 3 | CH3C (O)CH=C(OH ) CH3 | 0.27 |
Los enoles son derivados del alcohol vinílico, con conectividad C=C-OH. La desprotonación de carbonilos orgánicos da el anión enolato, que es un nucleófilo fuerte. Un ejemplo clásico de favorecer la forma ceto puede verse en el equilibrio entre el alcohol vinílico y el acetaldehído (K = [enol]/[ceto] ≈ 3 × 10). En las 1,3-dicetonas, como la acetilacetona (2,4-pentanodiona), se prefiere la forma enol.
La conversión catalizada por ácido de un enol a la forma ceto procede por la transferencia de protones del O al carbono. El proceso no ocurre intramolecularmente, sino que requiere la participación de solventes u otros mediadores.
Estereoquímica de la cetonización
Si R y R (nota la ecuación en la parte superior de la página) son sustituyentes diferentes, se forma un nuevo estereocentro en la posición alfa cuando un enol se convierte a su forma ceto. Según la naturaleza de los tres grupos R, los productos resultantes en esta situación serían diastereoisómeros o enantiómeros.
Enodioles
Los enodioles son alquenos con un grupo hidroxilo en cada carbono del doble enlace C=C. Normalmente tales compuestos son componentes desfavorecidos en equilibrio con las aciloínas. Un caso especial es el catecol, donde la subunidad C=C es parte de un anillo aromático. Sin embargo, en algunos otros casos, los enodioles se estabilizan por grupos carbonilo flanqueantes. Estos enodioles estabilizados se denominan reductonas. Tales especies son importantes en la glicoquímica, por ejemplo, la transformación de Lobry de Bruyn-van Ekenstein.
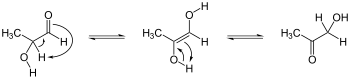
Tautomerizaciones de ceto-enediol. Enediol en el centro; isómeros de aciloína a izquierda y derecha. Ex. es hidroxiacetona, que se muestra a la derecha.
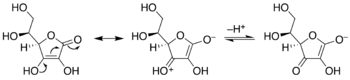 Conversión de ácido ascórbico (vitamina C) a un enolato. Enodiol a la izquierda, enolato a la derecha, que muestra el movimiento de pares de electrones que resultan en la desprotonación del enodiol padre estable. Un sistema químico distinto y más complejo, que exhibe la característica de la vinilología.
Conversión de ácido ascórbico (vitamina C) a un enolato. Enodiol a la izquierda, enolato a la derecha, que muestra el movimiento de pares de electrones que resultan en la desprotonación del enodiol padre estable. Un sistema químico distinto y más complejo, que exhibe la característica de la vinilología.
La ribulosa-1,5-bisfosfato es un sustrato clave en el ciclo de fotosíntesis de Calvin. En el ciclo de Calvin, la ribulosa se equilibra con el enediol, que luego se une al dióxido de carbono. El mismo enediol también es susceptible al ataque del oxígeno (O 2) en el (indeseable) proceso llamado fotorrespiración.
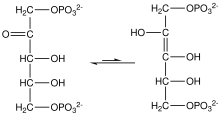 Equilibrio de ceto-enodiol para ribulosa-1,5-bisfosfato.
Equilibrio de ceto-enodiol para ribulosa-1,5-bisfosfato.
Fenoles
Los fenoles representan un tipo de enol. Para algunos fenoles y compuestos relacionados, el tautómero ceto juega un papel importante. Muchas de las reacciones del resorcinol involucran al cetotautómero, por ejemplo. El naftaleno-1,4-diol existe en un equilibrio observable con la dicetona tetrahidronaftaleno-1,4-diona.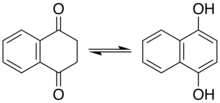
Bioquímica
El tautomerismo de ceto-enol es importante en varias áreas de la bioquímica.
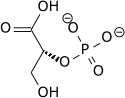
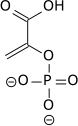
El alto potencial de transferencia de fosfato del fosfoenolpiruvato resulta del hecho de que el compuesto fosforilado está "atrapado" en la forma enol menos favorable termodinámicamente, mientras que después de la desfosforilación puede asumir la forma ceto.
La enzima enolasa cataliza la deshidratación del ácido 2-fosfoglicérico al éster de fosfato de enol. El metabolismo de PEP a ácido pirúvico por la piruvato quinasa (PK) genera trifosfato de adenosina (ATP) a través de la fosforilación a nivel de sustrato.
 |  |  | ||
| H2O _ _ | ADP | atp | ||
 |  | |||
| H2O _ _ | ||||
Reactividad
Adición de electrófilos
El término del doble enlace en los enoles es nucleófilo. Sus reacciones con compuestos orgánicos electrofílicos son importantes tanto en bioquímica como en química orgánica sintética. En la primera área, la fijación de dióxido de carbono implica la adición de CO 2 a un enol.
Desprotonación: enolatos
La desprotonación de cetonas, aldehídos y ésteres enolizables da enolatos. Los enolatos pueden quedar atrapados mediante la adición de electrófilos en el oxígeno. La sililación da silil enol éter. La acilación da ésteres como el acetato de vinilo.
Enoles estables
En general, los enoles son menos estables que sus cetoequivalentes debido a la preferencia del doble enlace C=O sobre el doble enlace C=C. Sin embargo, los enoles se pueden estabilizar cinética o termodinámicamente.
Algunos enoles están lo suficientemente cinéticamente estabilizados para que puedan caracterizarse.
La deslocalización puede estabilizar el tautómero enol. Así, los enoles muy estables son los fenoles. Otro factor estabilizador en los 1,3-dicarbonilos es el enlace de hidrógeno intramolecular. Ambos factores influyen en el equilibrio enol-diona en la acetilacetona.
Contenido relacionado
Transición de fase
Ferrocianuro de potasio
Actinio